Чем обусловлено явление аллотропии
Общее понятие
Аллотропия проявляется, благодаря разному составу микрочастиц простой материи и координируется вариантом размещения молекул и атомов в кристаллической решетке. Вещество кристаллизуется в нескольких модификациях, при этом два параметра простой ячейки совпадают. Изменение состояния происходит из-за отличия третьего показателя, который учитывает расстояние между сопредельными слоями.
Явление часто обнаруживается в структурах, которые равнозначны гексагональному и кубическому расположению атомов. Соседняя атомная среда представляет эквивалентное окружение, а различия проявляются на удаленных сферах. Энергетические характеристики решеток приблизительно равны, поэтому физические свойства разных состояний одного элемента остаются похожими.
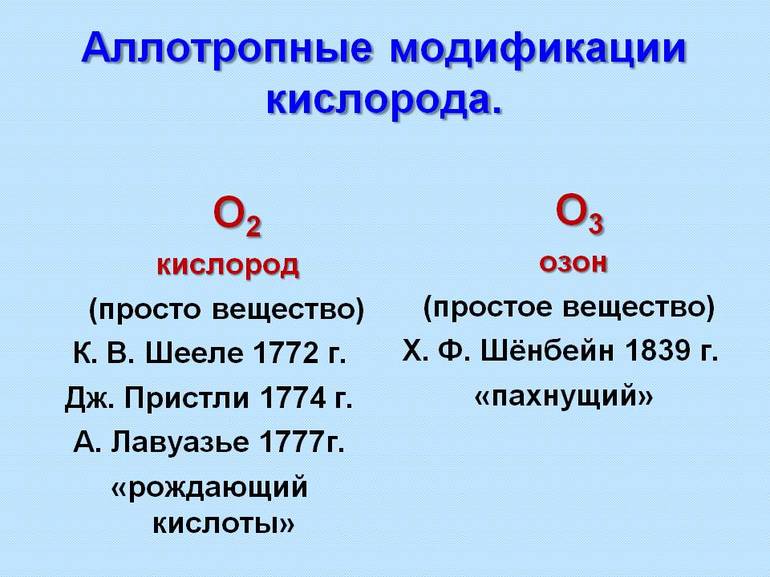
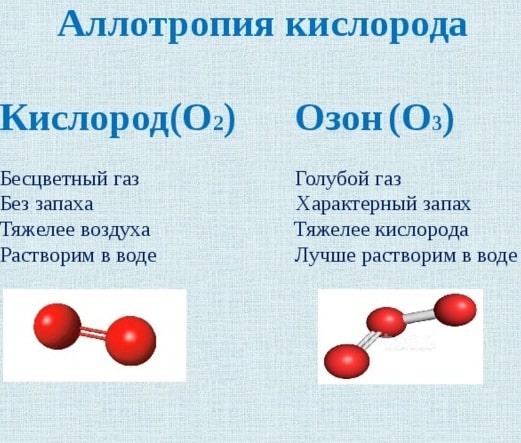
Первые примеры аллотропных модификаций показал шведский минералог и химик Берцелиус середине XIX века для выделения различных форм нахождения элемента. Через 2 десятка лет была принята гипотеза итальянского химика А. Авогадро о многоатомных молекулах и стало видно, что от строения частиц зависит проявление элемента в материи. Например, О3 — озон, а О2 — кислород.
В 1912 году ученые определили, что различия в структуре простых элементов, например, фосфора или углерода, относятся к первопричинам существования двух и более состояний. В настоящее время аллотропией называется видоизменение простых материй, независимо от агрегатного вида. Изменения в твердых состояниях сложных и простых веществ имеет название полиморфизма. Два определения совпадают, если речь идет о простых материалах в твердом виде (железо, сера в кристаллах, фосфор).
Реорганизация веществ
Продолжаются открытия видов простых материалов, способных к аллотропии, несмотря на то, что список образовательных веществ уже превышает 400 материалов. Типы химических связей в элементарных частицах зависят от строения атома, вместе эти характеристики определяют возможность вещества образовывать разные аллотропные формы.
Компоненты, которые могут изменять показатель координационного числа и стадии окисления, образовывают большее количество аллотропных состояний. Важным фактором разнообразия форм является способность элемента к образованию гомоцепных решеток (состоящих из однотипных атомов).
Преобразование простых элементов
Более выраженными являются аллотропные модификации неметаллов, но среди веществ этой группы имеются исключения, например, благородные газы и галогены. Некоторые состояния отличаются температурной стабильностью, другие характеризуются фазовой динамикой. Такие различия объясняются затратами некоторой энергии при изменении кристаллической решетки в результате плавления.
Примеры реорганизации неметаллов:
Разные состояния одного компонента обозначаются строчными литерами греческой латиницы для написания в формулах. Низкотемпературные формы отмечаются буквой α, следующие состояния по показателям обозначаются β и дальше по такому принципу.
Модификации полупроводников
К этой группе относятся элементы, располагающиеся в таблице на переходе от металлов к неметаллам. У материалов присутствует кристаллическая ковалентная решетка, чаще они характеризуются проводимостью по типу металлов. Иногда материалы работают как полупроводники.
Примеры трансформации неметаллов:
К особенностям относится слабое сочетание зоны проводимости и валентной области. Это обеспечивает электропроводность до того времени, пока температура не снизится до 0ºС. Нагревание способствует увеличению электронных дырок (обладателей тока), но видоизменение идет слабо. Положительные квазичастицы в полуметаллах активно двигаются при малой полезной массе. По этой причине материалы больше других веществ подходят для изготовления фазовых переходов в магнитных полях большой силы, наблюдения квантовых и классических размерных эффектов.
Особенности видоизменения металлов
Металлы образовывают различные состояния при увеличении давления или в случае технологической обработки. Аллотропной модификацией металлов называется возможность материала в твердой форме образовывать различные виды кристаллических решеток. Процесс перехода от одной структуры к другой рассматривается в виде превращения.
Обследование структуры производится способом микроанализа, делается ультразвуковая, магнитная и рентгеновская дефектоскопия.
Микроанализ проводится на основе снятия микрошлифов, которые перед исследованием полируются до блеска. Вывод о структуре делается после рассмотрения срезов под микроскопом после травления. Шлифы показывают границы зерен из-за неодинаковой обработки основного слоя и рельефных выступов. Анализ выявляет форму и размеры частиц, инородные включения.
Рентген дает понятие об атомном строении материала, типе кристаллической структуры, дефектах решеток. Для исследования используется свойство рядов отражать гамма-лучи. При магнитном способе поверхность металла намагничивается и покрывается железным порошком. После размагничивания слой показывает очертания решетки.
Ультразвук применяется для эффективного обнаружения качественного преобразования металла в требуемую аллотропную модификацию. Волновое излучение распространяется внутрь и отражается от элементов решетки.
Примеры аллотропии
При нагревании металлов в процессе превращения поглощается тепло, при этом изменение решеточной конструкции происходит при одной и той же температуре. Аллотропным модификациям подвергаются многие металлы, например, титан, железо, олово и др. Железо при нагревании до +1390ºС характеризуется гранецентрированной решеткой. Повышение температуры до +1540ºС ведет к перестройке до центрировано-кубической структуры.
Аллотропные модификации металлов:
Определенные свойства твердых элементов зависят не только от строения решетки и дефектов, но и от структуры микрочастиц, их состава, размера и формы. Конструкция кристаллов оказывает влияние на физические характеристики тела и предопределяет пределы деформационной пластики, твердость материала.
Обратимые и непоправимые переходы
В случае изменения температурных показателей и параметров давления твердые материалы переходят из одной структуры в другую без перемены количественного состава элементов. Предпосылками является подвижность частиц решетки и перенос некоторого количества вещества, вызванный дефектами строения твердого состояния.
Примеры переходов:
Проводят разработанную методику трехфазной реакции для направленного получения требуемой решеточной структуры. Выбор нагревательного режима и продолжительность повышения температуры ускоряет рост кристаллов до больших зерен, что улучшает качество. Изменение способа обработки направляется иногда на снижение активности катализаторов в результате процесса рекристаллизации.
Энантиотропное видоизменение возникает при нулевой температуре и выбранном давлении. Иногда аллотропное преобразование относится к необратимым и одно из состояний материала является неустойчивым в термическом плане. Эта фаза сохраняется на всем температурном интервале от абсолютного нуля и называется монотропным. При получении серого олова из белого происходит обратимое преобразование, а превращение алмаза в графит становится необратимым.
Отличие этих типов превращений — в технологических особенностях проведения. Энантиотропные переходы модификации А чаще получаются методом постепенного охлаждения сплава. Сначала масса кристаллизуется в виде состояния Б, которое затем видоизменяется в устойчивую фазу к низким температурам.
При монотропном переходе в случае охлаждения сплава образуется только вещество в состоянии А. Требуется особый технологический режим со строгим дозированием понижения температуры и давления для получения модификации Б. Примером служит получение стабильного черного фосфора из белого путем нагревания до + 200ºС и повышения давления до 1,25 ГПа. После помещения полученного образца в нормальные условия обратного преобразования не происходит.
Химия изучает свойства и строение простых веществ. В большинстве своем они остаются неизменными в любых ситуациях. Однако есть ряд элементов, способных менять свои свойства в различных своих состояниях. Такое явление называется аллотропией. Знание о поведении элементов, подверженных аллотропии, расширяет понимание устройства мира и поведения в нем веществ и элементов.
Определение
Виды аллотропии
Каким веществам свойственна аллотропия
Не все вещества способны преобразоваться из сложных в простые даже под действием температур или других воздействий. Это может происходить только с теми из них, у которых есть способность к образованию гомоцепных структур или хорошо окисляющихся. Именно поэтому аллотропия веществ свойственна неметаллам. Хотя справедливости ради следует сказать, что есть металлы, способные преобразовываться в простые элементы, но это, скорее, полуметаллы.
Примеры аллотропии
Как уже упоминалось, явление аллотропии свойственно и некоторым металлам. Но из-за сложности их структуры переходы из одного в другое состояние могут чередоваться. Например, в нормальных условиях белое олово является пластичным металлом, но при нагревании его при температуре 173 градуса по Цельсию оно перестраивает свою кристаллическую решетку до очень хрупкого состояния, а при снижении температуры до 13 градусов кристаллическая решетка принимает вид кубической алмазоподобной и делает вещество порошкообразным.
Модификации неметаллов
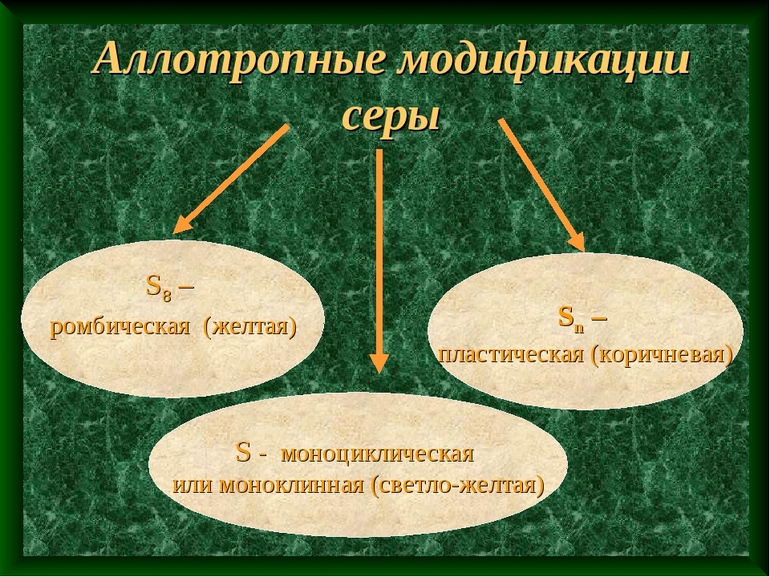
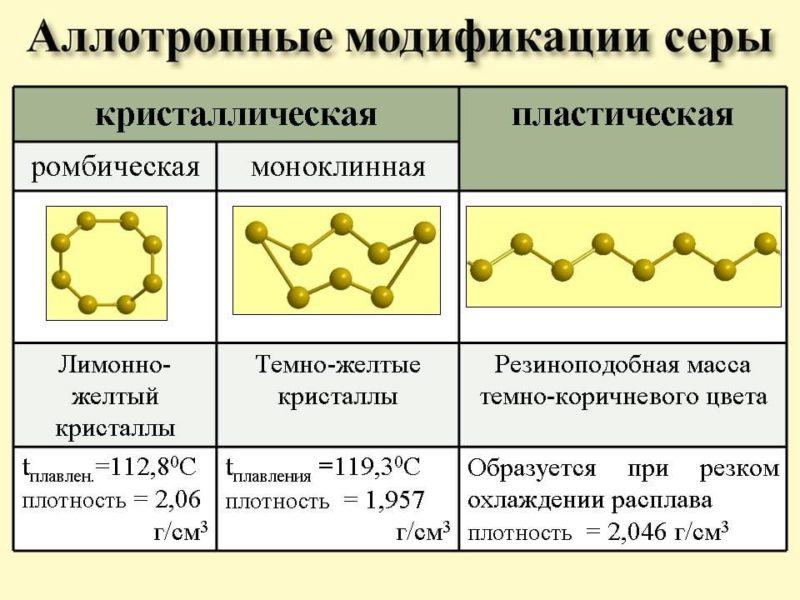
Аллотропия характерна для серы. В нормальных условиях структура вещества моноклинная, а под воздействием температур может преобразоваться в пластическую и следом за этим в ромбовидную.
Модификации полуметаллов
Аморфным и кристаллическим бывает кремний. Сурьма в четырех формах по своей структуре представляется металлом, и в трех она аморфная, аллотропная.
Как и в случае с фосфором или селеном, мышьяк бывает серый или черный, в зависимости от формы – полимер или неметаллическая структура.
Модификации металлов
Самым широким спектром форм среди металлов обладает железо. В первом виде феррита, с характерной объемно-центрированной кубической кристаллической решеткой, железо способно существовать в температурных пределах от 0 до 769 градусов по Цельсию. Имеет свойства ферромагнетиков.
Второй тип феррита существует при температурах в диапазоне 769-917 градусов по Цельсию. Отличается объемно-центрированной кубической кристаллической решеткой. Магнетические свойства проявляет как парамагнетик.
Третий тип железа называется аустенит, характерен гранецентрированной кубической кристаллической решеткой. Способен существовать только при температурах от 917 до 1394 градусов по Цельсию. Магнитных свойств не имеет.
Четвертый тип железа возникает при температурах свыше 1397 градусов по Цельсию. Магнитных свойств не имеет, характерен объемно-центрированной кубической кристаллической решеткой.
Заключение
Все металлы, полуметаллы и неметаллы различных аллотропных типов с характерным строением кристаллических решеток, массой, количеством и зарядом протонов и нейтронов могут встречаться в природе в чистом, натуральном виде или получаются только в лаборатории. В обычных условиях они не сохраняют своей стабильности. Все это говорит о многообразии химических элементов и перспективах открытий новых доселе неизвестных науке форм и типов веществ. Такие исследования ведут к развитию всех отраслей жизнедеятельности человека.
Аллотропия
Аллотро́пия (от др.-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам — так называемых аллотропических (аллотропных) модификаций или форм.
Явление аллотропии обусловлено либо различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы).
Содержание
История
Понятие аллотропии введено в науку Й. Берцелиусом в 1841 году для обозначения разных форм существования элементов; одновременно он предполагал, по-видимому, применить его и к изомерии соединений. После принятия гипотезы А. Авогадро в 1860 году стало понятно, что элементы могут существовать в виде многоатомных молекул, например, О2 — кислород и О3 — озон.
Примеры аллотропии
В настоящее время известно более 400 разновидностей простых веществ. Способность элемента к образованию аллотропных форм обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов.
Как правило, большее число аллотропных форм образуют элементы, имеющие переменные значения координационного числа или степени окисления (олово, фосфор). Другим важным фактором является катенация — способность атомов элемента образовывать гомоцепные структуры (например, сера). Склонность к аллотропии более выражена у неметаллов, за исключением галогенов и благородных газов, и полуметаллов.
Принято обозначать различные аллотропические формы одного и того же элемента строчными буквами греческого алфавита; причём форму, существующую при самых низких температурах, обозначают буквой α, следующую — β и т. д.
Неметаллы
Водород может существовать в виде орто- и пара-водорода. В молекуле орто-водорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины параллельны, а у пара-водорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — антипараллельны.
Множество модификаций: алмаз, графит, фуллерен, карбин, графен, углеродные нанотрубки, лонсдейлит и др. Точное число модификаций указать затруднительно вследствие разнообразия форм связывания атомов углерода между собой. Наиболее многочисленны молекулярные структуры фуллеренов и нанотрубок.
Известно 11 аллотропных модификаций фосфора. Основные модификации: белый, красный и чёрный фосфор. Белый фосфор ядовит, светится в темноте, способен самовоспламеняться, красный фосфор не ядовит, не светится в темноте, сам по себе не воспламеняется.
Две аллотропные модификации: О2 — кислород и О3 — озон. Кислород бесцветен, не имеет запаха; озон имеет выраженный запах, имеет бледно-фиолетовый цвет, он более бактерициден.
Большое число аллотропных модификаций, второе место после углерода. Основные модификации: ромбическая, моноклинная и пластическая сера.
Красный цикло-Se8, серый полимер Se и чёрный селен.
Полуметаллы
Бор существует в аморфном и кристаллическом видах. Аморфный бор – порошок бурого цвета. Обладает большей реакционной способностью, чем кристаллический бор. Кристаллический бор – вещество черного цвета. Известно более 10 аллотропных модификаций бора, которые кристаллизуются в ромбической и тетрагональной сингониях. Наиболее устойчивая модификация – β-ромбический бор – состоит из икосаэдров B12, которые образуют слои, объединенные в бесконечную структуру.
Известны четыре металлических аллотропных модификаций сурьмы, существующих при различных давлениях, и три аморфные модификации (взрывчатая, чёрная и жёлтая сурьма), из которых наиболее устойчива металлическая форма серебристо-белого цвета с синеватым оттенком
Полоний существует в двух аллотропных металлических модификациях. Кристаллы одной из них – низкотемпературной – имеют кубическую решетку (α-Po), а другой – высокотемпературной – ромбическую (β-Po). Фазовый переход из одной формы в другую происходит при 36 °C, однако при обычных условиях полоний находится в высокотемпературной форме вследствие разогрева собственным радиоактивным излучением.
Металлы
Среди металлов, которые встречаются в природе в больших количествах (до U, без Tc и Pm), 28 имеют аллотропные формы при атмосферном давлении: Li, Be, Na, Ca, Sc, Ti, Mn, Fe, Co, Sr, Y, Zr, Sn, La, Ce, Pr, Nd, Sm, Gd, Tb, Dy, Yb, Hf, Tl, Th, Pa, U. Также важны аллотропные формы ряда металлов, образующиеся при их технологической обработке: Ti при 882˚C, Fe при 912˚C и 1394˚C, Co при 422˚C, Zr при 863˚C, Sn при 13˚C и U при 668˚C и 776˚C.
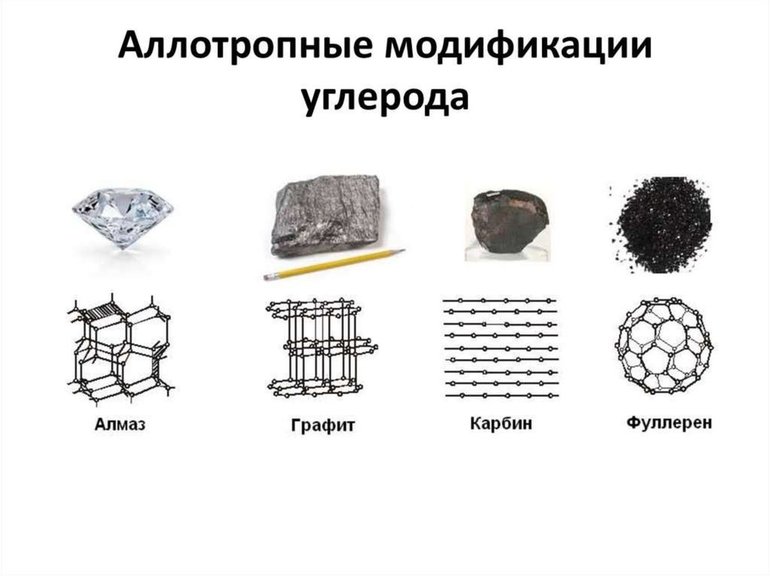




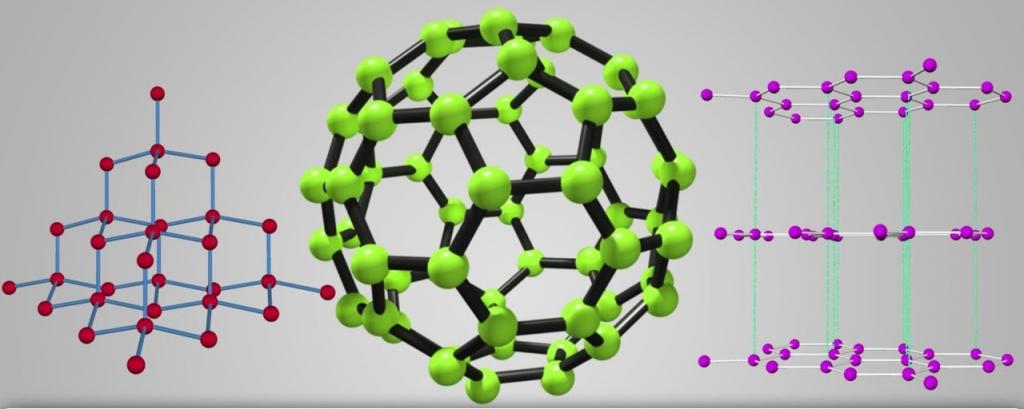
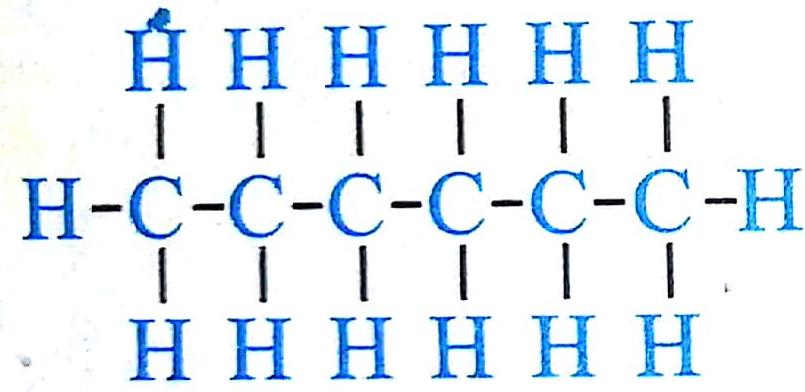











 Аллотропные формы углерода: a) лонсдейлит; б) алмаз;
Аллотропные формы углерода: a) лонсдейлит; б) алмаз;