Чем обусловлена нингидриновая реакция
ЦВЕТНЫЕ И ИМЕННЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ
История химии в школьном курсе
РЕАКЦИЯ ПИОТРОВСКОГО (БИУРЕТОВАЯ РЕАКЦИЯ)
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки млекул аминокислот, – пептидной связью.
При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т. д.
Дикетопиперазины образуются при взаимодействии двух молекул аминокислот с отщеплением двух молекул воды:
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
Реакция идет по схеме:
Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
Описание опыта. В пробирку наливают 5 капель 1%-го раствора глицина и прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем 40%-го раствора формальдегида (формалин). Появляется красное окрашивание (кислая среда):
Это реакция на аминокислоту глицин.
В таких солях ион меди координационными связями соединен с аминогруппами.
Описание опыта. В пробирку наливают 3 мл 3%-го раствора сульфата меди(II), добавляют несколько капель 10%-го раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают 0,5 мл концентрированного раствора глицина. При этом образуется темно-синий раствор глицината меди:
Описание опыта. В пробирку наливают 1 мл раствора тирозина и добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора:
Описание опыта. В пробирку наливают около
0,5 мл раствора уксуснокислого свинца и прибавляют раствор едкого кали до растворения образовавшегося осадка гидроксида свинца. В другую пробирку наливают
Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
В ходе проведенного исследования мы выявили по литературным источникам имеющуюся информацию о цветных качественных реакциях на белковые аминокислоты; выполнили ряд перечисленных реакций и составили базу данных. Эта база может быть использована в школьной практике как в теоретическом плане, так и в практическом, т. к. мы приводим краткие, но подробные описания выполнения всех опытов.
Из предложенных 18 качественных реакций каждая практически осуществима в школьном курсе химии и имеет важное практическое значение. Сопровождение реакций химическими уравнениями конкретизирует и углубляет знания по биологической и органической химии, особенно знания учащихся специализированных биологических и химических классов.
Использованная литература
Ермаков А.Н., Арасимович В.В., Смирнова-Иконникова М.И., Мирри И.К. Методы биохимического исследования растений. М.,1952, 520 с.
Полянская А.С., Шевелева А.О. Методическая разработка по лабораторным работам: «Аминокислоты» и «Белки». Л., 1976, 37 с.
Пустовалова Л.М. Практикум по биохимии. 1999, 541 с.
Руководство к практическим занятиям по органической химии. Под ред. В.М.Родионова. М., 1954, 111 с.
Соловьев Н.А. Лабораторные работы по биологической химии. Методическая разработка. СПб., 1996, 70 с.
Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. М., 1982, 311 с.
З.Саитов, С.В.Телешов, Б.Харитонцев,
секция «Юный химик» РХО им. Д.И.Менделеева (г. Тобольск)
Лабораторная работа №1
Лабораторная работа №1
ХИМИЯ ПРОСТЫХ БЕЛКОВ.
ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ
Белки представляют собой высокомолекулярные полимерные органические соединения, построенные из остатков различных α-аминокислот, соединенных ковалентной пептидной связью.
Присутствие белка в растворах можно обнаружить с помощью цветных реакций, обусловленных наличием в белке аминокислот, их специфических групп и пептидных связей. Существуют универсальные цветные реакции, т. е. на все белки (биуретовая и нингидриновая), и специфические, т. е. на определенные аминокислоты (ксантопротеиновая, Миллона, Фоля и др.).
На основании некоторых цветных реакций разработаны методы количественного определения белков и аминокислот, которые широко используются в биохимических лабораториях.
Цель: Ознакомиться с универсальными цветными реакциями на белки и специфическими реакциями на отдельные аминокислоты, содержащиеся в белковых растворах.
Работа 1. Биуретовая реакция на пептидную связь (Пиотровского)
Биуретовая реакция обусловлена наличием в белке пептидных связей, которые в щелочной среде образуют с сернокислой медью комплексы фиолетового цвета с красным или синим оттенком. Группа, образующая пептидную связь, в щелочной среде присутствует в своей таутомерной енольной форме:
При избытке щелочи происходит диссоциация ОН-группы, появляется отрицательный заряд, с помощью которого кислород взаимодействует с медью. Возникает солеобразная связь. Кроме того, медь образует дополнительные координационные связи с атомами азота, участвующими в пептидной связи, путем использования их электронных пар. Возникающий таким образом комплекс очень стабилен. Интенсивность окраски комплекса зависит от концентрации белка и количества медной соли в растворе.
Исследуемый материал: раствор яичного белка, раствор растительного белка, 1% раствор желатина.
Реактивы: 10% раствор NaOH, 1% раствор CuSO4.
Оборудование: пробирки, капельницы.
Ход работы. К 5 каплям водного раствора белка добавляют 5 капель 10% раствора NaOH и 2 капли 1% раствора CuSO4. Содержимое перемешивают. Оно приобретает сине-фиолетовый цвет. Нельзя добавлять избыток CuSO4, так как синий осадок маскирует характерное фиолетовое окрашивание биуретового комплекса.
Работа 2. Нингидриновая реакция на α-аминокислоты
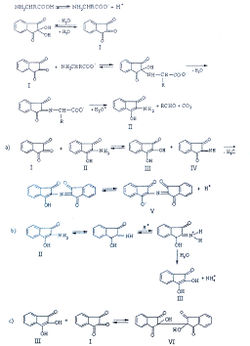
Белки, полипептиды и свободные α-аминокислоты дают синее или фиолетовое окрашивание с нингидрином. При нагревании белка с водным раствором нингидрина аминокислоты окисляются и распадаются, образуя СО2, NH3 и соответствующий альдегид. Нингидрин, являясь сильным окислителем, вызывает окислительное дезаминирование α-аминокислоты, приводящее к образованию аммиака, двуокиси углерода, соответствующего альдегида и восстановленной формы нингидрина. Нингидрин восстанавливается и связывается со второй молекулой нингидрина посредством молекулы аммиака, образуя продукты конденсации, окрашенные в синий, фиолетовый, красный, а в случае пролина – в желтый цвет.
Нингидриновая реакция на определение аминокислот и белка
Содержание
Спектрофотометрическое исследование продуктов нингидриновой реакции [ править | править код ]
Разработка точных, доступных методов анализа а-аминокислот является одной из актуальных задач современной фармации, в данной статье описан простой и доступный способ определения аминокислот и протеина в различных продуктах, включая биологически-активные добавки и спортивное питание.
В настоящее время существует ряд методов количественного определения а-аминокислот в лекарственном растительном сырье, в лекарственных препаратах и биологических жидкостях [1—31]. Однако, несмотря на высокую точность, их применение ограничено длительностью приготовления рабочих растворов (потенциометрическое титрование в неводной среде), дороговизной оборудования (ГЖХ, ВЭЖХ) [4, 6,27,28, 30].
Для анализа а-аминокислот также широко используют методы, основанные на реакции с нингидрином [1,3, 8,9, 11-20,23, 29].
Khan А. с соавторами изучили механизм нингидриновой реакции [29]:
Для детектирования продукта нингидриновой реакции используют спектрофотометры, флуориметры.
Широкое распространение в анализе аминокислот получили аминокислотные анализаторы [1,9,11,13—15, 17]. Данный метод основан на разделении аминокислот с помощью ионообменной хроматографии с последующим фотоколориметрическим определением продуктов реакции аминокислот с нингидрином. Применение аминокислотных анализаторов позволяет разделить исследуемый образец на отдельные компоненты и определить их количество быстро и с высокой точностью. Главным недостатком данного метода анализа является высокая стоимость оборудования, что делает его недоступным для большинства лабораторий.
Более доступными и простыми являются фотоколориметрические и спектрофотометрические методы анализа о-аминокислот, основанные на их взаимодействии с нингидрином. Так, В.А. Храмовым модифицирован метод определения диаминокислот по Чинарду [12]. Метод основан на образовании красно-коричневых продуктов взаимодействия диаминокислот с нингидрином с последующим фотоколориметрическим определением при длине волны 490 нм. Метод является специфичным: нейтральные аминокислоты, а также амины и диамины при pH 1 с нингидрином окрашенных продуктов не образуют. Несмотря на доступность и простоту данный метод не является универсальным для всех а-аминокислот и позволяет определить лишь диаминокислоты, из которых наибольшее практическое значение имеет незаменимая аминокислота лизин. Кроме того, этим методом можно определить пролин.
Разработана точная методика количественного определения кислоты аспарагиновой в лекарственном препарате «Аспаркам», основанная на ее взаимодействии с 1 % этаноловым раствором нингидрина и последующим определением оптической плотности продукта реакции при длине волны 568 нм. Метод отличается хорошей воспроизводимостью, относительная ошибка среднего результата составила ±2,25 % [19]. Кроме того, предложен спектрофотометрический метод анализа суммы аминокислот различных видов пыльцы, основанный на взаимодействии с 2 % этаноловым раствором нингидрина [11].
С этих позиций представляет интерес изучение спектральных характеристик продуктов нингидриновой реакции 20-ти наиболее важных в биологическом отношении а-аминокислот, оптимизация условий ее проведения с целью разработки точного и доступного метода количественного определения а-аминокислот в растительном сырье, субстанциях и суммарных лекарственных препаратах.
Исследование спектральных характеристик продуктов реакции а-аминокислот с 0,2 % раствором нингидрина в ацетоне [ править | править код ]
В соответствии с ГФ XI наиболее часто в хроматографических методах анализа а-аминокислот используют 0,2 % раствор нингидрина в ацетоне [3, 8]. На этом основании мы изучили спектры продуктов реакции для 20-ти а-аминокислот с ОД % раствором нингидрина в ацетоне с целью создания нового метода количественного анализа аминокислот в различных объектах.
Нингидриновую реакцию проводили по методике, указанной в ФСП на кислоту глутаминовую в разделе «подлинность»: к 1 мл 2 % раствора а-аминокислоты прибавляют 1 мл свежеприготовленного 0,2 % раствора нингидрина в ацетоне и нагревают до появления сине-фиолетовой окраски [10]. Цистеин и тирозин, вследствие их низкой растворимости в воде, использовали в виде менее концентрированных 0,04 % растворов. После полного охлаждения продукты нингидриновой реакции каждой из 20-ти а-аминокислот разбавляли водой в различных соотношениях до получения значений оптической плотности максимумов поглощения от 0,4 до 1,0.
Исследование спектров поглощения в видимой области показало наличие двух максимумов в диапазонах длин волн 399-405 и 560-570 нм. Данная закономерность наблюдается для 19-ти из 20-ти а-аминокислот (рис. 1-4). Исключение составляет пролин, продукт реакции которого с нингидрином имеет один максимум поглощения в видимой области — при длине волны 416 нм, что объясняется отсутствием первичной аминогруппы в структуре данной аминокислоты.
Чем обусловлена нингидриновая реакция
Биуретовая реакция (реакция Пиотровского). В щелочной среде белки, а также продукты их гидролиза — полипептиды дают фиолетовое или красно-фиолетовое окрашивание с солями меди. Реакция обусловлена наличием пептидных связей. Положительная биуретовая реакция проявляется у соединений, содержащих не менее двух
пептидных групп. Интенсивность окраски зависит от длины пептида и варьирует от сине-фиолетовой до краснофиолетовой и красной.
Биуретовую реакцию дают также аспарагин (амид аспарагиновой кислоты) и аминокислоты гистидин, треонин и серин.
Свое название реакция получила от биурета — соединения, которое образуется при нагревании мочевины. Эта реакция сопровождается отщеплением молекулы аммиака
Комплексной медно-натриевой соли пептидов и белков приписывают следующее строение:
Реактивы: а) раствор яичного белка (без добавления хлористого натрия); б) раствор растительного белка (приготовление — см. с. 6); в) едкий натр, 10%-ный раствор; г) сернокислая медь, 1%-ный раствор.
В одну пробирку наливают 2 мл раствора яичного белка, в другую — столько же растительного, затем в каждую из них прибавляют равный объем раствора едкого натра и по 1—2 капли раствора сернокислой меди. Появляется красно-фиолетовое или сине-фиолетовое окрашивание.
Нингидриновая реакция.
Нингидриновая реакция обусловлена наличием аминокислот, имеющих аминогруппы в a-положении. Белки, полипептиды и аминокислоты образуют с нингидрином соединение синего или сине-фиолетового цвета (при нагревании). Нингидриновая реакция является одной из наиболее чувствительных для обнаружения а-аминогрупп.
Сущность реакции заключается в том, что а-аминокислоты и пептиды, реагируя с нингидрином, подвергаются окислительному дезаминированию и декарбоксилированию:
Восстановленный нингидрин взаимодействует с аммиаком и второй молекулой нингидрина, в результате чего образуется окрашенное соединение (пурпурный Руэманна)
Реактивы: а) раствор белка (без хлористого натрия). Приготовление — см. с. 6; б) глицин, 0,1%-ный водный раствор; в) нингидрин, 0,1%-ный спиртовой раствор. В одну пробирку наливают 1-2 мл раствора глицина, в другую — столько же раствора белка. В обе пробирки добавляют раствор нингидрина (в первую 5—6 капель, во вторую — 10—12), нагревают около минуты. В пробирке с глицином быстро появляется фиолетово-синее или фиолетовое окрашивание, в пробирке с белком окрашивание развивается медленно и имеет красновато-фиолетовый оттенок (или даже желтовато-фиолетовый в случае наличия иминокислоты пролина).
Реакция Лоури.
Это одна из наиболее чувствительных реакций на белки. Ее дают циклические аминокислоты. Реагируя с реактивом Фолина, они образуют комплексы, окрашенные в синий цвет. Интенсивность окраски зависит от концентрации белков, поэтому реакция Лоури может быть использована и для количественного определения.
Реактивы: а) раствор яичного белка для цветных реакций и реакций осаждения (см. с. 6), разведенный дистиллированной водой в 100 раз; б) глицин, 0,02%-ный раствор; в) фенилаланин, 0,02%-ный раствор; г) реактив А: 2%-ный раствор углекислого натрия 






концентрированной соляной кислоты 

В три пробирки вносят соответственно растворы яичного белка, глицина и фенилаланина (по 2,5 мл), добавляют по 5 мл раствора С и оставляют на 10 мин., после чего приливают по 5 мл рабочего раствора реактива Фолина. Через 30 мин. наблюдают окрашивание жидкости: в пробирках с белком и фенилаланином развивается интенсивная синяя окраска, в пробирке с глицином сохраняется желтый цвет реактива.
Ксантопротеиновая реакция.
Характерна для некоторых ароматических аминокислот (фенилаланина, тирозина, триптофана). При нагревании белков и полипептидов с концентрированной азотной кислотой образуется нитросоединение желтого цвета.
Реакция протекает в две стадии. На протяжении первой аминокислота, например тирозин, взаимодействуя с концентрированной азотной кислотой, подвергается нитрованию. При этом образуется динитротирозин (желтого цвета).
Примечание. В зависимости от количества прибавленной азотной кислоты может образоваться и смесь динитро- и нитротирозина.
Во второй стадии продукты нитрования тирозина (ди-нитро- и нитротирозин) реагируют с едким натром или гидроокисью аммония с образованием натриевой или аммонийной соли, имеющей желто-оранжевое окрашивание.
Ксантопротеиновую реакцию, кроме белков, пептидов и циклических аминокислот, дают также многие простые ароматические соединения (бензол, фенол и др.).
Реактивы: а) раствор яичного или растительного белка (приготовление — см. с. 6); б) раствор желатина, 


К 2-3 мл раствора фенола осторожно (по стенке пробирки) приливают 1-2 мл концентрированной азотной кислоты. Осторожно нагревают, появляется желтое окрашивание.
В другую пробирку наливают 1-2 мл раствора яичного или растительного белка, прибавляют 8—10 капель концентрированной азотной кислоты и осторожно нагревают. Выпадает осадок, который окрашивается в желтый цвет.
После охлаждения в пробирку осторожно (по стенке) приливают избыток концентрированного раствора аммиака или едкого натра — жидкость принимает оранжевое или желто-оранжевое окрашивание.
Реакцию следует проводить под тягой!
Те же реакции проводят с раствором желатина: желтого окрашивания не наступает, так как желатин не содержит ароматических аминокислот (иногда может появиться очень слабое желтоватое окрашивание, обусловленное примесью других белков).
Реакция Миллона.
С помощью реакции Миллона открывают наличие аминокислоты тирозина. Тирозин образует с реактивом Миллона ртутную соль нитротирозина красного цвета. Эта реакция характерна также почти для всех фенолов.
Реактивы: а) раствор яичного или растительного белка (см. с. 6); б) раствор желатина, 1%-ный; в) фенол, 0,1%-ный раствор; г) реактив Миллона: 40 г ртути растворяют в 57 мл концентрированной азотной кислоты вначале при комнатной температуре, затем слабо подогревая на водяной бане. Раствор разбавляют двумя объемами воды и после отстаивания сливают с осадка.
Все работы производят под тягой!
К 1 мл раствора фенола в пробирке приливают 0,5 мл реактива Миллона 
В пробирку наливают 1-2 мл раствора яичного или растительного белка и 5—6 капель реактива Миллона, осторожно нагревают.
Жидкость окрашивается в красный цвет, и затем выпадает осадок кирпично-красного цвета.
То же проделывают и с раствором желатина: красного окрашивания не наступает или оно проявляется очень слабо (если желатин не очищен от примеси других белков),
Реакции на триптофан.
Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению
По аналогичной схеме протекает также реакция триптофана с оксиметилфурфуролом или формальдегидом.
В указанных реакциях принимает участие серная кислота, являющаяся водоотнимающим средством.
Реакция Адамкевича. Реактивы: а) свежий яичный белок (неразбавленный); б) желатин, 1%-ный раствор; в) уксусная кислота, концентрированная; г) серная кислота, концентрированная.
В пробирку наливают несколько капель неразбавленного яичного белка, прибавляют 1-2 мл концентрированной уксусной кислоты (лучше ледяной) и осторожно нагревают до растворения выпавшего осадка, после чего охлаждают и (осторожно!) по стенке пробирки, наклонив ее, наслаивают 1 мл концентрированной серной кислоты, следя, чтобы не произошло смешения жидкостей. На границе двух слоев через некоторое время появляется красно-фиолетовое кольцо.
Эту же реакцию проделывают с раствором желатина — окрашивания не наступает, так как триптофан не входит в состав желатина.
Реакция с оксиметилфурфуролом (Шульце — Распайля). От фруктозы в присутствии концентрированной серной кислоты отщепляется три молекулы воды, она превращается в оксиметилфурфурол, который образует с триптофаном окрашенные продукты конденсации. Реакцию можно производить как с фруктозой, так
и с сахарозой, при гидролитическом расщеплении которой освобождаются равные количества глюкозы и фруктозы.
Реактивы: а) раствор яичного или растительного белка (приготовление — см. с. 6); б) сахароза, 5%-ный раствор; в) серная кислота, концентрированная.
К 1-2 мл раствора белка добавляют 2—4 капли раствора сахарозы и по стенке пробирки осторожно наслаивают 1 мл концентрированной серной кислоты. На границе жидкостей появляется кольцо темно-красного (вишневого) цвета.
Реакция с формальдегидом. Реактивы: а) раствор яичного или растительного белка; б) формалин, 5%-ный раствор; в) серная кислота, концентрированная.
К 1 мл раствора белка в пробирке добавляют 2 капли раствора формалина и затем осторожно (по стенке пробирки) наслаивают 1 мл концентрированной серной кислоты, следя, чтобы жидкости не перемешивались. На границе соприкосновения жидкостей появляется кольцо фиолетового или фиолетово-красноватого цвета.
Реакция на аргинин (Сакагучи).
Производные гуанидина, как, например, аминокислота аргинин (гуанидина-миновалериановая кислота), метилгуанидин, гликоциамин (гуанидинуксусная кислота), реагируя с гипобромитом натрия (NaBrO) и а-нафтолом, образуют продукт конденсации кирпично-красного или малинового цвета. Метилгуанидин и глнкоциамин не входят в состав белковых веществ, и поэтому реакцию Сакагучи можно использовать для открытия аминокислоты аргинина.
Гипобромит является окислителем. Окисленный аргинин,
потеряв одну иминогруппу 
Реактивы: а) раствор яичного или растительного белка; б) а-нафтол. Готовят 1%-ный раствор в 96%-ном этиловом спирте. Перед употреблением 10 мл раствора разбавляют спиртом в мерной колбе емкостью 
Примечание. Раствор гипобромита натрия готовится лаборантом.
К 1 мл раствора белка прибавляют 2—3 капли раствора едкого натра, 
Реакция на аминокислоты, содержащие серу (цистеин, цистин).
Известны три серусодержащие аминокислоты: цистеин, цистин и метионин.
В молекулах цистеин а и цистин а сера связана относительно слабо и легко отщепляется при щелочном гидролизе в виде сероводорода, который реагирует со щелочью, образуя сульфиды натрия или калия. Сульфиды взаимодействуют с уксуснокислым свинцом (вернее, с плюмбитом) с образованием осадка сернистого свинца черного или буро-черного цвета. Реакции протекают по следующим уравнениям:
Реактивы: а) раствор яичного или растительного белка (см. с. 6); б) желатин, 1%-ный раствор; в) едкий натр, 15-20%-ный раствор; г) уксуснокислый свинец, 1%-ный раствор.
В одну пробирку наливают 2 мл раствора яичного или растительного белка, в другую — столько же раствора желатина. В обе пробирки добавляют по 1-1,5 мл раствора щелочи и осторожно нагревают до кипения, кипятят 1—2 мин., после чего в каждую пробирку прибавляют по 2—3 капли раствора уксуснокислого свинца.
В пробирке с яичным (или растительным) белком появляется буровато-черное или черное окрашивание, интенсивность которогозависит от концентрации раствора белка и содержания в нем цистеина и цистина. Раствор желатина окрашивания не дает. Это свидетельствует о том, что в состав желатина не входят серусодержащие аминокислоты.