Чем обусловлена не свертываемость белков в щелочной среде
Чем обусловлена не свертываемость белков в щелочной среде


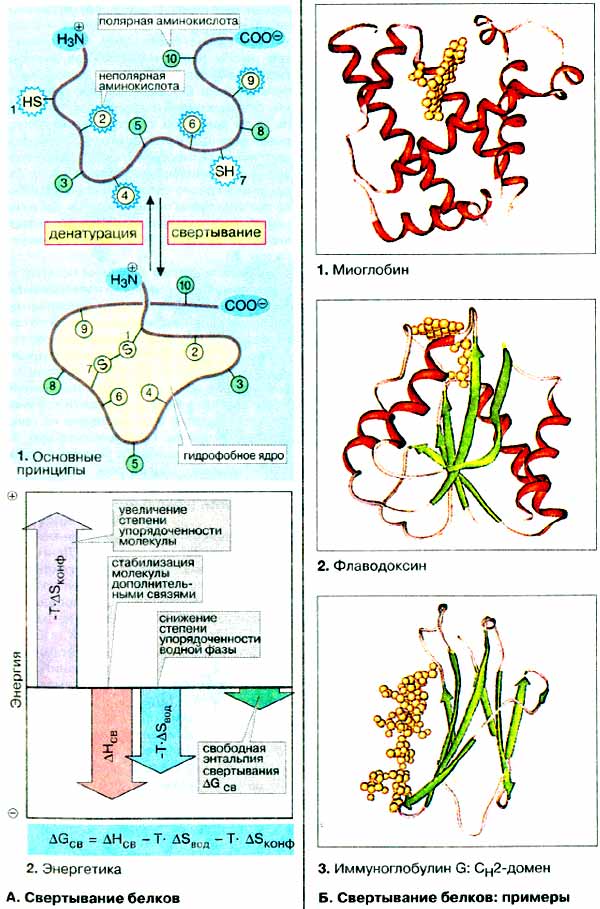
Информация относительно биологически активной (нативной) конформации полипептидной цепи закодирована в аминокислотной последовательности. Вторичные, третичные и четвертичные структуры многих белков образуются в растворе самопроизвольно в пределах нескольких минут. Тем не менее в клетке имеются специальные белки (шапероны, см. с. 230), функция которых обеспечивать свертывание полипептидных цепей вновь синтезируемых белков. Выяснение закономерностей свертывания полипептидных цепей является одной из важнейших задач биохимии. В случае успеха появилась бы возможность предсказывать нативные конформации белков на основании данных об аминокислотных последовательностях, реконструируемых на основании относительно легко доступных ДНК-последовательностей (см. c. 256).
К факторам, стабилизирующим конформацию белка, относятся водородные связи, дисульфидные мостики, электростатическое взаимодействие и комплексообразование с ионами металлов (см. с. 73). Другим очень важным стабилизирующим фактором является «гидрофобный эффект». Как отмечалось на с. 34, в смеси неполярных вещесте с ведой происходит разделение фаз («эффект масляных капель»), т. е. идет самопроизвольный процесс, при котором поверхность контакта между фазами стремится быть минимальной. По аналогии с этим процессом полипептидная цепь свертывается в водной среде таким образом, чтобы как можно больше неполярных боковых групп аминокислотных остатков были бы спрятаны внутри глобулы, тогда как полярные группы контактируют с водой ( 1 ). Такой механизм позволяет объяснить распределение соответствующих группировок и в молекуле инсулина (см. с. 83).
Б. Свертывание белков: примеры
Лабораторная работа 3. Реакции осаждения белка



Опыт 1. Осаждение белков при кипячении
Почти все белки свертываются при нагревании в нейтральной или слабокислой среде. В сильнокислых и щелочных средах растворы белков при кипячении не коагулируют и могут дать осадок лишь при добавлении нейтральной соли (NaCl и др.). Устойчивость белка в растворе зависит от приобретения положительного заряда в сильнокислой среде и увеличения отрицательного заряда в щелочной среде.
При понижении рН диссоциация карбоксильной группы подавляется и молекула становится положительно заряженной. При повышении рН происходит отрыв протона аминогруппы и молекула приобретает отрицательный заряд. Наиболее полное и быстрое осаждение белков происходит в изоэлектрической точке (это такое значение рН, при котором частицы белка не передвигаются в электрическом поле ни к аноду, ни к катоду). Для большинства белков изоэлектрическая точка соответствует слабокислой среде (рН
Порядок выполнения опыта. В 5 пробирок наливают по 5 капель 1%-ного раствора яичного белка. Первую пробирку нагревают до кипения, при этом жидкость мутнеет. Во второй пробирке раствор белка нагревают до кипения и прибавляют 1 каплю1%-ного раствора уксусной кислоты. При стоянии выпадает хлопьевидный осадок белка, т.к. частицы белка теряют заряд и приближаются к изоэлектрическому состоянию. В третью пробирку добавляют 5 капель 1%-ного раствора уксусной кислоты для получения сильнокислой реакции среды. При кипячении осадок не образуется, поскольку белковые мицеллы перезаряжаются и несут положительный заряд, повышая их устойчивость. В четвертую пробирку приливают 5 капель 1%-ного раствора уксусной кислоты и 2 капли насыщенного раствора хлористого натрия и нагревают, выпадает белый хлопьевидный осадок белка, т.к. его частицы теряют заряд вследствие взаимодействия белка с ионами хлористого натрия. В пятую пробирку добавляют 2 капли 10%-ного раствора едкого натра. При кипячении жидкости осадок не образуется, поскольку в щелочной среде отрицательный заряд на частицах белка увеличивается.
Указания к составлению отчета:Необходимо отметить положительный результат осаждения плюсом, а отрицательный – минусом и сделать выводы по работе касающихся изоэлектрической точки.
| Нейтральная среда | Слабокислая среда | Сильнокислая среда | Сильнокислая среда + электролит | Щелочная среда |
Опыт 2. Высаливание
Высаливанием называют осаждение белков с помощью больших концентраций нейтральных солей: NaCl, (NH4)2SO4 и др. Реакция высаливания обусловлена дегидратацией макромолекул белка и одновременной нейтрализацией электрического заряда. Для высаливания различных белков требуется неодинаковая концентрация одних и тех же солей. Хлористый натрий осаждает слабее, чем сернокислый аммоний, вследствие меньшей дегидратирующей способности. При высаливании белок обычно не теряет своих естественных свойств, например, он может вновь проявлять ферментативную активность. Метод высаливания позволяет разделить белки на различные белковые фракции: альбумины, глобулины и др.
Порядок выполнения опыта. 1). В пробирку наливают 20 капель раствора белка и прибавляют порошок хлористого натрия до полного насыщения раствора. Через несколько минут появляется осадок глобулинов. Содержимое пробирки отфильтровывают, в фильтрате остается альбумин, который в нейтральных растворах не выпадает даже при добавлении хлористого натрия. К фильтрату прибавляют по каплям 1%-ный раствор уксусной кислоты (15-20 капель), альбумин выпадает в осадок, его отфильтровывают и проверяют фильтрат на отсутствие белка при помощи биуретовой реакции;
2) К 15 каплям раствора белка добавляют 15 капель насыщенного раствора сернокислого аммония и перемешивают, выпадает осадок глобулинов. Его отфильтровывают, в фильтрате остается альбумин, к нему добавляют порошок сернокислого аммония до полного насыщения. Выпадает осадок яичного альбумина, его отфильтровывают, фильтрат проверяют на отсутствие белка с помощью биуретовой реакции.
Указания к составлению отчета:необходимо отметить положительный результат осаждения белков плюсом, а отрицательный – минусом; Результаты занести в таблицу и сделать выводы о высаливающей способности указанных растворов.
Опыт 3. Осаждение белков солями тяжелых металлов
Осаждение белков солями тяжелых металлов в отличие от высаливания, происходит при небольших концентрациях солей. Соли тяжелых металлов вызывают необратимое осаждение белков, т.е. денатурацию. Способность белка прочно связывать ионы тяжелого металла в виде нерастворимых осадков используется как противоядие при отравлении солями ртути, меди, свинца и др.
Порядок выполнения опыта. 1.Осаждение медным купоросом. К 5 каплям раствора яичного белка прибавляют 1 каплю 10%-ного раствора сернокислой меди, образуется бледно-голубой осадок, нерастворимый в воде. В другой пробирке к такой же порции белка приливают 1 каплю 10%-ного раствора сернокислой меди, а затем еще 10 капель и наблюдают растворение осадка в избытке реактива.
2. Осаждение белков уксуснокислым свинцом. К 5 каплям раствора белка приливают 2 капли 5%-ного раствора уксуснокислого свинца. Образуется нерастворимый в воде осадок, но легко растворяющийся в избытке осадителя.
Указания к составлению отчета: результаты реакций записывают в таблицу. Появление осадка обозначают плюсом, растворение осадка – минусом и делают обоснованные выводы по работе.
| Название веществ, осаждающих белки | Употребляемые реактивы | Характер и цвет осадка | Чем обусловлена реакция. Каковы ее особенности? |
Опыт 4. Осаждение белков концентрированными минеральными кислотами
Концентрированные минеральные кислоты вызывают денатурацию белка. В избытке минеральных кислот (за исключением азотной) выпавший осадок белка растворяется.
Порядок выполнения опыта: а) осаждение азотной кислотой. К 5 каплям концентрированной азотной кислоты приливают по стенке пробирки равный объем раствора белка. На границе двух жидкостей образуется осадок в виде небольшого белого кольца;
б) осаждение серной кислотой проводят аналогично. При избытке кислоты образующийся осадок растворяется.
Опыт 5. Осаждение белков органическими кислотами
Органические кислоты вызывают необратимое осаждение белков. Наибольшее применение получили трихлоруксусная CCl3COOH и сульфосалициловая C6H3(OH)(COOH)SO3H.
Порядок выполнения опыта: а) осаждение сульфосалициловой кислотой. К 5 каплям раствора белка добавляют 2 капли 20%-ного раствора сульфосалициловой кислоты. Выпадает осадок белка;
б) осаждение трихлоруксусной кислотой проводят аналогично.
Опыт 6. Осаждение белков органическими растворителями
В органических растворителях (спирт, ацетон) белки не растворяются. В зависимости от природы белка для его осаждения требуются различные концентрации спирта. При осаждении спиртом раствор белка должен быть нейтральным или слабокислым, но не щелочным. Успешнее реакция проходит в присутствии хлористого натрия вследствие снятия заряда с частиц белка. При кратковременном действии и на холоду реакция осаждения белка спиртом обратима. При длительном воздействии происходит денатурация белка.
Порядок выполнения опыта. К 5 каплям раствора белка приливают 15-20 капель этилового спирта (или ацетона), раствор мутнеет. Добавляют 1 каплю насыщенного раствора хлористого натрия, при стоянии выпадает осадок белка.
Чем обусловлена не свертываемость белков в щелочной среде
Реакции осаждения белков
4. Реакции осаждения белков
Белки в растворе и соответственно в организме сохраняются в нативном состоянии за счет факторов устойчивости, к которым относятся заряд белковой молекулы и гидратная оболочка вокруг нее. Удаление этих факторов приводит к склеиванию молекул белков и выпадению их в осадок. Осаждение белков может быть обратимым и необратимым в зависимости от реактивов и условий реакции. В клинической лабораторной практике реакции осаждения используют для выделения альбуминовой и глобулиновой фракций белков плазмы крови, количественной характеристики их устойчивости в плазме, обнаружения белков в биологических жидкостях и освобождения от них с целью получения без белкового раствора.
Под действием факторов осаждения белки выпадают в осадок, но после прекращения действия (удаления) этих факторов белки вновь переходят в растворимое состояние и приобретают свои нативные свойства. Одним из видов обратимого осаждения белков является высаливание.
1) неразведенный яичный белок;
2) насыщенный раствор сульфата аммония;
5) дистиллированная вода;
6) сульфат аммония в порошке.
Необратимое осаждение белков.
Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими нативных свойств. Такие изменения белков можно вызвать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов.
Осаждение при кипячении.
1) яичный белок, 1% раствор;
2) уксусная кислота, 1% и 10% растворы;
Ход определения. В 4 пронумерованные пробирки приливают по 10 капель раствора яичного белка. Затем 1-ю пробирку нагревают до кипячения, при этом раствор мутнеет, но т.к. частицы денатурированного белка несут заряд, они в осадок не выпадают. Это связано с тем, что яичный белок имеет кислые свойства (его изоэлектрическая точка 4,8) и в нейтральной среде заряжен отрицательно; во вторую пробирку добавляют 1 каплю 1% раствора уксусной кислоты и нагревают до кипячения. Белок выпадает в осадок, т.к. его раствор приближается к изоэлектрической точке и белок теряет заряд (один из факторов устойчивости белка в растворе); в 3-ю пробирку добавляют 1 каплю 10% раствора уксусной кислоты и нагревают до кипения. Осадка не образуется, т.к. в сильнокислой среде частицы белка приобретают положительный заряд (сохраняется один из факторов устойчивости белка в растворе); в 4-ю пробирку наливают 1 каплю раствора NaOH, нагревают до кипения. Осадок не образуется, поскольку в щелочной среде отрицательный заряд белка увеличивается.
Осаждение концентрированными минеральными кислотами.
Концентрированные кислоты (серная, хлористоводородная, азотная и др.) вызывают денатурацию белка за счет удаления факторов устойчивости белка в растворе (заряда и гидратной оболочки). Однако при избытке хлористоводородной и серной кислоты выпавший осадок денатурированного белка снова растворяется. По-видимому, это происходит в результате перезарядки молекул белка и частичного их гидролиза. При добавлении избытка азотной кислоты растворения осадка не происходит. Вот почему для определения малых количеств белка в моче при клинических исследованиях применяется азотная кислота.
1) яичный белок,1% раствор;
2) концентрированная серная кислота;
3) концентрированная хлористоводородная кислота;
4) концентрированная азотная кислота.
Ход определения. В три пробирки наливают по 5 капель концентрированной серной, хлористоводородной и азотной кислот. затем, наклонив пробирку под углом 45 градусов, осторожно по стенке наслаивают такой же объем яичного белка. На границе двух слоев появляется осадок белка в виде белого кольца. Осторожно встряхивают пробирки, наблюдают растворение белка в пробирках с серной и хлористоводородной кислотами, в пробирке с азотной кислотой растворения белка не происходит.
Осаждение органическими кислотами.
Трихлоруксусная кислота осаждает только белки, а сульфосалициловая осаждает не только белки, но и высокомолекулярные пептиды. Сульфосалициловой кислотой пользуются при определении белка в моче.
1) яичный белок, 1% раствор;
2) трихлоруксусная кислота, 10% раствор;
3) сульфосалициловая кислота, 10% раствор.
Осаждение белка солями тяжелых металлов.
Белки при взаимодействии с солями свинца, меди, ртути, серебра и других тяжелых металлов денатурируются и выпадают в осадок. Однако при избытке некоторых солей наблюдается растворение первоначально образовавшегося осадка. Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле.
1) яичный белок, 1% раствор;
2) сульфат меди, 10% раствор;
3) ацетат свинца, 5% раствор;
4) нитрат серебра, 5% раствор.
Чем обусловлена не свертываемость белков в щелочной среде
§ 9. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Белки – это очень крупные молекулы, по своим размерам они могут уступать только отдельным представителям нуклеиновых кислот и полисахаридам. В таблице 4 представлены молекулярные характеристики некоторые белков.
Молекулярные характеристики некоторых белков
Относитель-ная молекулярная масса
Число аминокислотных остатков
Зная относительную молекулярную массу белка, можно приблизительно оценить, какое число аминокислотных остатков входит в его состав. Средняя относительная молекулярная масса аминокислот, образующих полипептидную цепь, равна 128. При образовании пептидной связи происходит отщепление молекулы воды, следовательно, средняя относительная масса аминокислотного остатка составит 128 – 18 = 110. Используя эти данные, можно подсчитать, что белок с относительной молекулярной массой 100000 будет состоять приблизительно из 909 аминокислотных остатков.
Электрические свойства белковых молекул
Электрические свойства белков определяются присутствием на их поверхности положительно и отрицательно заряженных аминокислотных остатков. Наличие заряженных группировок белка определяет суммарный заряд белковой молекулы. Если в белках преобладают отрицательно заряженные аминокислоты, то его молекула в нейтральном растворе будет иметь отрицательный заряд, если преобладают положительно заряженные – молекула будет иметь положительный заряд. Суммарный заряд белковой молекулы зависит и от кислотности (рН) среды. При увеличении концентрации ионов водорода (увеличении кислотности) происходит подавление диссоциации карбоксильных групп:
и в то же время увеличивается число протонированных амино-групп;
Таким образом, при увеличении кислотности среды происходит уменьшение на поверхности молекулы белка числа отрицательно заряженных и увеличение числа положительно заряженных групп. Совсем другая картина наблюдается при снижении концентрации ионов водорода и увеличении концентрации гидроксид-ионов. Число диссоциированных карбоксильных групп возрастает
и снижается число протонированных аминогрупп
Итак, изменяя кислотность среды, можно изменить и заряд молекулы белка. При увеличении кислотности среды в молекуле белка снижается число отрицательно заряженных группировок и увеличивается число положительно заряженных, молекула постепенно теряет отрицательный и приобретает положительный заряд. При снижении кислотности раствора наблюдается противоположная картина. Очевидно, что при определенных значениях рН молекула будет электронейтральной, т.е. число положительно заряженных групп будет равно числу отрицательно заряженных групп, и суммарный заряд молекулы будет равен нулю (рис. 14).
Значение рН, при котором суммарный заряд белка равен нулю, называется изоэлектрической точкой и обозначается pI.
Рис. 14. В состоянии изоэлектрической точки суммарный заряд молекулы белка равен нулю
Изоэлектрическая точка для большинства белков находится в области рН от 4,5 до 6,5. Однако есть и исключения. Ниже приведены изоэлектрические точки некоторых белков:
При значениях рН ниже изоэлектрической точки белок несет суммарный положительный заряд, выше – суммарный отрицательный.
Растворимость белков
Рис. 15. Образование гидратной оболочки вокруг молекулы белка.
На растворимость белка влияет наличие нейтральных солей (Na2SO4, (NH4)2SO4 и др.) в растворе. При малых концентрациях солей растворимость белка увеличивается (рис. 16), так как в таких условиях увеличивается степень диссоциации полярных групп и экранируются заряженные группы белковых молекул, тем самым снижается белок-белковое взаимодействие, способствующее образованию агрегатов и выпадению белка в осадок. При высоких концентрациях солей растворимость белка снижается (рис. 16) вследствие разрушения гидратной оболочки, приводящего к агрегации молекул белка.
Рис. 16. Зависимость растворимости белка от концентрации соли
Существуют белки, которые растворяются только в растворах солей и не растворяются в чистой воде, такие белки называют глобулины. Существуют и другие белки – альбумины, они в отличие от глобулинов хорошо растворимы в чистой воде.
Растворимость белков зависит и от рН растворов. Как мы уже отмечали, минимальной растворимостью обладают белки в изоэлектрической точке, что объясняется отсутствием электростатического отталкивания между молекулами белка.
При определенных условиях белки могут образовывать гели. При образовании геля молекулы белка формируют густую сеть, внутреннее пространство которой заполнено растворителем. Гели образуют, например, желатина (этот белок используют для приготовления желе) и белки молока при приготовлении простокваши.
На растворимость белка оказывает влияние и температура. При действии высокой температуры многие белки выпадают в осадок вследствие нарушения их структуры, но об этом более подробно поговорим в следующем разделе.
Денатурация белка
Рис. 17. Денатурация белка
При денатурации гидрофобные радикалы аминокислот, находящиеся в нативных белках в глубине молекулы, оказываются на поверхности, в результате создаются условия для агрегации. Агрегаты белковых молекул выпадают в осадок. Денатурация сопровождается потерей биологической функции белка.
Денатурация белка может быть вызвана не только повышенной температурой, но и другими факторами. Кислоты и щелочи способны вызвать денатурацию белка: в результате их действия происходит перезарядка ионогенных групп, что приводит к разрыву ионных и водородных связей. Мочевина разрушает водородные связи, следствием этого является потеря белками своей нативной структуры. Денатурирующими агентами являются органические растворители и ионы тяжелых металлов: органические растворители разрушают гидрофобные связи, а ионы тяжелых металлов образуют нерастворимые комплексы с белками.
Наряду с денатурацией существует и обратный процесс – ренатурация. При снятии денатурирующего фактора возможно восстановление исходной нативной структуры. Например, при медленном охлаждении до комнатной температуры раствора восстанавливается нативная структура и биологическая функция трипсина.
Белки могут денатурировать и в клетке при протекании нормальных процессов жизнедеятельности. Совершенно очевидно, что утрата нативной структуры и функции белков – крайне нежелательное событие. В связи с этим следует упомянуть об особых белках – шаперонах. Эти белки способны узнавать частично денатурированные белки и, связываясь с ними, восстанавливать их нативную конформацию. Шапероны также узнают белки, процесс денатурации которых зашел далеко, и транспортируют их в лизосомы, где происходит их расщепление (деградация). Шапероны играют важную роль и в процессе формирования третичной и четвертичной структур во время синтеза белка.
Интересно знать! В настоящее время часто упоминается такое заболевание, как коровье бешенство. Эту болезнь вызывают прионы. Они могут вызывать у животных и человека и другие заболевания, носящие нейродегенеративный характер. Прионы – это инфекционные агенты белковой природы. Прион, попадая в клетку, вызывает изменение конформации своего клеточного аналога, который сам становится прионом. Так возникает заболевание. Прионный белок отличается от клеточного по вторичной структуре. Прионная форма белка имеет в основном b-складчатую структуру, а клеточная – a-спиральную.
ЦВЕТНЫЕ И ИМЕННЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ
История химии в школьном курсе
РЕАКЦИЯ ПИОТРОВСКОГО (БИУРЕТОВАЯ РЕАКЦИЯ)
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки млекул аминокислот, – пептидной связью.
При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т. д.
Дикетопиперазины образуются при взаимодействии двух молекул аминокислот с отщеплением двух молекул воды:
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
Реакция идет по схеме:
Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
Описание опыта. В пробирку наливают 5 капель 1%-го раствора глицина и прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем 40%-го раствора формальдегида (формалин). Появляется красное окрашивание (кислая среда):
Это реакция на аминокислоту глицин.
В таких солях ион меди координационными связями соединен с аминогруппами.
Описание опыта. В пробирку наливают 3 мл 3%-го раствора сульфата меди(II), добавляют несколько капель 10%-го раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают 0,5 мл концентрированного раствора глицина. При этом образуется темно-синий раствор глицината меди:
Описание опыта. В пробирку наливают 1 мл раствора тирозина и добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора:
Описание опыта. В пробирку наливают около
0,5 мл раствора уксуснокислого свинца и прибавляют раствор едкого кали до растворения образовавшегося осадка гидроксида свинца. В другую пробирку наливают
Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
В ходе проведенного исследования мы выявили по литературным источникам имеющуюся информацию о цветных качественных реакциях на белковые аминокислоты; выполнили ряд перечисленных реакций и составили базу данных. Эта база может быть использована в школьной практике как в теоретическом плане, так и в практическом, т. к. мы приводим краткие, но подробные описания выполнения всех опытов.
Из предложенных 18 качественных реакций каждая практически осуществима в школьном курсе химии и имеет важное практическое значение. Сопровождение реакций химическими уравнениями конкретизирует и углубляет знания по биологической и органической химии, особенно знания учащихся специализированных биологических и химических классов.
Использованная литература
Ермаков А.Н., Арасимович В.В., Смирнова-Иконникова М.И., Мирри И.К. Методы биохимического исследования растений. М.,1952, 520 с.
Полянская А.С., Шевелева А.О. Методическая разработка по лабораторным работам: «Аминокислоты» и «Белки». Л., 1976, 37 с.
Пустовалова Л.М. Практикум по биохимии. 1999, 541 с.
Руководство к практическим занятиям по органической химии. Под ред. В.М.Родионова. М., 1954, 111 с.
Соловьев Н.А. Лабораторные работы по биологической химии. Методическая разработка. СПб., 1996, 70 с.
Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. М., 1982, 311 с.
З.Саитов, С.В.Телешов, Б.Харитонцев,
секция «Юный химик» РХО им. Д.И.Менделеева (г. Тобольск)