Чем обеспечивается пространственная конфигурация белковой молекулы
Пространственная организация белковой молекулы
В базе каждого белка лежит полипептидная цепь. Она не просто вытянута в пространстве, а организована в трехмерную структуру. Исходя из этого существует понятие о 4-х уровнях пространственной организации белка, в частности — первичной, вторичной, третичной и четвертичной структурах протеиновых молекул.
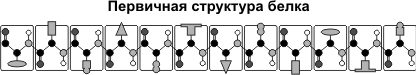
Первичная структура белка — последовательность аминокислотных фрагментов, прочно (и в течение всего периода существования белка) соединенных пептидными связями. Существует период полужизни протеиновых молекул — для большинства белков около 2-х недель. В случае если случился разрыв хотя бы одной пептидной связи, то образуется уже второй белок.
Вторичная структура — это пространственная организация стержня полипептидной цепи. Существуют 3 основных типа вторичной структуры:
1) Альфа-спираль — имеет определенные характеристики: ширину, расстояние между двумя витками спирали. Для белков характерна правозакрученная спираль. В данной спирали на 10 витков приходится 36 аминокислотных остатков. У всех пептидов, уложенных в такую спираль, эта спираль полностью однообразна. Фиксируется альфа-спираль посредством водородных связей между NH-группами одного витка спирали и С=О группами соседнего витка. Эти водородные связи расположены параллельно оси спирали и многократно повторяются, исходя из этого прочно удерживают спиралеобразную структуру. Более того, удерживают в пара напряженном состоянии (как сжатую пружину).
Бета-складчатая структура — либо структура складчатого страницы. Фиксируется кроме этого водородными связями между С=О и NH-группами. Фиксирует два участка полипептидной цепи. Эти цепи смогут быть параллельны либо антипараллельны. В случае если такие связи образуются в пределах одного пептида, то они неизменно антипараллельны, а вдруг между различными полипептидами, то параллельны.
3) Нерегулярная структура — тип вторичной структуры, в котором размещение разных участков полипептидной цепи относительно друг друга не имеет регулярного (постоянного) характера, исходя из этого нерегулярные структуры смогут иметь разную конформацию.
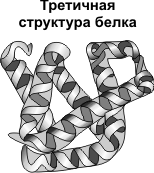
Это трехмерная архитектура полипептидной цепи – особенное обоюдное размещение в пространстве спиралеобразных, складчатых и нерегулярных участков полипептидной цепи. У различных белков третичной структуры разна. В формировании третичной структуры участвуют дисульфидные связи и все не сильный типы связей.
Выделяют два неспециализированных типа третичной структуры:
1) В фибриллярных белках (к примеру, коллаген, эластин ) молекулы которых имеют вытянутую форму и в большинстве случаев формируют волокнистые структуры тканей, третичная структура представлена или тройной альфа-спиралью (к примеру, в коллагене), или бета-складчатыми структурами.
В большинстве случаев в глобулярных белках гидрофобные участки молекулы находятся в глубине молекулы. Соединяясь между собой, гидрофобные радикалы образуют гидрофобные кластеры (центры). Формирование гидрофобного кластера вынуждает молекулу соответствующим образом изгибаться в пространстве. В большинстве случаев в молекуле глобулярного белка не редкость пара гидрофобных кластеров в глубине молекулы. Это есть проявлением двойственности особенностей протеиновой молекулы: на поверхности молекулы — гидрофильные группировки, исходя из этого молекула в целом — гидрофильная, а в глубине молекулы — запрятаны гидрофобные радикалы.
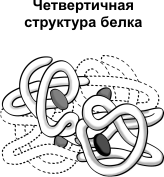
Видится не у всех белков, а лишь у тех, каковые складываются из двух либо более полипептидных цепей. Любая такая цепь именуется субъединицей данной молекулы (либо протомером). Исходя из этого белки, владеющие четвертичной структурой, именуют олигомерными белками. В состав протеиновой молекулы смогут входить однообразные либо различные субъединицы. К примеру, молекула гемоглобина «А» складывается из двух субъединиц одного типа и двух субъединиц другого типа, другими словами есть тетрамером. Фиксируются четвертичные структуры белков всеми типами не сильный связей, а время от времени еще и дисульфидными связями.
Конформация и Конфигурация ПРОТЕИНОВОЙ МОЛЕКУЛЫ
Из всего сообщённого возможно заключить, что пространственная организация белков весьма сложна. В химии существует понятие — пространственная конфигурация — жестко закрепленное ковалентными связями пространственное обоюдное размещение частей молекулы (к примеру: принадлежность к L-последовательности стереоизомеров либо к D-последовательности).
Для белков кроме этого употребляется понятие конформация протеиновой молекулы — определенное, но не застывшее, не неизменное обоюдное размещение частей молекулы. Так как конформация протеиновой молекулы формируется при участии не сильный типов связей, то она есть подвижной (способной к трансформациям), и белок может изменять собственную структуру. В зависимости от условий окружающей среды молекула существует в различных конформационных состояниях, каковые легко переходят приятель в приятеля. Энергетически удачными для настоящих условий являются лишь одно либо пара конформационных состояний, между которыми существует равновесие. Переходы из одного конформационного состояния в второе снабжают функционирование протеиновой молекулы. Это обратимые конформационные трансформации (видятся в организме, к примеру, при проведении нервного импульса, при переносе кислорода гемоглобином). При трансформации конформации часть не сильный связей разрушается, и образуются новые связи не сильный типа.
Сотрудничество белка с каким-нибудь веществом время от времени ведет к связыванию молекулы этого вещества молекулой белка. Данный явление известно как «сорбция» (связывание). Обратный же процесс — освобождение второй молекулы от протеиновой именуется «десорбция».
В случае если для какой-нибудь пары молекул процесс сорбции преобладает над десорбцией, то это уже своеобразная сорбция, а вещество, которое сорбируется, именуется «лиганд».
1) Лиганд белка-фермента – субстрат.
2) Лиганд траспортного белка – транспортируемое вещество.
3) Лиганд антитела (иммуноглобулина) – антиген.
4) Лиганд рецептора гормона либо нейромедиатора – гормон либо нейромедиатор.
Белок может изменять собственную конформацию не только при сотрудничестве с лигандом, но и в следствии любого химического сотрудничества. Примером для того чтобы сотрудничества может служить присоединение остатка фосфорной кислоты.
В природных условиях белки имеют пара термодинамически удачных конформационных состояний. Это нативные состояния (природные). Natura (лат.) – природа.
НАТИВНОСТЬ ПРОТЕИНОВОЙ МОЛЕКУЛЫ
Нативность — это неповторимый комплекс физических, физико-химических, химических и биологических особенностей протеиновой молекулы, что в собственности ей, в то время, когда молекула белка находится в естественном, природном (нативном) состоянии.
К примеру: белок хрусталика глаза — кристаллин — владеет высокой прозрачностью лишь в нативном состоянии).
Для обозначения процесса, при котором нативные особенности белка теряются, применяют термин денатурация.
Денатурация — это лишение белка его природных, нативных особенностей, сопровождающееся разрушением четвертичной (если она была), третичной, а время от времени и вторичной структуры протеиновой молекулы, которое появляется при разрушении дисульфидных и не сильный типов связей, участвующих в образовании этих структур. Первичная структура наряду с этим сохраняется, по причине того, что она организована прочными ковалентными связями. Разрушение первичной структуры может случиться лишь в следствии гидролиза протеиновой молекулы долгим кипячением в растворе кислоты либо щелочи.
ФАКТОРЫ, ВЫЗЫВАЮЩИЕ ДЕНАТУРАЦИЮ БЕЛКОВ
Факторы, каковые приводят к денатурации белков, возможно поделить на физические и химические.
1. Большие температуры. Для различных белков характерна разная чувствительность к тепловому действию. Часть белков подвергается денатурации уже при 40-50°С. Такие белки именуют термолабильными. Другие белки денатурируют при значительно более больших температурах, они являются термостабильными.
2. Ультрафиолетовое облучение
3. Рентгеновское и радиоактивное облучение
5. Механическое действие (к примеру, вибрация).
1. щёлочи и Концентрированные кислоты. К примеру, трихлоруксусная кислота (органическая), азотная кислота (неорганическая).
2. Соли тяжелых металлов (к примеру, CuSO4).
3. Органические растворители (этиловый спирт, ацетон)
4. Растительные алкалоиды.
5. Мочевина в высоких концентрациях
 |
5. Другие вещества, талантливые нарушать не сильный типы связей в молекулах белков.
Действие факторами денатурации используют для инструментов и стерилизации оборудования, и как антисептики.
В пробирке (in vitro) значительно чаще это – необратимый процесс. В случае если же денатурированный белок поместить в условия, родные к нативным, то он может ренатурировать, но весьма медлительно, и такое явление характерно не для всех белков.
In vivo, в организме, вероятна стремительная ренатурация. Это связано с выработкой в живом организме своеобразных белков, каковые «определят» структуру денатурированного белка, присоединяются к нему посредством не сильный типов связи и создают оптимальные условия для ренатурации. Такие своеобразные белки известны как «белки теплового шока» либо «белки стресса».
Существует пара семейств этих белков, они отличаются по молекулярной массе.
К примеру, известен белок hsp 70 – heatshock protein массой 70 kDa.
Такие белки имеется во всех клетках организма. Они делают кроме этого функцию транспорта полипептидных цепей через биологические мембраны и участвуют в формировании третичной и четвертичной структур протеиновых молекул. Перечисленные функции белков стресса именуются шаперонными. При разных видах стресса происходит индукция синтеза таких белков: при перегреве организма (40-44°С), при вирусных болезнях, отравлениях солями тяжелых металлов, этанолом и др.
В организме южных народов установлено повышенное содержание белков стресса, если сравнивать с северной расой.
Молекула белка теплового шока складывается из двух компактных глобул, соединенных свободной цепью:
Различные белки теплового шока имеют неспециализированный замысел построения. Все они содержат контактные домены.
Различные белки с разными функциями смогут содержать однообразные домены. К примеру, разные кальций-связывающие белки имеют однообразный для всех них домен, несущий ответственность за связывание Ca+2.
Роль доменной структуры содержится в том, что она предоставляет белку довольно широкие возможности для исполнения собственной функции благодаря перемещениям одного домена по отношению к второму. Участки соединения двух доменов – самое не сильный в структурном отношении место в молекуле таких белков. Как раз тут значительно чаще происходит гидролиз связей, и белок разрушается.
Цитология. Лекция 16. аминокислоты и Белки.
Чем обеспечивается пространственная конфигурация белковой молекулы
§ 8. ПРОСТРАНСТВЕННАЯ ОРГАНИЗАЦИЯ БЕЛКОВОЙ МОЛЕКУЛЫ
Первичная структура
Под первичной структурой белка понимают количество и порядок чередования аминокислотных остатков, соединенных друг с другом пептидными связями, в полипептидной цепи.
Полипептидная цепь на одном конце содержит свободную, не участвующую в образовании пептидной связи, NH2-группу, этот участок обозначается как N–конец. На противоположной стороне располагается свободная, не участвующая в образовании пептидной связи, НООС-группа, это – С-конец. За начало цепи принимается N-конец, именно с него начинается нумерация аминокислотных остатков:
Аминокислотную последовательность инсулина установил Ф. Сэнгер (Кембриджский университет). Этот белок состоит из двух полипептидных цепей. Одна цепь состоит из 21 аминокислотного остатка, другая цепь – из 30. Цепи связаны двумя дисульфидными мостиками (рис.6).
Рис. 6. Первичная структура инсулина человека
На расшифровку этой структуры было затрачено 10 лет (1944 – 1954 гг.). В настоящее время первичная структура определена у многих белков, процесс ее определения автоматизирован и не представляет собой серьезную проблему для исследователей.
Информация о первичной структуре каждого белка закодирована в гене (участке молекулы ДНК) и реализуется в ходе транскрипции (переписывании информации на мРНК) и трансляции (синтеза полипептидной цепи). В связи с этим можно установить первичную структуру белка также по известной структуре соответствующего гена.
По первичной структуре гомологичных белков можно судить о таксономическом родстве видов. К гомологичным белкам относятся те белки, которые у разных видов выполняют одинаковые функции. Такие белки имеют сходные аминокислотные последовательности. Например, белок цитохром С у большинства видов имеет относительную молекулярную массу около 12500 и содержит около 100 аминокислотных остатков. Различия в первичной структуре цитохрома С двух видов пропорциональны филогенетическому различию между данными видами. Так цитохромы С лошади и дрожжей отличаются по 48 аминокислотным остаткам, курицы и утки – по двум, цитохромы же курицы и индейки идентичны.
Вторичная структура
Вторичная структура белка формируется вследствие образования водородных связей между пептидными группами. Различают два типа вторичной структуры: α-спираль и β-структура (или складчатый слой). В белках могут присутствовать также участки полипептидной цепи, не образующие вторичную структуру.
α-Спираль по форме напоминает пружину. При формировании α-спирали атом кислорода каждой пептидной группы образует водородную связь с атомом водорода четвертой по ходу цепи NH-группы:
Каждый виток спирали связан со следующим витком спирали несколькими водородными связями, что придает структуре значительную прочность. α-Спираль обладает следующими характеристиками: диаметр спирали 0,5 нм, шаг спирали – 0,54 нм, на один виток спирали приходится 3,6 аминокислотных остатка (рис. 7).
Рис. 7. Модель a-спирали, отражающая ее количественные характеристики
Боковые радикалы аминокислот направлены наружу от 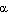
Рис. 8. Модель 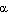
Из природных L-аминокислот может быть построена как правая, так и левая 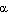
Некоторые аминокислотные остатки препятствуют образованию α-спирали. Например, если в цепи подряд расположено несколько положительно или отрицательно заряженных аминокислотных остатков, такой участок не примет α-спиральной структуры из-за взаимного отталкивания одноименно заряженных радикалов. Затрудняют образование 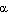
Рис. 9. Остаток пролина препятствует образованию 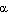
Поэтому остаток пролина, входящий в состав полипептидной цепи, не способен образовывать внутрицепочечную водородную связь. Кроме того, атом азота в пролине входит в состав жесткого кольца, что делает невозможным вращение вокруг связи N – C и образование спирали.
Кроме α-спирали описаны и другие типы спиралей. Однако они встречаются редко, в основном на коротких участках.
Образование водородных связей между пептидными группами соседних полипептидных фрагментов цепей приводит к формированию β-структуры, или складчатого слоя:
В отличие от α-спирали складчатый слой имеет зигзагообразную форму, похожую на гармошку (рис. 10).
Рис. 10. β-Структура белка
Различают параллельные и антипараллельные складчатые слои. Параллельные β-структуры образуются между участками полипептидной цепи, направления которых совпадают:
Антипаралельные β-структуры образуются между противоположно направленными участками полипептидной цепи:
β-Структуры могут формироваться более чем между двумя полипептидными цепями:
В составе одних белков вторичная структура может быть представлена только α-спиралью, в других – только β-структурами (параллельными, или антипараллельными, или и теми, и другими), в третьих наряду с α-спирализованными участками могут присутствовать и β-структуры.
Третичная структура
У многих белков вторичноорганизованные структуры (α-спирали, 
Третичная структура белков определяется их аминокислотной последовательностью. При ее формировании связи могут возникать между аминокислотами, расположенными в полипептидной цепи на значительном расстоянии. У растворимых белков полярные радикалы аминокислот, как правило, оказываются на поверхности белковых молекул и реже – внутри молекулы, гидрофобные радикалы оказываются компактно упакованными внутри глобулы, образуя гидрофобные области.
В настоящее время третичная структура многих белков установлена. Рассмотрим два примера.
Миоглобин – кислород-связывающий белок с относительной массой 16700. Его функция – запасание кислорода в мышцах. В его молекуле имеется одна полипептидная цепь, состоящая из 153 аминокислотных остатков, и гемогруппа, играющая важную роль в связывании кислорода.
Пространственная организация миоглобина установлена благодаря работам Джона Кендрью и его коллег (рис. 11). В молекуле этого белка присутствуют 8 α-спиральных участков, на их долю приходится 80 % всех аминокислотных остатков. Молекула миоглобина очень компактна, внутри нее может уместиться всего четыре молекулы воды, почти все полярные радикалы аминокислот расположены на внешней поверхности молекулы, большая часть гидрофобных радикалов расположена внутри молекулы, вблизи поверхности находится гем – небелковая группа, ответственная за связывание кислорода.
Рис.11. Третичная структура миоглобина
Рибонуклеаза – глобулярный белок. Она секретируется клетками поджелудочной железы, это – фермент, катализирующий расщепление РНК. В отличие от миоглобина, в молекуле рибонуклеазы имеется очень мало α-спиральных участков и достаточно большое число сегментов, находящихся в β-конформации. Прочность третичной структуре белка придают 4 дисульфидные связи.
Четвертичная структура
Многие белки состоят из нескольких, двух или более, белковых субъединиц, или молекул, обладающих определенной вторичной и третичной структурами, удерживаемых вместе при помощи водородных и ионных связей, гидрофобных взаимодействий, ван-дер-ваальсовых сил. Такая организация белковых молекул носит название четвертичной структуры, а сами белки называют олигомерными. Отдельная субъединица, или белковая молекула, в составе олигомерного белка называется протомером.
Число протомеров в олигомерных белках может варьировать в широких пределах. Например, креатинкиназа состоит из 2 протомеров, гемоглобин – из 4 протомеров, РНК-полимераза E.coli – фермент, ответственный за синтез РНК, – из 5 протомеров, пируватдегидрогеназный комплекс – из 72 протомеров. Если белок состоит из двух протомеров, его называют димером, четырех – тетрамером, шести – гексамером (рис. 12). Чаще в молекуле олигомерного белка содержится 2 или 4 протомера. В состав олигомерного белка могут входить одинаковые или различные протомеры. Если в состав белка входят два идентичных протомера, то это – гомодимер, если разные – гетеродимер.
Рис. 12. Олигомерные белки
Рассмотрим организацию молекулы гемоглобина. Основная функция гемоглобина заключается в транспорте кислорода из легких в ткани и углекислого газа в обратном направлении. Его молекула (рис. 13) состоит из четырех полипептидных цепей двух различных типов – двух α-цепей и двух β-цепей и гема. Гемоглобин является белком, родственным миоглобину. Вторичная и третичная структуры миоглобина и протомеров гемоглобина очень сходны. Каждый протомер гемоглобина содержит, как и миоглобин, 8 α-спирализованных участков полипептидной цепи. При этом надо отметить, что в первичных структурах миоглобина и протомера гемоглобина идентичны только 24 аминокислотных остатка. Следовательно, белки, значительно отличающиеся по первичной структуре, могут иметь сходную пространственную организацию и выполнять сходные функции.
Пространственная организация белковых молекул



Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).
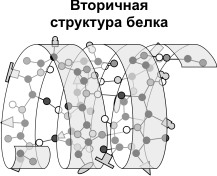
Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
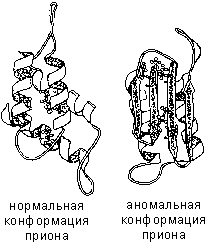
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.