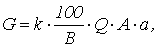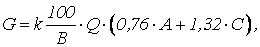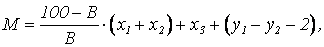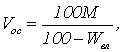Чем нейтрализуется серная кислота
Нейтрализация путем добавления реагентов
Если на промышленном предприятии имеются только кислые или щелочные воды или невозможно обеспечить их взаимную нейтрализацию применяется реагентный метод нейтрализации. Этот метод наиболее широко используется для нейтрализации кислых сточных вод. Выбор реагента зависит от вида кислот, их концентрации, растворимости солей, образующихся в результате химической реакции.
Для нейтрализации минеральных кислот применяется любой щелочной реагент, чаще всего известь-пушонка, известковое молоко, карбонаты кальция и магния в виде суспензии. Эти реагенты сравнительно дешевы и общедоступны, но имеют ряд недостатков: обязательно устройство усреднителей перед нейтрализационной установкой; затруднительно регулирование дозы реагента по рН нейтрализованной водой; сложное реагентное хозяйство.
Скорость реакции между раствором кислоты и твердыми частицами суспензии относительно невелика и зависит от размеров частицы и растворимости образующегося в результате реакции нейтрализации соединения. Поэтому окончательная активная реакция устанавливается не сразу, а по истечении некоторого времени – 10-15 мин. Сказанное выше относится к сточным водам, содержащим сильные кислоты (H2SO4, H2SO4), кальциевые соли которых труднорастворимы в воде.
При нейтрализации сточных вод, содержащих серную кислоту (H2SO4), реакция в зависимости от применяемого реагента протекает по уравнениям:
H2SO4+Ca (OH)2 = CaSO4+2H2O,
Образующийся в результате нейтрализации сульфат кальция (гипс) кристаллизуется из разбавленных растворов в виде CaSO4·2H2O. Растворимость этой соли при температуре 0-40 0С колеблется от 1,76 до 2,11 г/л.
При более высокой концентрации сульфат кальция выпадает в осадок, поэтому при нейтрализации сильных кислот, кальциевые соли которых труднорастворимы в воде, необходимо устраивать отстойники-шламонакопители. Существенным недостатком метода нейтрализации серной кислоты известью является образование пресыщенного раствора гипса (коэффициент пресыщения может достигать 4-6), выделение которого из сточной воды может продолжаться несколько суток, что приводит к зарастанию трубопроводов и аппаратуры. Присутствие в сточных водах многих химических производств высокомолекулярных органических соединений усиливает устойчивость пресыщенных растворов гипса, поскольку эти соединения сорбируются на гранях кристаллов сульфата кальция и препятствуют их дальнейшему росту.
Для уменьшения коэффициента пресыщения используется метод рециркуляции образующегося в результате нейтрализации осадка сульфата кальция. Концентрация ионов кальция в сточной воде уменьшается при увеличении дозы рециркулирующего осадка: продолжительность перемешивания этой воды должна быть не менее 20-30 мин. Для уменьшения зарастания трубопроводов, по которым транспортируются нейтрализованные известью сернокислотные стоки, применяют методы промывки, увеличивают скорость транспортирования, а также заменяют металлические трубопроводы на пластмассовые.
Поскольку в кислых и щелочных сточных водах практически всегда присутствуют ионы тяжелых металлов, то дозу реагентов следует определять с учетом выделений в осадок тяжелых металлов.
Количество реагента, необходимого для нейтрализации сточных вод определяется по формуле
где k – коэффициент запаса расхода реагента по сравнению с теоретическим k = 1,1 – для известкового молока, k = 1,5 – для известкового теста и сухой извести; В – количество активной части в товарном продукте, %; Q – количество сточных вод подлежащих нейтрализации, м3; а – расход реагента для нейтрализации (табл. 1.7), г/кг
Расход реагентов для нейтрализации 100 % кислот и щелочей
каустическая
0,67/1,5
При нейтрализации кислых и щелочных сточных вод содержащих соли тяжелых металлов, количество реагента будет определяться по формуле
где С1, С2. Сn – концентрации металлов в сточных водах, кг/м; b1, b2. bn, – концентрации реагентов, требуемых для перевода металла из растворенного состояния в осадок (табл. 1.8), кг/кг.
Расход реагентов, требуемых для удаления металлов
| Металл | Реагент СаО | Реагент Са(ОН)2 | Реагент Na2CO3 | Реагент NaOH |
| Цинк | 0,85 | 1,13 | 1,6 | 1,22 |
| Никель | 0,95 | 1,26 | 1,8 | 1,36 |
| Медь | 0,88 | 1,16 | 1,66 | 1,26 |
| Железо | 1 | 1,32 | 1,9 | 1,43 |
| Свинец | 0,27 | 0,36 | 0,51 | 0,38 |
Например, при нейтрализации гашеной известью сточных вод, поступающих после травления черных металлов серной кислотой происходят следующие реакции:
На основании приведенных выше реакций или данных в табл. 1.7 и 1.8, а также по содержанию серной кислоты и железа в отработанных травильных растворах можно определить количество гашеной извести, необходимой для нейтрализации кислых сточных вод и осаждения железа
где А – содержание серной кислоты, кг/м3; С – содержание железа, кг/м3.
Количество сухого вещества, которое образуется при нейтрализации 1м3 сточной воды, содержащей свободную серную кислоту и соли тяжелых металлов, определяется по формуле
где М – масса сухого вещества, кг; В – содержание активного вещества в используемой извести, %; х1, х2 – количество активного вещества, необходимое соотвественно для осаждения металла и для нейтрализациии свободной серной кислоты, кг; х3 – количество образующихся гидроксидов металлов, кг; у1, у2 – количество сульфата кальция, образующиеся соответственно при осаждении металла и при нейтрализации свободной серной кислоты, кг.
Если значение третьего члена в приведенной формуле отрицательно, то он не учитывается.
Объем осадка, образующегося при нейтрализации сточной воды можно найти по уравнению
где Wвл – влажность осадка, %.
Для нейтрализации кислых вод могут быть использованы: NaOH, КОН, Na2CO3. NH4OH (аммиачная вода), СаСО3. доломит (СаСО3. MgСО3 ) цемент. Однако наиболее дешевым реагентом является гидроксид кальция (известковое молоко) с содержанием активной извести Са(ОН)2 5-10 %. Соду и гидроксид натрия следует использовать, если они являются отходами производства. Иногда для нейтрализации применяют различные отходы производства. Например, шлаки сталеплавильного, феррохромового и доменного производств используют для нейтрализации вод, содержащих серную кислоту.
Реагенты выбирают в зависимости от состава и концентрации кислой сточной воды. При этом учитывают, будет ли в процессе образовываться осадок или нет. Различают три вида кислотосодержащих сточных вод: 1) воды, содержащие слабые кислоты (Н2СО3, СН3СООН); 2) воды, содержащие сильные кислоты (НСl, HNO3). Для их нейтрализации может быть использован любой названный выше реагент. Соли этих кислот хорошо растворимы в воде; 3) воды, содержащие серную и сернистую кислоты. Кальциевые соли этих кислот плохо растворимы в воде и выпадают в осадок.
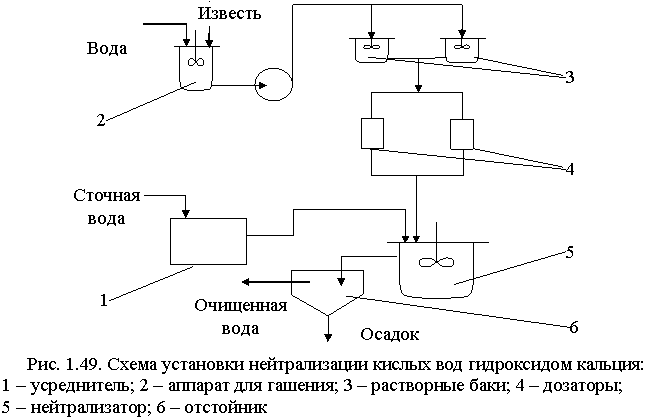
Известь для нейтрализации вводят в сточную воду в виде гидроксида кальция (известкового молока; «мокрое» дозирование) или в виде сухого порошка («сухое» дозирование). Схема установки для нейтрализации кислых вод известковым молоком показана на рис. 1.49.
Для гашения извести используют шаровые мельницы мокрого помола, в которых одновременно происходят тонкое измельчение и гашение. Для смешения сточных вод с известковым молоком применяют гидравлические смесители различных типов: дырчатые, перегородчатые, вихревые, с механическими мешалками или барботажные с расходом воздуха 5-10 м3/ч на 1 м2 свободной поверхности.
При нейтрализации сточных вод, содержащих серную кислоту, известковым молоком в осадок выпадает гипс CaSO4·2H:2O. Растворимость гипса мало меняется с температурой. При перемещении таких растворов происходит отложение гипса на стенках трубопроводов и их забивка. Для устранения забивки трубопровода необходимо промывать их чистой водой или добавлять в сточные воды специальные умягчители, например гексаметафосфат. Увеличение скорости движения нейтрализованных вод способствует уменьшению отложений гипса на стенках трубопровода.
Для нейтрализации щелочных сточных вод используют различные кислоты или кислые газы. Метод реагентной нейтрализации кислых и щелочных сточных вод широко используется на предприятиях химической промышленности.
Как действовать в аварийных ситуациях, связанных с кислотами и щелочами
При строгом соблюдении техники безопасности при хранении и транспортировке кислот и щелочей, а также при работе с ними, вероятность аварийной ситуации крайне мала. Тем не менее, знать, как действовать в случае ее возникновения, надо обязательно. Это может спасти чье-то здоровье или даже жизнь!
Чем опасны кислоты и щелочи
Контакт с кислотами и щелочами может вызвать химические ожоги; 
Все сотрудники лабораторий, имеющих дело с едкими реактивами, обязаны уметь оказывать первую помощь при химических ожогах; знать, где расположены аптечка, нейтрализующие растворы, песок и опилки. По технике безопасности в аптечке должны находиться по 1 л раствора борной или лимонной кислоты и раствора соды, или комплект PLUM с нейтрализующими растворами.
Приготовление нейтрализующего раствора
Для приготовления нейтрализующего раствора берут 1 литр воды и 10 г реактива (лимонной кислоты, борной кислоты, соды). Размешивают до полного растворения всех твердых частиц и переливают в пластиковые сосуды подходящего размера. Потом на них наклеивается этикетка с хорошо читаемым указанием названия, концентрации и назначения («нейтрализующий раствор для кислоты», «нейтрализующий раствор для щелочи»).
Приготовленные растворы должны храниться в аптечке или рядом с ней.
Что делать при химических ожогах
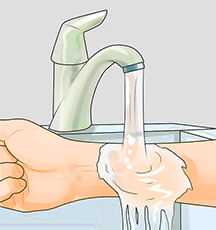
Место поражения щелочью обильно поливают 1%-ным раствором лимонной или борной кислоты.
Для химических ожогов специально предназначена нейтрализующая жидкость из комплекта PLUM (выливается весь флакон).
• Если кислота или щелочь попали в глаза, то они промываются нейтрализующим раствором, разведенным вдвое.
• После этого место ожога промывают водой, мылом и снова водой. Промывание водой должно длиться не менее 15 минут.
• Пострадавшего должен осмотреть врач для определения дальнейшего лечения. При необходимости вызывают «Скорую помощь».
Что делать при разливах
При разливе едкого хим. реактива крайне важно знать характер 
После того, как вся жидкость впиталась, песок или опилки сметают и утилизируют (захоранивают или передают на утилизацию сертифицированным организациям). Место пролива заливают нейтрализующим раствором (раствором соды или лимонной, борной кислоты), промывают водой и вытирают насухо.
Что делать при пожарах
Сами кислоты и щелочи, как правило, относятся к негорючим веществам, но они могут разлагаться при нагревании или вступать в реакции с металлами или органическими материалами, выделяя токсичные и горючие газы и вещества.
Если в зоне пожара оказались кислоты или щелочи, то все участвующие в тушении должны быть об этом проинформированы. Следует принять меры предосторожности, необходимые при контакте с кислотами или щелочами; использовать резиновую обувь, перчатки и респираторы, очки.
Пожар, в зоне которого оказались кислоты или щелочи, тушат песком, химической пеной, углекислым газом, мелкораспыленной водой.
Утилизация кислот: серной, соляной, азотной, уксусной и др.
Исследовательские центры и химические производства хранят продукты или образцы, которые они используют редко или никогда не используют. Нередко химикаты покупают оптом, чтобы сэкономить деньги. Вскоре их срок годности подходит к концу, об этих просроченных химикатах, включая и кислоты, можно забыть, положить их не на место или использовать только наполовину. Выбросить их в мусор нельзя. Обязательно проводится утилизация кислоты с истекшим сроком годности в соответствии с разработанными процедурами.
Зачем нужна утилизация кислот?
Проблема неграмотной утилизации кислот многогранна. Дело не только в загрязнении окружающей среды. Вред может наносится существенно раньше, чем через годы, доставляя неприятности не гипотетической окружающей среде, а непосредственно предприятию или учреждению, в котором хранится.
В крайних случаях некоторые из этих химических веществ, такие как пикриновая кислота, становятся взрывоопасными с возрастом. В течение нескольких месяцев она может взорваться только от трения открытия крышки.
Но наибольший ущерб кислоты наносят существенно чаще в виде штрафов за нарушение законов о хранении и утилизации опасных отходов. Тем более это актуально, если такие действия стали причиной ухудшения здоровья персонала. Чтобы предотвратить нежелательные последствия, рекомендуется придерживаться следующих рекомендаций:
Чтобы защитить сотрудников от потенциальных опасностей или просто сократить объем нежелательных материалов и риски штрафов, предприятия должны периодически удалять эти неиспользованные химические вещества. Рекомендуется прибегать к помощи специальных компаний. Но в некоторых случаях утилизацию кислот можно провести самостоятельно.
Утилизация кислот
В целом кислоты не должны выбрасываться в канализацию. Для их сбора и хранения нужно использовать емкость для отходов, предназначенную только для этих химикатов. Перед утилизацией их нужно разбавить. Если в канализацию удаляются небольшие количества разбавленных кислот и оснований ( Особенности утилизации кислот для отдельных видов
Утилизация серной кислоты может проводится тремя способами обезвреживания:
Утилизация соляной кислоты потребует разные щелочные растворы, которые ее нейтрализуют, а именно: каустическую соду, гашеную известь и едкий натрий – каждого по 5%.
Утилизация уксусной кислоты, как и в предыдущем случае требует применения раствора 5% щелочей. При ее попадании в грунт, его придется срезать и отвозить на захоронение на специальные полигоны.
Утилизация азотной кислоты проводится с помощью воды, которой разбавляют химикат. В процессе задействуют нитрат кальция, при помощи которого извлекают йод.
Централизованная утилизация
Если количество кислот, которые требуется утилизировать, измеряется литрами или десятками литров, требуется заказывать услуги специальных компаний. Процедура выглядит следующим образом:
Для пользователей сайта Vyvoz.org нами был собран (и постоянно пополняется) перечень организаций в крупных (и не только) городах России, которые занимаются утилизацией кислот:
На предприятии или учреждении должна сохраняться соответствующая документация: журналы учета опасных отходов, приказ о назначении ответственного лица, договор на утилизацию, акты приема-передачи и утилизации, переработки кислот. При отсутствии этих документов представители контролирующих органов составят акт о нарушении и наложат штраф. Юридическим лицам придется уплатить до 250 т.р. и более.
Инструкция по нейтрализации отработанной серной кислоты аккумуляторных батарей
Утверждаю:
Директор ООО » »
_______________ В.В.Иванов
« ____ » ____________ 2015г.
Инструкция
по нейтрализации отработанной серной кислоты аккумуляторных батарей (2 класса опасности).
1. Общие требования безопасности.
При сборе, хранении, нейтрализации отработанной серной кислоты от аккумуляторных батарей следует учитывать особенности ее эксплуатации и степень опасности.
Природные воды имеют нейтральную, слабокислую или слабощелочную реакцию, рН их находится в пределах 6.5 — 8,5. Электролит имеет кислую рН среду и представляет собой серную кислоту плотностью 1,2 — 1,27. Аккумуляторная серная кислота является достаточно концентрированной и не подлежит утилизации без предварительной нейтрализации.
Растворы серной кислоты оказывают вредное воздействие на организм человека.
При нагревании серной кислоты образуются пары сернистого ангидрида, которые, соединяясь с парами воздуха, образуют кислотный туман. При вдыхании паров серной кислоты раздражаются и прижигаются слизистые оболочки верхних дыхательных путей.
При попадании на кожу серная кислота вызывает сильные ожоги, болезненные и трудно поддающиеся лечению. Попадание серной кислоты в глаза грозит потерей зрения.
Персонал, занятый нейтрализацией аккумуляторной серной кислоты, должен работать в одежде из кисло-защитной ткани, прорезиненных фартуках, резиновых сапогах, резиновых кислостойких перчатках, защитных очках или щитках из оргстекла, иметь фильтрующий противогаз марки В.
Места сбора и нейтрализации аккумуляторной серной кислоты должны иметь предупредительные надписи.
2. Требования безопасности перед началом работы.
Получить инструктаж от ответственного за нейтрализацию, о мерах безопасности и производственной санитарии при работе с аккумуляторной серной кислотой.
Подготовить и проверить исправность защитных средств, приспособлений и другого инвентаря. Следует иметь в виду, что любые разбавленные растворы серной кислоты, к которым относится и электролит, крайне • агрессивны. Вследствие этого нейтрализацию электролита необходимо проводить с максимально возможной быстротой и без перерывов.
Разработал руководитель экологической службы организации_____________
Согласовано:
Инженер по охране труда _______________________________
Ожоги кислотой
Последнее обновление: 21.02.2021
Первая помощь при ожоге кислотой или щелочью
Оказание первой помощи при ожоге кислотами и щелочами должно произойти как можно быстрее, так как от этого зависят последствия травмы.
При ожоге кислотой необходимо:
Ожог кислотой: первая помощь
Данный химикат применяется в нефтяной, кожевенной, металлообрабатывающей, пищевой (в качестве эмульгатора) химической и аграрной промышленности (в составе минеральных удобрений). При контакте с кожными покровами вызывает окрашивание кожи в белый цвет, после чего образуется коричневый оттенок.
При контакте с кожей, слизистыми, а также при вдыхании паров данного вещества можно получить ожог кислотой. Лечение сводится к описанным выше рекомендациям.
Ожог борной кислотой
Данное вещество используется в основном в медицине, фотографии, пищевой промышленности и некоторых других отраслях. Если вы обожглись им, срочно проведите описанные выше процедуры по оказанию первой помощи.
Ожог лимонной кислотой
Этот химикат применяется в кулинарии, пищевой промышленности, при производстве косметики. При употреблении внутрь в больших дозах способен привести к повреждениям пищевода.
Ожоги азотной кислотой
При контакте с этим веществом кожа приобретает желтый цвет. Возможно появление долгозаживающих язв, поэтому необходимо как можно скорее оказать пострадавшему первую помощь.
Химический ожог соляной кислотой: первая помощь
Это едкое вещество используют в пищевой и гидрометаллургической промышленности, а также в медицине. При попадании на кожный покровы вызывает сильное жжение и образование струпов. Поддается нейтрализации раствором соды.
Чем лечить ожог от уксусной кислоты?
Водные растворы этого вещества используются в кулинарии, бытовой консервации, в ремонтных работах (например, при крашении), книгопечатании, в качестве растворителя, при получении некоторых фармацевтических препаратов. Обожженный участок тела нужно обработать так же, как и в описанных выше случаях.
Ожог уксусной кислотой и его особенности
Что делать при ожоге уксусной кислотой? Лечение должно проходить по описанному выше принципу. Обратите внимание на то, что последствия ожога кожи уксусной кислотой могут быть очень опасными (вплоть до некроза тканей), так что первую помощь необходимо оказать незамедлительно!
Если пострадавший принял химикат внутрь, может пострадать гортань (ее повреждение способно привести к нехватке воздуха), слизистая оболочка рта, пищевод, желудок. Не рекомендуется вызывать рвоту, так как повторное прохождение химиката через ЖКТ приводит к очень тяжелым последствиям. Требуется дать пострадавшему большое количество питья и как можно быстрее доставить в больницу, где ему введут зонд и промоют желудок.
Средства «Ла-Кри» и их помощь в заживлении ран
После того, как пойдет процесс заживления, можно начинать постепенное использование смягчающих кремов и эмульсий «Ла-Кри». Конечно, их нельзя расценивать как полноценное средство от ожогов кислотой, однако они способны оказывать увлажняющее, восстанавливающее и успокаивающее действие на поврежденный участок кожи.
Разработанные на основе натуральных негормональных компонентов и не содержащие парабены, отдушки и силиконы, средства «Ла-Кри» обеспечивают мягкий уход за восстанавливающимися кожными покровами. Они помогают снять зуд и обеспечивают достаточное питание поврежденным участкам кожи.
Мнение специалистов
Клинические исследования, проводимые при участии союза Педиатров России, позволили установить, что: