Чем не является жировая ткань
Ожирение
Ожирение — избыточное накопление жировой ткани в организме. Ожирение является мультифакториальным заболеванием, которое чревато многочисленными кардиологическими рисками и метаболически и расстройствами.
Составить суждение о содержании жировой ткани позволяет индекс массы тела (ИМТ). Этот показатель рассчитывается по формуле: ИМТ= Масса тела (кг)/Рост (м 2 ).
Показатель не информативен у спортсменов, а также у пожилых людей, поскольку в первом случае мускулатура избыточно развита, а во втором, наоборот, атрофирована.
Норма содержания жировой ткани у мужчин составляет 15–20% массы тела, у женщин — 25–30%.
Классификация
Существует несколько классификаций ожирения. В одной из них учитывается ИМТ и риск кардиометаболических расстройств.
Степень ожирения:
1) Нормальный вес, ИМТ 40.
В каждой из групп присутствуют лица с метаболически здоровым фенотипом: ОТ у мужчин ≤ 0,9; ОТ у женщин ≤ 0,85 и метаболически нездоровым фенотипом: ОТ у мужчин > 0,9; ОТ у женщин > 0,85, поскольку не у всех людей с ожирением наблюдаются расстройства метаболического плана и, наоборот, у части лиц на фоне нормальной массы тела присутствуют нарушения углеводного и липидного обменов. К группе «метаболически здорового ожирения» относят тех, у кого помимо ожирения присутствует один и менее дополнительный патологический фактор на фоне нормальной чувствительности тканей к инсулину.
По характеру течения ожирение бывает прогрессирующим, стабильным и резидуальным. Последнее отражает остаточные явления после стойкого снижения веса.
Обмен в жировой ткани и патогенез ожирения
Жировая ткань является одним из видов соединительной ткани в организме. Главной функцией жировой ткани является создание энергетического депо в виде запасов триглицеридов, обеспечение теплоизоляции, продукция гормонов и биологически активных веществ (адипонектин, лептин и прочее).
Жировая ткань представлена совокупностью жировых клеток — адипоцитов. Число и размеры адипоцитов — строго индивидуальный показатель, который варьирует от человека к человеку. Под действием гормонов таких как инсулин, глюкокортикоиды, Т3, количество адипоцитов может увеличиваться.
Постоянство массы и структуры тела обеспечивается благодаря взаимодействию нервных и гуморальных механизмов регулирования потребления пищи, расхода и запасания в виде энергии.
Гипоталамус является важнейшим регулятором пищевого поведения, поскольку в нём присутствуют «центр голода» и «центр насыщения». Гипоталамус контролирует работу центров по управлению пищевым поведением и расходом энергии.
Механизмы кратковременной или быстрой регуляции:
1) Наполненность желудка тормозит потребление пищи.
2) Приём пищи стимулирует выработку гормонов ЖКТ — холецистокинина, пептида YY, глюкагон-подобного пептида, которые формируют чувство насыщения.
3) Нахождение пищи в ротовой полости, слюноотделение, глотание тормозят активность «центра голода» гипоталамуса.
4) Уровень грелина — гормона желудка. После приёма пищи его уровень быстро снижается, пик концентрации наблюдается перед приёмом пищи.
Механизмы долговременной регуляции:
1) Снижение концентрации глюкозы, аминокислот, некоторых жирных кислот и кетокислот приводит к пищевой мотивации. При приёме пищи также увеличивается концентрация инсулина крови. Инсулин подавляет активность «центра голода».
2) Взаимодействие с «центром терморегуляции».
Потребление пищи увеличивается в условиях холода, снижается при жаре.
3) Сигналы от лептина — гормона жировой ткани, который передаёт сигнал от жировой ткани об энергетических запасах организма. Повышение уровня лептина пропорционально увеличению количества жировой ткани. Увеличение концентрации лептина в крови способствует развитию чувства насыщения и приводит к снижению потребления пищи. В гипоталамусе лептин инициирует сразу несколько ответов, сутью которых является снижение запасов жира. Лептин тормозит выделение нейропептида Y, который вызывает чувство голода; увеличивает активность симпатического отдела нервной системы, повышая активность метаболизма и расход энергии; снижает секрецию инсулина b-клетками поджелудочной железы.
Патогенез ожирения
Если энергии, заключённой в пище поступает в организм больше, чем расходуется, то масса тела повышается. Способом запасания энергии служит накопления жира. Поэтому причиной избыточного количества жировой ткани является превышение поступления источников энергии над её расходом. При этом не имеет значение какие вещества поступили в избыточном количестве — белки, жиры или углеводы.
Углеводы — предпочтительный источник энергии, нежели жиры. В условиях доступности, углеводы выполняют жиросберегающую функцию. Избыток углеводов, не использованный на энергетические ресурсы, превращается в жиры и депонируются.
Аналогично происходит с избытком белков.
Каждые 9,3 ккал избыточного поступления энергии приводят к отложению в организме 1 грамма жира. Жиры накапливаются под кожей, преимущественно в области бедёр, ягодиц и в висцеральных пространствах — в сальнике, брыжейке. Печень и прочие органы также запасают небольшие количества жиров, но в меньшем количестве.
Исследования последних лет показали, что новые адипоциты могут дифференцироваться из клеток-предшественников в любой период жизни и развитие ожирения у взрослых ассоциировано с увеличением не только размеров жировых клеток, но и их количеством.
Гормональная регуляция использования жиров
7 гормонов оказывают сильное регуляторное воздействие на жировой обмен:
1) Адреналин и норадреналин — два гормона, которые работают в условиях стрессовых реакциях. Кратковременный и сильный стресс, тяжёлые физические нагрузки вызывают мобилизацию жиров из депо.
2) АКТГ. Выделение гормона увеличивается также при стрессе, при этом под действием АКТГ увеличивается выброс кортизола. Кортизол — это гормон планового стресса в отличие от адреналина и норадреналина. Кортизол обладает кетогенным влиянием на мобилизацию жиров. Если стресс носит долговременный характер, то длительное и стойкое повышение кортизола приводит к ожирению, которым сопровождается синдром/болезнь Иценко-Кушинга.
3) Гормон роста. Активирует липолиз и, тем самым, увеличивает распад жиров. При ожирении концентрация гормона падает из-за повышения концентрации свободных жирных кислот и инсулина.
4) Тиреоидные гормоны. Стимулируют мобилизацию жиров, поскольку увеличивают основной обмен в клетках. При дефиците трийодтиронина, тироксина, гипотиреозе — наблюдается ожирение, так как снижается уровень основного обмена в клетках.
5) Инсулин. Активирует процесс синтеза и запасания жира — липолиза.
Причины ожирения
Существует комплекс причин, приводящих к ожирению. Существует генетическая обусловленность интенсивности энергетического обмена и потребления пищи, но, порой, факторы окружающей среды и образ жизни играют доминирующую роль в развитии ожирения.
1) Снижение энергозатрат, в том числе недостаточная физическая активность. У людей с ожирением небольшая физическая активность сочетается с уменьшением массы и увеличением жировых отложений.
Около 25–30% ежедневно расходуемой энергии приходится на энергозатраты, связанные с работой мышц. Поэтому регулярные физические нагрузки и тренировки увеличивают мышечную массу и снижают количество жировой ткани. Даже однократный эпизод физических упражнений увеличивает базальный расход энергии в течение нескольких часов после прекращения тренировки.
2) Нарушение пищевого поведения. Несмотря на наличие в организме физиологических механизмов, регулирующих потребления пищи, многие пагубные пищевые привычки могут стать причиной развития ожирения. Доказано, что у людей с ожирением в рационе превалируют продукты, богатые жирами. Такие продукты в меньшей степени растягивают стенки желудка, обладают излишней калорийностью, не требуют долгого пережевывания. Пища, богатая жирами вкуснее, поскольку содержит жирорастворимые ароматические молекулы, определяющие её вкус. Дополнительно, на депонирование жиров требуется меньше энергии организму, чем на углеводы.
3) Психогенные факторы. У некоторых людей развитие ожирения обусловлено психологическими факторами. Резкая прибавка массы тела наблюдается во время стресса или после него, поскольку происходит снижение чувствительности «центра насыщения». Например, потеря близкого родственника, увольнение, тяжёлая болезнь и депрессивные состояния зачастую становятся причиной переедания. Пища для такого человека становится средством снижения эмоционального напряжения.
4) Перекармливание детей. Скорость образования новых жировых клеток особенно велика в первые годы жизни. Чем выше скорость, тем больше будет дифференцироваться адипоцитов в организме, тем выше риск ожирения.
5) Лептинорезистентность. У людей с ожирением уровень лептина высок, но рецепторы гипоталамуса становятся нечувствительны к его сигналам или нарушается процесс передачи сигнала. В результате чувствительность «центра насыщения» снижается, появляется склонность к перееданию. Такое состояние носит название лептинорезистентности. Оно чревато тем, что способствует развитию инсулинорезистентности. Оба состояния являются факторами риска развития сердечно-сосудистых заболеваний и сахарного диабета 2 типа.
6) Нейрогенные расстройства. Такие состояния, как опухоли и травмы гипофиза и гипоталамуса могут нарушать регуляторные системы, контролирующие пищевое поведение.
Диагноз ожирения и дальнейшее ведение пациента основываются на анамнестических данных и данных, полученных в результате внешнего осмотра, лабораторного и инструментального обследования.
При сборе анамнеза врач уточняет время возникновения ожирения, интересуется динамикой изменения веса, есть ли ожирение у родственников, какой образ жизни, режим физической активности, питания у пациента.
В ходе осмотра обязательно измеряются объём талии, объём бедер, рассчитывается соотношение ОТ/ОБ и индекс массы тела.
Виды жировой ткани, их описание
Жировой ткани отведена важная роль в человеческом здоровье. Данный тип ткани начинает свое формирование уже на четвертом месяце эмбрионального развития организма человека. Основная составляющая жировой ткани – это адипоциты, или жировые клетки, большая часть которых располагается в подкожной клетчатке и прочих жизненно важных органах. В течение нескольких первых лет жизни человека отмечается активный рост размеров и числа адипоцитов. По словам специалистов, появление новых жировых клеток вскоре начинает сокращаться, и уже к 11-12 годам происходит формирование их индивидуального количества, которое может отличаться у разных людей.
Адипоциты примерно на 85% состоят из триглицеридов – особого природного вещества, синтезирующегося из компонентов, образующихся путем расщепления пищевых жиров. В такой форме жировые соединения обычно сохраняются в человеческом организме.
ВАЖНО: Белая жировая ткань может накапливаться в подкожной клетчатке в избыточном количестве у людей, имеющих избыточный вес или страдающих от ожирения.
В процессе расщепления триглицериды являются энергетическим источником, на долю данного вещества приходится около 90% всех запасов энергии в организме. Специалисты считают, что данный резерв энергии важен для нормального роста, репродуктивной функции и прочих физиологических процессов. Если сравнивать с триглицеридами, то энергетический запас гликогена и белка составляет небольшую часть и используется только для быстрого восполнения энергии при недлительном голодании или при физических нагрузках. Энергия жировой ткани не затрачивается организмом по мелким нуждам, она сохраняется на случай серьезных жизненных проблем, благодаря чему живой организм в тяжелой ситуации будет иметь возможность прожить без пищи длительное время.
Основная составляющая жировой ткани – адипоциты
Функции жировой ткани
Слои жировой ткани
Специалисты называют три слоя жировой ткани:
По словам специалистов, жировая ткань распределяется по всему человеческому организму, но здесь имеются небольшие отличия у женщин и мужчин. В женском организме жировая ткань составляет около четверти всей массы тела, подкожно-жировой слой имеет большую толщину, чем у мужчин, а жиры откладываются в области бедер, груди и таза. В мужском организме жировая ткань распределена равномерно и составляет от 15 до 20% массы тела, при этом структура жировой ткани имеет большую плотность, чем у женщин, поэтому целлюлит у мужчин – достаточно редкое явление.
Жировую ткань составляют бурые и белые клетки. Бурая жировая ткань может согревать организм при помощи тепловой выработки, она же отвечает за рассеивание излишка энергии, потребляемой с пищей. Белая жировая ткань содержится в организме в большем количестве, нежели ткань бурая, она отвечает за выполнение всех функций, отводимых жировой ткани.
Слои жировой ткани
Возможности бурой ткани
Бурая жировая ткань имеет особые свойства метаболизма. Как и многие другие ткани, она способна к окислению субстратов в митохондриях с помощью цикла трикарбоновых кислот. В тканях, где содержатся митохондрии, происходит перенос протонов наружу на внутреннюю мембрану. Данный процесс в митохондриях бурой ткани разделен протеином разобщения – термогенином, за счет чего высвобожденная энергия переходит в тепло, высвобождаются жирные кислоты, а их уровень в крови, оттекающей от ткани, увеличивается. Известно, что бурая жировая ткань организма имеет полноценное кровоснабжение.
Бурая жировая ткань играет важную роль в жизни животных, которым необходима выработка тепла, например, во время спячки. В этот период скорость метаболизма и температура тела снижается, сохраняя пищевые запасы. Тепло, производимое бурой тканью, также вызывает пробуждение животных от спячки весной.
Люди и крупные взрослые животные имеют терморегуляцию с выделением лишнего тепла, устраняемого потовыми железами при необходимости. В организме маленького ребенка бурая жировая ткань имеет большое значение, поэтому его у них больше, нежели у взрослых, но ребенку требуются дополнительные механизмы выработки тепла.
Таким образом, имеется целый ряд аналогичных протеинов:
Кроме этого, имеются разобщающие растительные протеины, способные согревать ткани перед началом прорастания семян растения.
Некоторые варианты белков способны к индукции разобщения, но главной их функцией остается транспортировка жирных кислот из матрикса митохондрий на внешнюю часть внутренней мембраны. В пределах матрикса происходит накопление жирных кислот в ходе их повышенного окисления при голодании, что является стимулом для начала экспорта жирных кислот наружу.
Метаболические процессы белой жировой ткани
Взрослые организмы практически не содержат бурого жира, его полностью заменяет жир белый. Основное значение метаболизма белой жировой ткани – контроль процесса высвобождения жира в виде неэтерифицированных жирных кислот и запасания жира в форме триацилглицерида.
Жировая ткань имеет метаболическую инертность – она практически не потребляет кислород. Основную часть метаболизма энергии составляет транспорт жирных кислот внутрь и наружу. Жиры не растворяются в воде, и их наличие в плазме связано с некоторыми механизмами транспортировки. Липидный избыток в плазме способен вызвать некие побочные эффекты. Очевидно, что роль белого жира как регулятора необходима для здорового организма.
Постоянное присутствие повышенного уровня триацилглицеридов или холестерина в крови приводит к образованию жировых отложений в артериальной стенке – атеросклероз.
Чрезмерное высвобождение неэтерифицированных жирных кислот, происходящее в ходе стресса, оказывает побочные эффекты на работу сердца, способно развить фибрилляцию желудочков. Нередко из-за сильного стресса происходили сердечные приступы.
Если высокий уровень неэтерифицированных жирных кислот держится долгое время, нарушается тканевая чувствительность к инсулину и нарушается процесс секреции инсулина в поджелудочной железе. Исследования выявили, что повышенный уровень жирных кислот в плазме имеет связь с риском развития сахарного диабета 2 типа и летального исхода из-за сердечного приступа.
Одним из наиболее редких и сложных ситуаций избыточной плазменной концентрации липидов считается эмболия жира. Она может происходить после переломов трубчатых длинных костей, при этом в кровеносные сосуды попадают клетки жира из желтого костного мозга. Жирные капли представляют угрозу здоровью организма и могут заблокировать кровеносные легочные сосуды.
Все ситуации, относящиеся к избытку липидов в кровотоке, требуют сокращения их поступления и удаления из крови. Регулировать поступление липидов в кровь помогает белая жировая ткань. Таким образом, существуют два пункта метаболического процесса белой жировой ткани:
Оба эти процесса регулируются и происходят в одно время, они зависимы друг от друга.
Опасный ген ожирения
Ученые из Каролинского института в Швеции в ходе недавнего исследования сумели выявить ген, который отвечает за развитие наиболее опасного жира в человеческом организме (в плане осложнений). По словам научных специалистов, данный ген может являться фактором риска развития сахарного диабета 2 типа и инсулинорезистентности.
Бурая и белая жировая ткань
Белая жировая ткань, считающаяся «плохим» жиром организма, подразумевает рыхлую ткань, состоящую в большинстве своем из адипоцитов. Данные жировые клетки отвечают за выполнение функции сохранения и в дальнейшем высвобождения энергии в человеческом организме.
ВАЖНО: В женском организме жировая ткань составляет около четверти всей массы тела, подкожно-жировой слой имеет большую толщину, чем у мужчин, а жиры откладываются в области бедер, груди и таза.
У человека имеется две разновидности жировой ткани: бурый и белый жир. В последнее время бурая жировая ткань считается «хорошим» жиром организма. По словам специалистов науки, основная роль бурого жира состоит в накоплении и выработке энергии с целью обеспечения физиологических процессов. Ученым удалось выяснить, что люди с весом в норме склонны к накоплению бурой жировой ткани, служащей субстратом энергии при физических нагрузках.
Белая жировая ткань может накапливаться в подкожной клетчатке в избыточном количестве у людей, имеющих избыточный вес или страдающих от ожирения.
Ученые из Швеции утверждают, что увеличенное число и размер адипоцитов может вызвать чрезмерное накопление белой жировой ткани и повышает риск развития сахарного диабета 2 типа. В недавнем исследовании ученые установили, что гипертрофия адипоцитов может быть связана с геном EBF1, низкий уровень экспрессии которого провоцирует инсулинорезистентность.
Ген, вызывающий ожирение
В ходе исследовательской деятельности ученые проводили анализ жировой ткани участников с крупными и мелкими жировыми клетками. Было выявлено, что у пациентов с крупными жировыми клетками экспрессия гена EBF1 в жировой ткани снижена по сравнению с пациентами, адипоциты которых имели малый размер. Кроме этого, у лиц с крупными адипоцитами отмечается изменение липидного транспорта и инсулинорезистентность, что говорит о высоком риске развития сахарного диабета по причине повышения в крови уровня глюкозы и липидов.
В дальнейшем ученые проводили эксперименты на мышах со специально сниженной экспрессией гена EBF1. Результатом стала гипертрофия адипоцитов и высвобождение липидов. После питания мышей продуктами с высоким жировым содержанием появлялась инсулинорезистентность.
Новые возможности науки
По мнению ученых, ген EBF1 связывается с белком, управляющим другими генами, регулирует образование адипоцитов и контролирует метаболизм. По словам профессора Петра Арнера, данные результаты могут создать новые возможности для лечения сахарного диабета 2 типа.
По словам профессора, в скором времени будут разработаны новые препараты, улучшающие обмен веществ и функцию гена EBF1 в жировой ткани организма человека. Благодаря этому в будущем могут быть найдены новые пути лечения сахарного диабета 2 типа.
Жировая ткань
Содержание
Жировая ткань [ править | править код ]
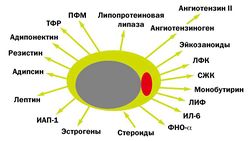
Жировая ткань является местом интенсивного метаболизма половых стероидов и сложным гормонально активным органом, играющим важнейшую роль в регуляции энергетического баланса и гомеостаза всего организма в целом (рис.1).
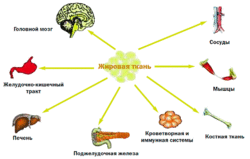
Секретируемые жировой тканью вещества — адипокины — обладают разнообразными метаболическими эффектами. Оказывая воздействие ауто/паракринным способом, они регулируют рост, развитие и метаболизм адипоцитов. Поступая в общую циркуляцию, адипокины действуют как эндокринные сигналы, оказывая влияние на функцию различных органов и систем организма: мозг, печень, мышцы, почки, эндотелий, иммунную систему и др. Так же адипоциты секретируют важные регуляторы липопротеинового метаболизма, такие как липопротеиновая липаза, аполипопротеин Е, переносящий эфиры холестерина протеин.
Выявлены новые носители информации в жировой ткани – молекулы микроРНК. В организме микроРНК участвует в регуляции работы генов при помощи механизма так называемой РНК-интерференции. Между клетками молекулы микроРНК путешествуют в экзосомах, небольших образованиях из цитоплазмы, имеющих мембрану. Когда экзосома достигает своей цели, микроРНК попадает в нужную клетку и работа генов в этой клетке корректируется.
Содержащиеся в жировой ткани нервные, стромальные и иммунные клетки обладают определенной секреторной активностью. Многие гормоны — катехоламины, инсулин, кортикостероиды, андрогены и др. в свою очередь оказывают влияние как на функцию адипоцитов, так и на эффекты адипокинов.
Таким образом, помимо депонирования энергии, жировая ткань через адипокины обладает способностью взаимодействовать с различными органами и системами, включая и ЦНС, и тем самым участвовать в регуляции разнообразных функций организма (рис. 2), а через взаимодействие с нейроэндокринной системой в адаптации организма к различным внешним воздействиям, таким как голод, стресс, переедание.
Избыточное развитие жировой ткани, особенно в висцеральной области, прямо коррелирует с инсулинорезистентностью, гипергликемией, дислипидемией, артериальной гипертензией, протромботическим и провоспалительным состояниями.
Адипокины, секретируемые жировой тканью:
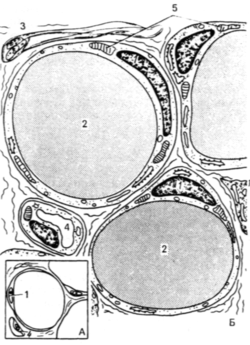
Строение жировой ткани [ править | править код ]
Это скопление жировых клеток. В соответствии наличию 2 типов жировых клеток различают 2 разновидности жировой ткани:
Функции белого жира: запас энергетического материала и воды;
механическая защита; участие в терморегуляции (теплоизоляция).
Ожирение и эндокринная функция жировой ткани [ править | править код ]
Жировая ткань является органом, поскольку секретирует молекулы, обладающие аутокринными, паракринными и эндокринными свойствами.
Ожирение характеризуется увеличением размеров (гипертрофия) и числа (гиперплазия) адипоцитов, приводящим к количественным и качественным изменениям продукции цитокинов, способствующим развитию инсулинорезистентности и изменений системного метаболизма. Как инсулинорезистентность, так и происходящие при этом изменения липолиза и липогенеза, функциональной активности нейроэндокринной системы, например, активация гипоталамо-гипофизарно-надпочечниковой оси, в начальных стадиях развития ожирения носят адаптационный характер, в процессе же постоянного нарастания веса они становятся дезадаптивными, патологическими и приводят к развитию осложнений, наблюдаемых у лиц с избыточным весом или ожирением.
Практически все цитокины, секретируемые адипоцитами, оказывают прямое или косвенное влияние на реализацию эффектов инсулина в периферических тканях. Можно сказать, что цитокины образуют «систему», регулирующую действие инсулина в организме. Развивающееся при ожирении снижение чувствительности тканей к инсулину (инсулинорезистентность) имеет исключительное значение в механизмах развития сахарного диабета и сердечно-сосудистых заболеваний, являющихся спутниками избыточного отложения жира в организме.
Так, имеющиеся при ожирении гиперлептинемия и лептинорезистентность могут быть одним из ведущих факторов в развитии инсулинорезистентности, а также нарушении функции р-клеток и ускорении процессов атерогенеза. Сочетание периферической леп-тинорезистентности, повышенной концентрации в плазме свободных жирных кислот, триглицеридов, липопротеинов низкой плотности и хиломикронов, развивающееся на фоне гиперкортизолемии, приводят при ожирении к развитию липотоксических нарушений, конечным результатом которых являются проявления метаболического синдрома: инсулинорезистентность, гиперлипидемия, гипергликемия, повышение АД, кардиомиопатия.
В условиях лептинорезистентности усиливается также влияние лептина на кальцификацию сосудов, аккумуляцию холестерина макрофагами, инициацию оксидативного стресса, повышение тонуса симпатической нервной системы, повышение АД. Все эти процессы в совокупности способствуют ускоренному развитию атеросклеротических изменений сосудов при ожирении.
Нарастание жировой массы в организме сопровождается повышением секреции ФНО-α, ИАП-1, ИЛ-6, способствующих, в свою очередь, также развитию инсулинорезистентности, активации клеточного транскрипционного фактора каппа В (ЯТФ-КВ), воспалительных реакции в сосудистой стенке, внутриклеточной адгезии моноцитов и всего каскада оксидативного стресса. Протективные механизмы адипонектина в отношении развития атеросклероза вследствие снижения его секреции также утрачиваются при ожирении, особенно при его висцеральной форме. Увеличение секреции ангиотензина II, являющегося проатерогенным белком, стимулирующим внутриклеточную адгезию молекул в сосудистую стенку, образование свободных радикалов, нарушение целостности сосудистой стенки, также провоцирует развитие эндотелиальной дисфунции.
Наблюдаемая при ожирении повышенная секреция ИЛ-6, хотя и способствует снижению активности ЛПЛ и тем самым некоторому ограничению нарастания веса, в то же время через воздействие на печень содействует развитию дислипидемии и нарушениям свертывающей системы крови.
Жировая ткань различной локализации отличается по уровню экспрессии и секреции как адипокинов, так и специфических рецепторов. Например, экспрессия и секреция ИЛ-6, ИАП-1 и адипонектина, экспрессия ангиотензиновых рецепторов 1 типа, βЗ-адренергических, глюкокортикоидных и андрогенных рецепторов, а также 11βГДГ относительно выше в висцеральной жировой ткани, лептина — в подкожной. Более того, адипокины, секретируемые висцеральной жировой тканью, вследствие ее топографических особенностей поступают преимущественно в портальную систему и печень, тогда как из подкожных депо в системный кровоток. В связи с этим, висцеральная жировая ткань оказывает, главным образом, влияние на метаболические процессы, происходящие в печени. Увеличенное поступление свободных жирных кислот в печень приводит к снижению связывания инсулина гепатоцитами, обуславливая развитие инсулинорезистентности на уровне печени, снижение экстракции инсулина печенью и развитие системной гиперинсулинемии. Свободные жирные кислоты также подавляют тормозящее действие инсулина на глюконеогенез, способствуя увеличению продукции глюкозы печенью; обуславливают увеличение синтеза триглицеридов липопротеинов очень низкой плотности и нарушения метаболизма липидов.
Топографические и функциональные особенности различных компартментов жировой ткани лежат в основе известных метаболических различий между висцеральным и глютеофеморальным типами ожирения. Однако важно учитывать, что размеры различных депо жировой ткани могут определять их относительный вклад в развитие нарушений метаболизма при ожирении и даже нивелировать метаболические различия между основными типами ожирения
Висцеральная жировая ткань менее эффективна, чем подкожная в регуляции энергетического баланса, осуществляемой через продукцию лептина.
Имеющаяся функциональная гетерогенность различных депо жировой ткани позволяет высказать предположение, что жировая ткань может быть не единым, а, возможно, группой схожих, но единственных в своем роде эндокринных органов.
Развивающиеся эндокринные и метаболические изменения по мере развития ожирения нарушают энергетический гомеостаз. Причем при ожирении увеличивается не только продукция адипокинов, но и происходят изменения биоактивности цитокинов через нарушение выделения растворимых рецепторов.
Таким образом, профиль цитокинов и жирных кислот, выделяемых жировой тканью, определяется метаболическими нуждами организма (характером питания, уровнем стресса, физической активностью, репродуктивной активностью), он также формируется и зависит от степени развития и особенностей распределения жировой ткани в организме, качественных и количественных изменений ее функциональной активности.
При постоянном, избыточном поступлении энергии развивается дисфункции жировой ткани, которая и лежит в основе прогрессирования ожирения и развития совокупности метаболических нарушений и заболеваний, сопровождающих избыточное накопление жира в организме.