Что значит усиление неметаллических свойств
Большая Энциклопедия Нефти и Газа
Усиление неметаллических свойств в пределах данного периода иллюстрируется изменением характера оксидов и гидроксндов, образуемых элементами этого периода. [1]
Рассматриваемые бинарные соединения приближаются по свойствам к солям при усилении неметаллических свойств элемента В. Так, в естественном ряду-карбиды, нитриды, теллуриды, селениды, сульфиды, иодиды металлов-наблюдается постепенное нарастание свойств, характерных для солей. Иодиды и большинство сульфидов являются типичными солями; то же наблюдается и при усилении металлических свойств элемента А. [3]
Номер периода соответствует числу энергетических слоев, а последовательность размещения электронов по энергетическим слоям позволяет объяснить ослабление металлических и усиление неметаллических свойств элементов слева направо в пределах одного периода. Легко объяснимым стал и тот факт, почему изменение химических свойств элементов больших периодов от типично металлических до неметаллических происходит значительно медленнее, чем в малых. [4]
Наиболее велики они у галогенов, имеющих на внешнем уровне по 7 электронов. Это говорит об усилении неметаллических свойств элементов по мере приближения к концу периода. [5]
В отличие от гидратов двуокисей углерода и кремния, гидрат двуокиси германия H4GeO4 представляет собой амфотерное соединение с преобладанием кислотных свойств. Следовательно, для типических элементов и их аналогов характерным является уменьшение металлических и усиление неметаллических свойств при переходе от одного элемента к другому в периоде слева направо. [9]
Величины сродства к электрону известны не для всех элементов, их измерять весьма трудно. Наибольшие значения этих величин у галогенов, так как на внешнем уровне их атомов находится по 7 электронов ( табл. 7), что указывает на усиление неметаллических свойств элементов по мере приближения к концу периода. [12]
Сродство к электрону атомов металлов, как правило, близко к нулю или отрицательно; из этого следует, что для атомов большинства металлов присоединение электронов энергетически невыгодно. Сродство же к электрону атомов неметаллов всегда положительно и тем больше, чем ближе к благородному газу расположен неметалл в периодической системе; это свидетельствует об усилении неметаллических свойств по мере приближения к концу периода. [13]
Обычно сродство к электрону, как и энергия ионизации, выражается в электрон-вольтах. Значения величины сродства к электрону известны не для всех элементов; измерять их весьма трудно. Наиболее велики они у галогенов, имеющих на внешнем уровне по 7 электронов. Это говорит об усилении неметаллических свойств элементов по мере приближения к концу периода. [15]
Усиление металлических и неметаллических свойств в таблице
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.
Как изменяются металлические свойства в периодической системе
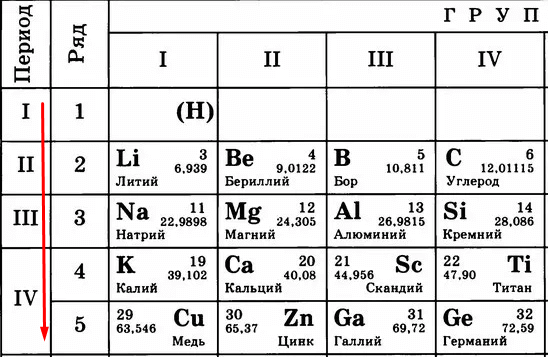
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.
Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
Нужна помощь! Пожалуйста объясните, что такое металлические и неметаллические свойства.
Закономерности, связанные с металлическими и неметаллическими свойствами элементов.
Это объясняется тем, что правее находятся элементы, электронные оболочки которых ближе к октету. Элементы в правой части периода менее склонны отдавать свои электроны для образования металлической связи и вообще в химических реакциях.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
У d- и f-элементов, как мы знаем, есть «резервные» электроны из «предпоследних» оболочек, которые усложняют простую картину, характерную для s- и p-элементов. В целом d- и f-элементы гораздо охотнее проявляют металлические свойства.
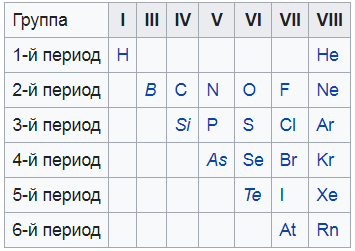
Подавляющее число элементов является металлами и только 22 элемента относят к неметаллам: H, B, C, Si, N, P, As, O, S, Se, Te, а также все галогены и инертные газы.
Некоторые элементы в связи с тем, что они могут проявлять лишь слабые металлические свойства, относят к полуметаллам.
2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой «шубой» из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
Металлы и неметаллы – в чем разница и как понять, когда металлические свойства усиливаются, а когда ослабевают
Одни отдают электроны, другие принимают.
Металлы – это такие элементы, которые стараются отдавать свои электроны. Неметаллы – наоборот, стараются их принимать. Вам надо понять, почему это происходит, и что значат фразы типа «металлические свойства усиливаются, а неметаллические ослабевают». Сейчас я вам это объясню.
Почему металлические свойства слабеют «слева направо»
Протоны и нейтроны находятся в ядре. Поэтому заряд ядра всегда плюсовой. А электроны крутятся вокруг ядра и притягиваются к нему, потому что у них заряд минусовой.
Электроны крутятся по электронным уровням – как планеты по орбитам вокруг Солнца.
Атомный номер показывает, сколько в атоме протонов. Как видите, это количество постоянно увеличивается.
Чем больше протонов, тем сильнее они «тянут» к себе электроны. Сравните:
Вывод – чем больше становится протонов, тем сильнее они удерживают электроны. Тем сложнее становится эти электроны отдавать. Поэтому слева направо, с увеличением порядкового номера (и, соответственно, числа протонов) металлические свойства слабеют, а неметаллические усиливаются.
На заметку – про радиус атома
Чем сильнее протоны притягивают электроны, тем ближе эти электроны становятся к протонам. Поэтому радиус атома уменьшается, атом как бы сжимается из-за увеличения заряда.
Почему неметаллические свойства слабеют «сверху вниз»
Идем дальше. Период в таблице показывает количество уровней (тех самых орбит), по которым летают электроны.
Чем больше период, тем больше этих орбит и тем дальше оказываются электроны от ядра. Сравните:
Кому сложнее удерживать электроны на последнем уровне? Меди, конечно, потому что эти электроны в два раза дальше от ядра, чем, например, у лития. Их проще становится отдать, чем пытаться удерживать.
Следовательно, «сверху вниз» количество уровней, по которым движутся электроны, растет, удерживать их становится сложнее, поэтому металлические свойства усиливаются, а неметаллические – слабеют.
Если смотреть на таблицу «сверху вниз» радиус ядра растет, потому что уровней становится больше.
Да, заряд атома тоже растет, но все-таки расстояние перевешивает. Чем больше уровней, тем труднее становится держать электроны, даже несмотря на то, что заряд увеличивается.
Из этих двух положений следует, что в правом углу таблицы Менделеева будут сосредоточены неметаллы, а в левом – металлы.
Я нашел вам вот такую картинку, на ней показаны все неметаллы. То, что выделено курсивом – это так называемые металлоиды – вроде и не совсем металлы, и в то же время не неметаллы. Нечто среднее.
Это основа основ. Надеюсь, я объяснил понятно и вы разобрались. Если нет – перечитайте еще раз, задайте вопросы мне в комментариях. Только когда разберетесь – читайте дальше.
Свойства металлов
Эти свойства проявляются в разной мере, но все-таки присущи всем металлам:
На сегодняшний день металлов известно 87.
Свойства неметаллов
У них почти все наоборот:
Неметаллов на данный момент 22.
Это первая статья по химии на нашем сайте. Напишите, что не так, что нравится и не нравится. Я буду думать, как сделать материал лучше.
И еще – есть идея записывать видеоролики с объяснениями. Лично вам удобнее разбираться в чем-то, читая текст, или просматривая видео?
Буду рад каждому вашему отзыву и комментарию.
Общая характеристика неметаллов

Неметаллы – это химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы. Практически все неметаллы имеют сравнительно малые радиусы и большое число электронов на внешнем энергетическом уровне от 4 до 7, для них характерны высокие значения электроотрицательности и окислительные свойства.

Электронные конфигурации валентных электронов элементов-неметаллов приведены в таблице:
Закономерности в изменении свойств элементов-неметаллов
В периоде с ростом заряда ядра (слева направо):
В группе с ростом заряда ядра (сверху вниз):
Таким образом, чем правее и выше стоит элемент в Периодической системе, тем ярче выражены его неметаллические свойства.
Неметаллами в главной подгруппе IV группы Периодической системы Д.И. Менделеева являются углерод и кремний. На внешнем энергетическом уровне этих элементов находятся 4 электрона (ns 2 np 2 ). В своих неорганических соединениях углерод имеет степень окисления +2 (в невозбужденном состоянии) и +4 (в возбужденном состоянии). В органических соединениях степень окисления углерода может быть любой от –4 до +4.