Что значит сильные электролиты
Разница между сильными и слабыми электролитами
Содержание:
Ключевые области покрыты
1. Что такое сильные электролиты
— определение, свойства, реакции
2. Что такое слабые электролиты
— определение, свойства, реакции
3. В чем разница между сильными и слабыми электролитами
— Сравнение основных различий
Ключевые термины: кислоты, основания, электролиты, соли, сильные электролиты, слабые электролиты.
Что такое сильные электролиты
Например, сильные кислоты, такие как HCl, HNO3 сильные электролиты. Они диссоциированы в их катион H + и анион полностью. Сильные основания, такие как NaOH, полностью диссоциируют на ионы, которые могут проводить электричество.
Что такое слабые электролиты
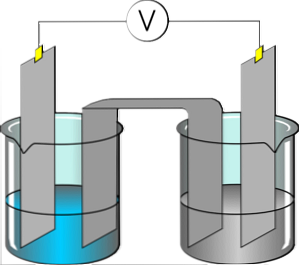
Обычно около 1-10% соединения диссоциирует на ионы. Большинство азотсодержащих соединений являются слабыми электролитами. Вода также считается слабым электролитом, поскольку молекулы воды частично диссоциируют на Н + и ОН – ионов.
Рисунок 2: Молекулы воды частично диссоциируют на ион
Поскольку эти слабые электролиты частично растворяются в воде, раствор слабых электролитов состоит из молекул, катионов и анионов. Поскольку существует несколько электрически заряженных ионов, эти растворы могут проводить электрический ток.
Некоторые общие слабые электролиты являются слабыми кислотами, такими как H2Колорадо3и слабые основания, такие как NH3, Для слабых электролитов константы диссоциации важны при прогнозировании емкости электрического заряда, который может быть проведен через раствор, поскольку диссоциация соединения образует растворимые ионы, которые могут проводить электричество.
Разница между сильными и слабыми электролитами
Определение
диссоциация
Сильные Электролиты: Сильные электролиты могут полностью диссоциировать на ионы.
Слабые электролиты: Слабые электролиты частично диссоциируют на ионы.
Примеры
Слабые электролиты: Слабыми электролитами являются слабые кислоты, слабые основания и некоторые соли.
Заключение
Электролиты представляют собой соединения, которые могут растворяться в воде с выделением катионов и анионов. Эти ионы могут способствовать прохождению электричества через раствор. Основное различие между сильными электролитами и слабыми электролитами заключается в том, что сильные электролиты могут почти полностью диссоциировать на ионы, тогда как слабые электролиты частично диссоциируют на ионы.
Определение сильных и слабых электролитов
Что такое электролиты — общие понятия
Электролиты — это вещества, которые могут проводить электрический ток после распада на ионы (или диссоциации). Это происходит в растворах и расплавах или, если электролит является твердым, — в кристаллических решетках. Примеры электролитов:
Для электролитов характерна сильно полярная ковалентная или ионная химическая связь. В противном случае вещество не способно распадаться на ионы в растворах и расплавах, вследствие чего они не проводят электрический ток. К неэлектролитам в химии относят вещества с ковалентной слабо полярной связью (в основном, это органические соединения, например, глицерин, сахароза и т.д.) и вещества с ковалентной неполярной связью (простые вещества неметаллы, например, водород, сера и т.д.)
Впервые теорию электролитической диссоциации (распада электролитов на ионы) предложил шведский физик и химик С. Аррениус. Он обнаружил, что в растворах, проводящих ток, содержится больше частиц и сделал вывод о том, что в растворах и расплавах эти виды веществ распадаются на ионы.
Наблюдая за движением частиц, ученый также установил, что они обладают различными зарядами. Так положительно заряженные ионы называются катионами, а отрицательно заряженные — анионами.
Определение сильных и слабых, как распознать
Аррениус является автором теории электролитической диссоциации. Под этим понятием подразумевается процесс, при котором вещество распадается на отдельные ионы. Степень диссоциации зависит от характера электролита и вычисляется по формуле:
α = ( N д и с ) / ( N о б щ ) × 100 %
Краткий вид формулы:
α = ( N д и с ) / ( N о б щ )
Если этот показатель превышает 30% (или 0,3), то электролит считается сильным. В уравнении их распада ставится знак «→», поскольку процесс необратимый. К подобным относятся:
Если степень диссоциации меньше 3% (или 0,03), то такие электролиты называют слабыми. Реакции с ними обратимы, поэтому используется знак «⇄» или «↔». К подобным относятся:
Сильные и слабые электролиты, отличия, примеры
электролиты они представляют собой вещества, которые образуют электропроводящий раствор при растворении в полярном растворителе, таком как вода. Растворенный электролит разделяется на катионы и анионы, которые диспергированы в указанном растворе. Если к раствору приложен электрический потенциал, катионы будут прилипать к электроду, который содержит большое количество электронов..
Напротив, анионы в растворе будут связываться с электрически дефектным электродом. Вещество, которое распадается на ионы, приобретает способность проводить электричество. Большинство солей, кислот и растворимых оснований представляют собой электролиты.
Некоторые газы, такие как хлористый водород, могут действовать как электролиты при определенных условиях температуры и давления. Натрий, калий, хлорид, кальций, магний и фосфат являются хорошими примерами электролитов.
Какие сильные и слабые электролиты?
Чтобы лучше дифференцировать эти два типа электролитов, можно сказать, что в растворе сильного электролита основными компонентами (или разновидностями) являются образующиеся ионы, тогда как в растворе слабого электролита основным компонентом является само соединение. ионизировать.
Сильные электролиты делятся на три категории: сильные кислоты, сильные основания и соли; в то время как слабые электролиты делятся на слабые кислоты и слабые основания.
Все ионные соединения являются сильными электролитами, поскольку при растворении в воде они разделяются на ионы..
Даже самые нерастворимые ионные соединения (AgCl, PbSO4, CaCO3) являются сильными электролитами, потому что небольшое количество, которое растворяется в воде, происходит главным образом в форме ионов; то есть в полученном растворе отсутствует диссоциированная форма или количество соединения.
Эквивалентная проводимость электролитов уменьшается при более высоких температурах, но ведет себя по-разному в зависимости от их прочности.
Сильные электролиты имеют более низкое снижение своей проводимости при более высоких концентрациях, в то время как слабые электролиты имеют большую скорость снижения проводимости при более высоких концентрациях.
различия
Важно знать, как распознать формулу и определить ее классификацию (ионная или составная), поскольку это будет зависеть от стандартов безопасности при работе с химическими веществами..
Как указывалось ранее, электролиты могут быть определены как сильные или слабые в зависимости от их ионизационной способности, но иногда это может быть более очевидным, чем кажется.
Большинство кислот, оснований и растворимых солей, которые не представляют кислоты или слабые основания, считаются слабыми электролитами..
Фактически, следует предположить, что все соли являются сильными электролитами. Напротив, слабые кислоты и основания, помимо азотсодержащих соединений, считаются слабыми электролитами..
Методы выявления электролитов
Существуют методы, облегчающие идентификацию электролитов. Далее используется шестиступенчатый метод:
Как указано в предыдущем разделе, проводимость электролита изменяется в зависимости от его концентрации в растворе, но также это значение зависит от силы электролита..
При более высоких концентрациях сильные и промежуточные электролиты не будут уменьшаться в значительных интервалах, но слабые будут сильно уменьшаться до достижения значений, близких к нулю при более высоких концентрациях..
Существуют также промежуточные электролиты, которые могут диссоциировать в растворах с более высоким процентным содержанием (менее 100%, но более 10%), в дополнение к неэлектролитам, которые просто не диссоциируют (соединения углерода, такие как сахара, жиры и спирты)..
Сильные электролиты

Всего получено оценок: 293.
Всего получено оценок: 293.
Вещества, быстро распадающиеся на ионы в расплавах или растворах, называются сильными электролитами. К ним относятся растворимые соли, сильные кислоты и щёлочи.
Электролитическая диссоциация
Чтобы раствор или расплав проводил электрических ток, необходимо наличие заряженных частиц – ионов. Распадаются на ионы, т.е. подвергаются электролитической диссоциации вещества, содержащие полярные молекулы. Под действием молекул воды или высокой температуры разрушаются ковалентные полярные или ионные связи. В результате образуются катионы – положительно заряженные ионы и анионы – отрицательно заряженные ионы.
Реакция электролитической диссоциации записывается с помощью ионного уравнения:
Скорость реакции и полнота разложения веществ зависит от степени диссоциации. Эта величина показывает, какая часть молекул от общего количества молекул вещества распалась на катионы и анионы. От степени диссоциации зависит, как поведёт себя вещество в растворе – растворится полностью или частично.
Степень диссоциации зависит он некоторых внешних факторов. Показатель степени можно увеличить с помощью повышения температуры. В кипящей воде электролит диссоциирует быстрее, молекулы активнее распадаются на ионы. А вот повышение концентрации вещества уменьшает степень диссоциации. Чем больше концентрация электролита, тем меньше действие растворителя и, следовательно, слабее диссоциация.
Степень диссоциации чаще всего выражают в процентах. Для вычисления степени диссоциации используется формула:
Электролиты, молекулы которых быстро и необратимо распадаются на ионы, называются сильными электролитами.
Сильные электролиты
Степень диссоциации сильных электролитов больше 0,3 или 30 %. Они диссоциируют практически полностью. Диссоциация в этом случае необратима.
Список сильных электролитов:
Определить, какая соль относится к сильным электролитам, можно с помощью таблицы растворимости солей. Все растворимые в воде соли – сильные электролиты, малорастворимые и нерастворимые соли – слабые электролиты.
Что мы узнали?
Из урока химии узнали, что такое электролитическая диссоциация и какие электролиты относятся к сильным. Электролитическая диссоциация характеризуется степенью диссоциации. Чем выше степень диссоциации, тем больше распадается электролит. У сильных электролитов степень диссоциации больше 30 %. К ним относятся сильные неорганические кислоты, растворимые соли и щёлочи. На степень диссоциации могут влиять внешние факторы – температура, концентрация, давление.
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация