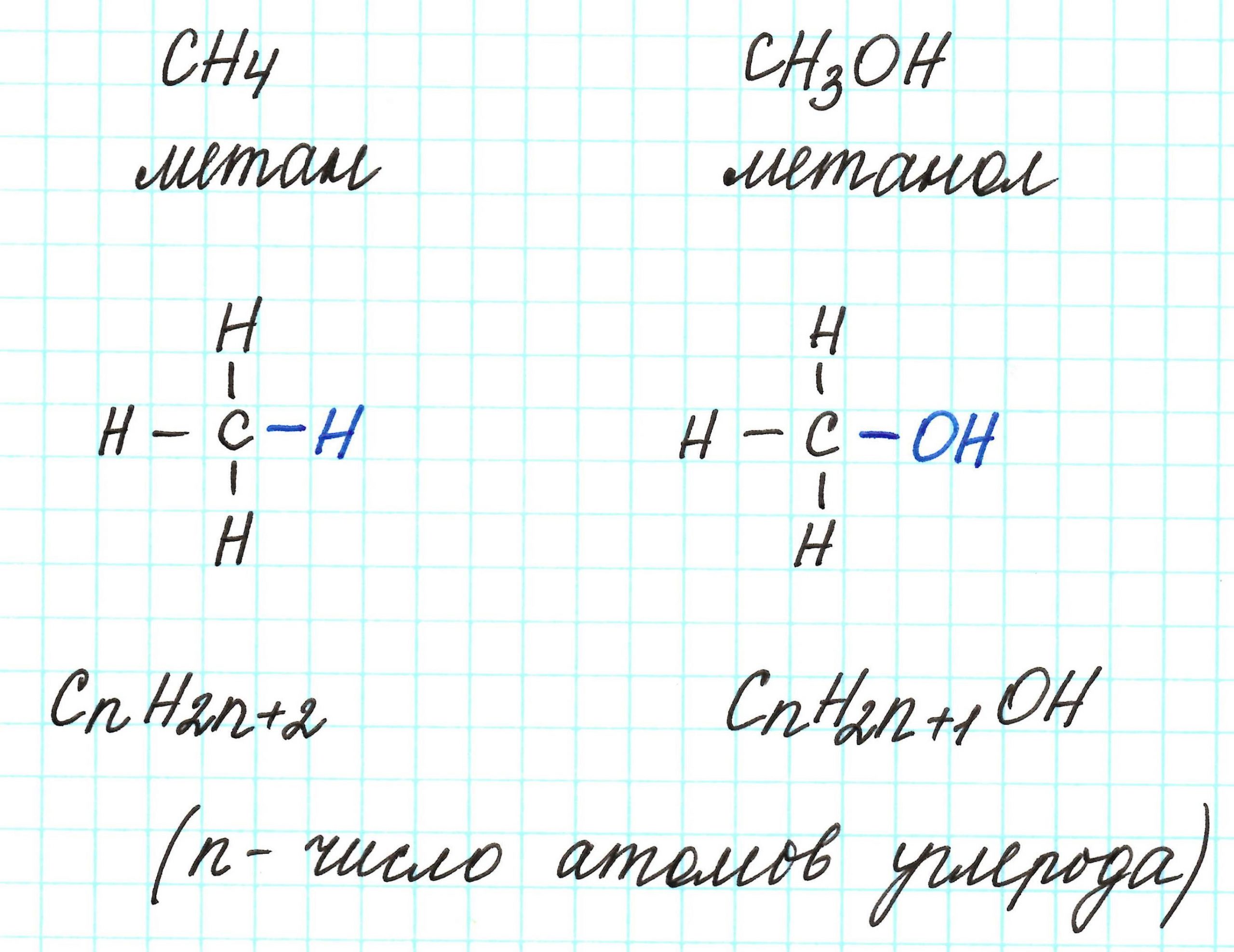
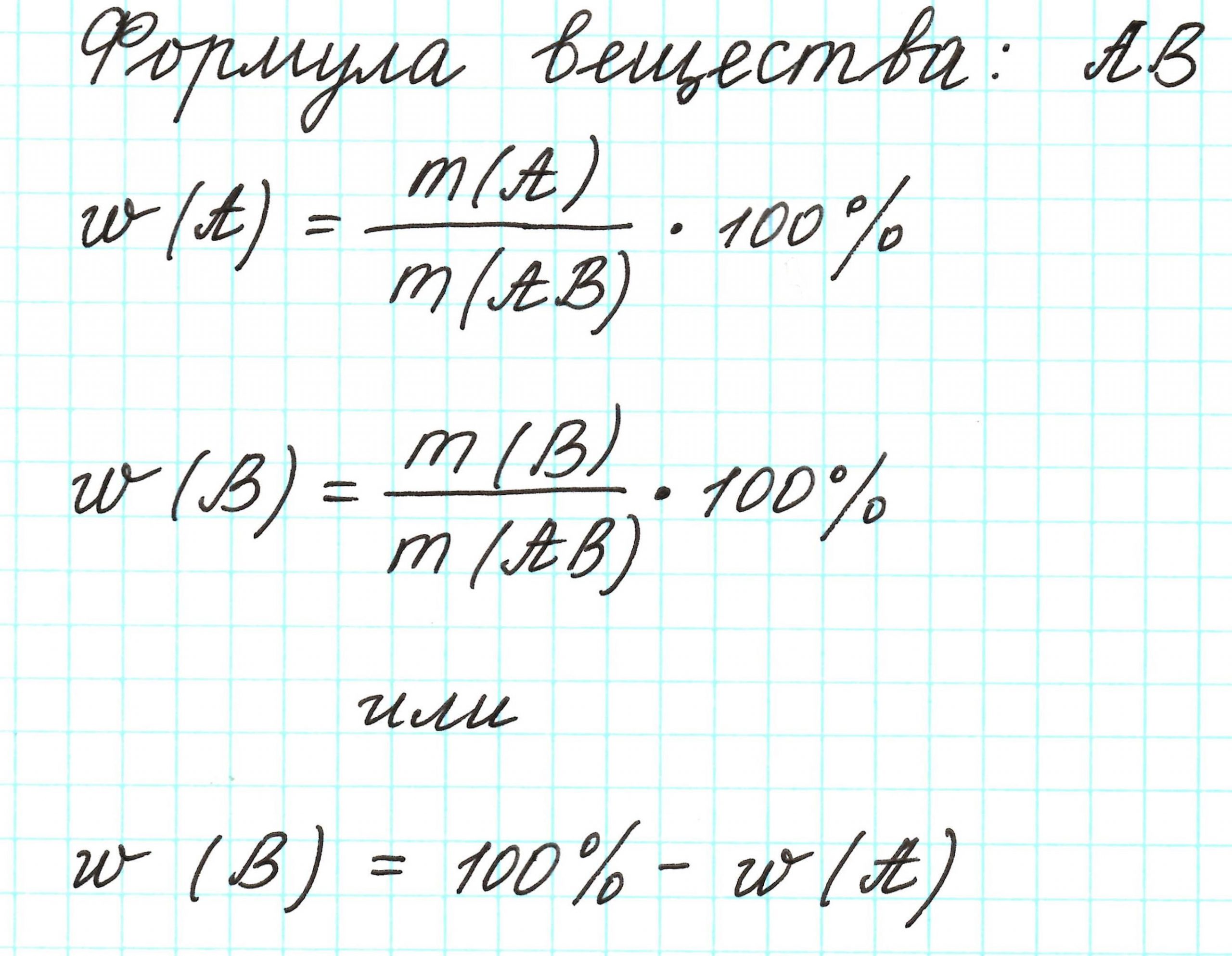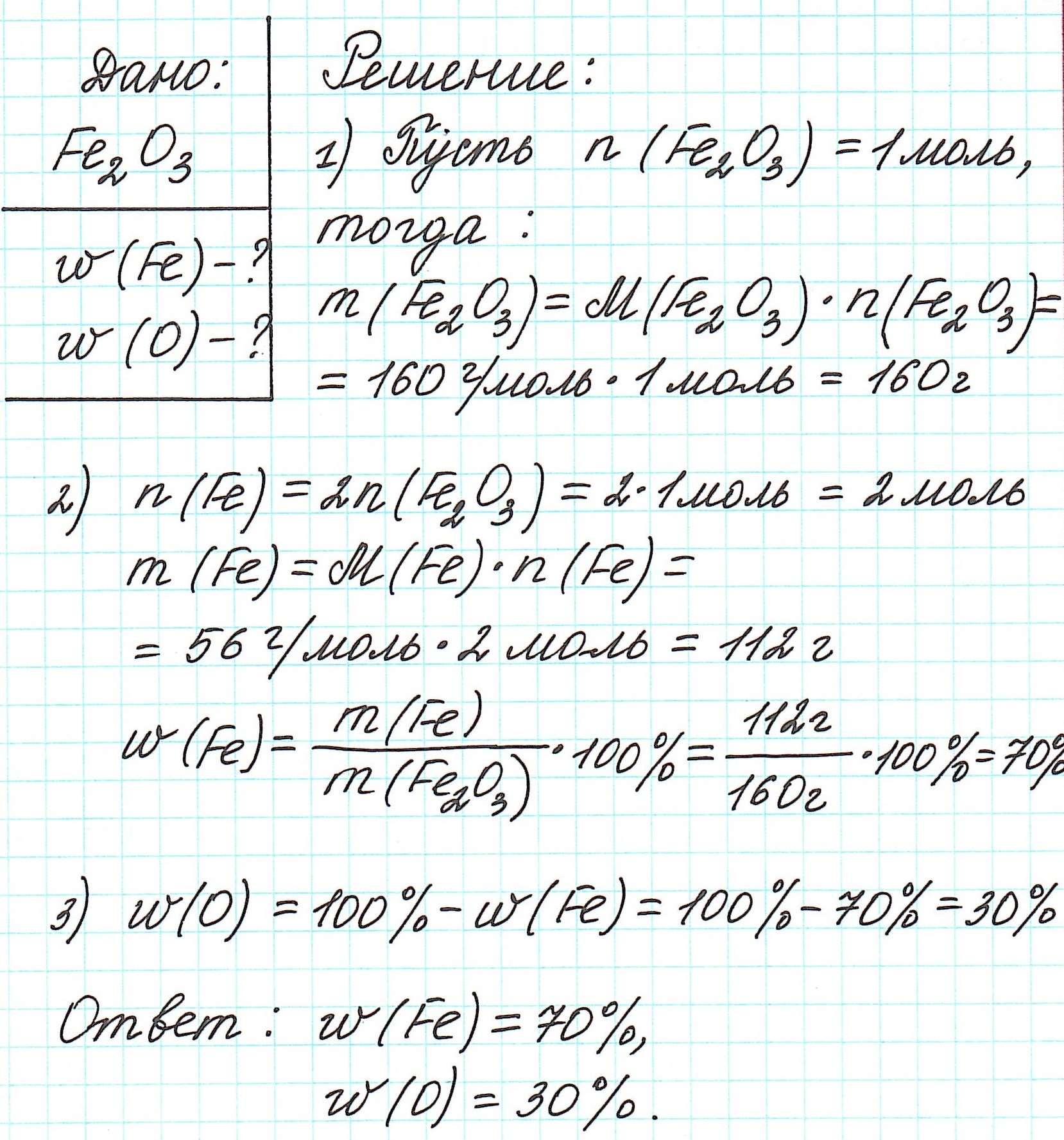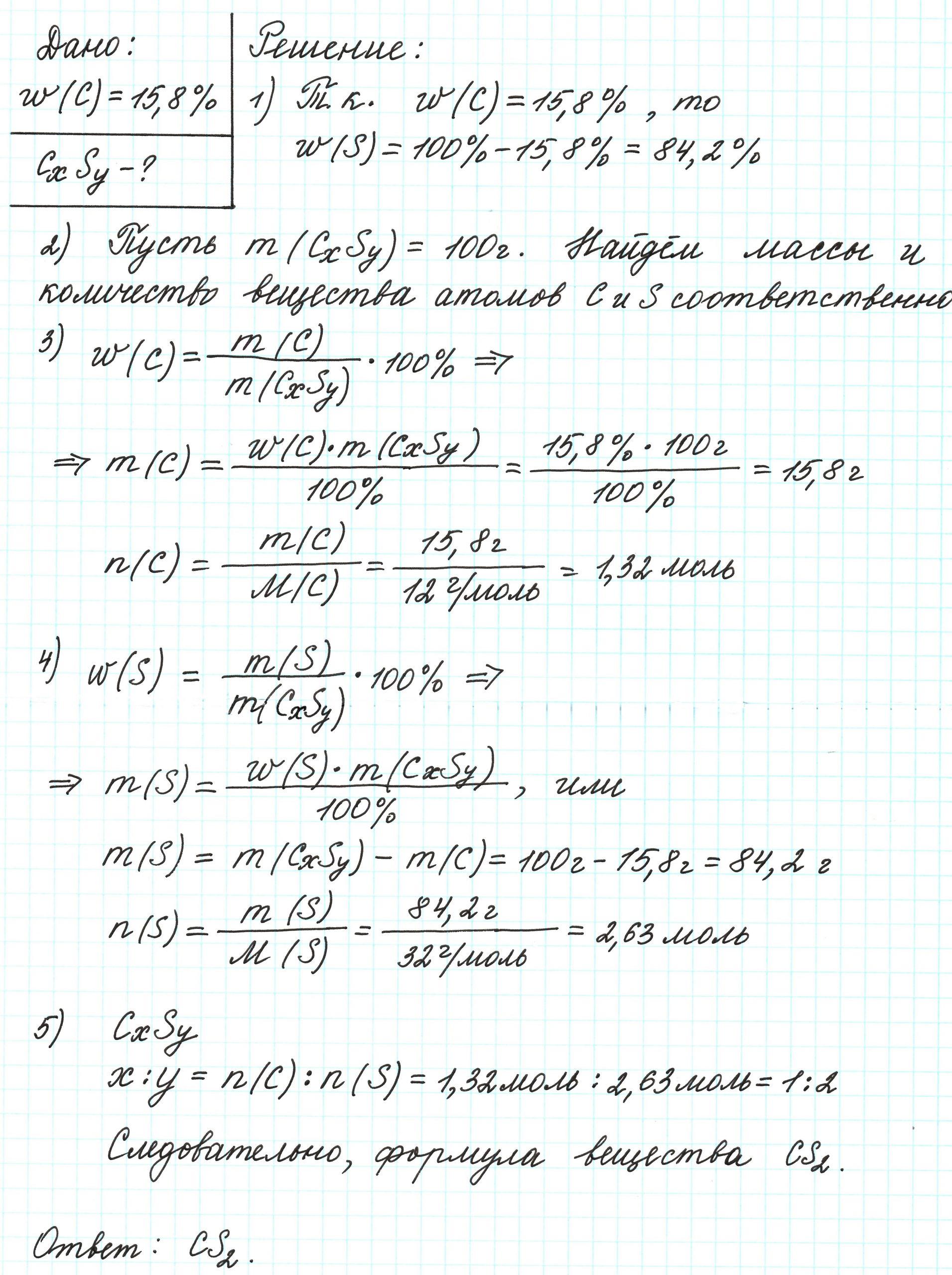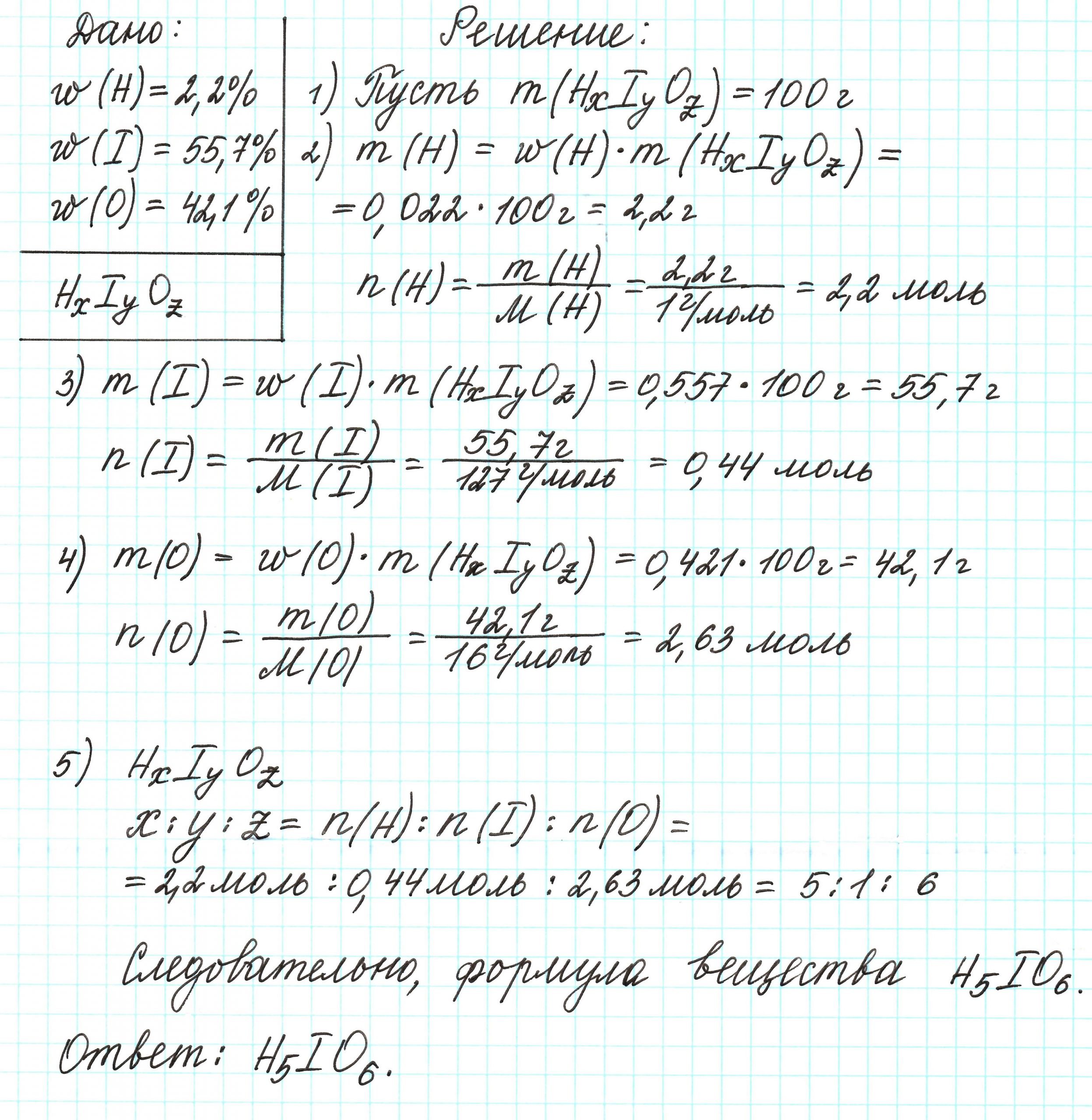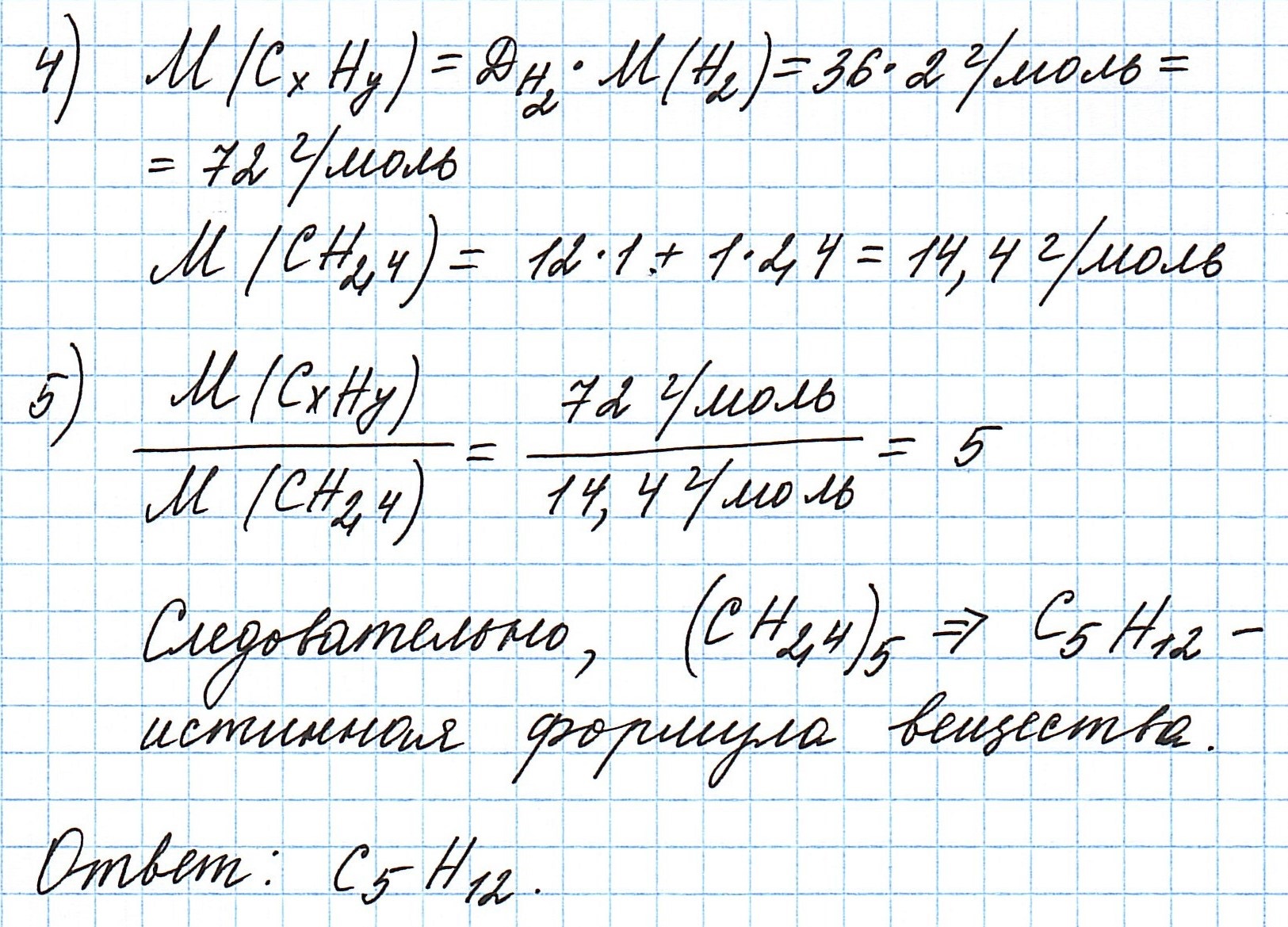Что значит простейшая молекулярная формула
Молекулярная формула
Что такое молекулярная формула
Современные символы химических элементов были введены в науку в 1813 году Я. Берцелиусом. По его предложению элементы обозначаются начальными буквами их латинских названий. Например, кислород (Oxygenium) обозначается буквой О, сера (Sulfur) – буквой S, водород (Hydrogenium) – буквой Н. В тех случаях, когда названия элементов начинаются с одной и той же буквы, к первой букве добавляется еще одна из последующих. Так, углерод (Carboneum) имеет символ С, кальций (Calcium) – Ca, медь (Cuprum) – Cu.
Химические символы – не только сокращенные названия элементов: они выражают и определенные их количества (или массы), т.е. каждый символ обозначает или один атом элемента, или один моль его атомов, или массу элемента, равную (или пропорциональную) молярной массе этого элемента. Например, С означает или один атом углерода, или один моль атомов углерода, или 12 единиц массы (обычно 12 г) углерода.
Молекулярная формула веществ
Формулы веществ также указывают не только состав вещества, но и его количество и массу. Каждая формула изображает или одну молекулу вещества, или один моль вещества, или массу вещества, равную (или пропорциональную) его молярной массе. Например, H2O обозначает или одну молекулу воды, или один моль воды, или 18 единиц массы (обычно (18 г) воды.
Простые вещества также обозначаются формулами, показывающими, из скольких атомов состоит молекула простого вещества: например, формула водорода H2. Если атомный состав молекулы простого вещества точно не известен или вещество состоит из молекул, содержащих различное число атомов, а также, если оно имеет не молекулярное, а атомное или металлическое строение, простое вещество обозначают символом элемента. Например, простое вещество фосфор обозначают формулой P, поскольку в зависимости от условий фосфор может состоять из молекул с различным числом атомов или иметь полимерное строение.
Формулу вещества устанавливают на основании результатов анализа. Например, согласно данным анализа глюкоза содержит 40% (масс.) углерода, 6,72% (масс.) водорода и 53,28% (масс.) кислорода. Следовательно, массы углерода, водорода и кислорода относятся друг к другу как 40:6,72:53,28. Обозначим искомую формулу глюкозы CxHyOz, где x, y и z – числа атомов углерода, водорода и кислорода в молекуле. Массы атомов этих элементов соответственно равны 12,01; 1,01 и 16,00 а.е.м. Поэтому в составе молекулы глюкозы находится 12,01х а.е.м. углерода, 1,01у а.е.м. водорода и 16,00zа.е.м. кислорода. Отношение этих масс равно 12,01х: 1,01у: 16,00z. Но это отношение мы уже нашли, исходя из данных анализа глюкозы. Следовательно:
12,01х: 1,01у: 16,00z = 40:6,72:53,28.
Согласно свойствам пропорции:
x: у: z = 40/12,01:6,72/1,01:53,28/16,00
или х: у: z = 3,33 : 6,65 : 3,33 = 1 : 2 : 1.
Следовательно, в молекуле глюкозы на один атом углерода приходится два атома водорода и один атом кислорода. Этому условию удовлетворяют формулы CH2O, C2H4O2, C3H6O3 и т.д. Первая из этих формул — CH2O — называется простейшей или эмпирической формулой; ей отвечает молекулярная масса 30,02. Для того, чтобы узнать истинную или молекулярную формулу, необходимо знать молекулярную массу данного вещества. Глюкоза при нагревании разрушается, не переходя в газ. Но ее молекулярную массу можно определить и другими методами: она равна 180. Из сопоставления этой молекулярной массы с молекулярной массой, отвечающей простейшей формуле, ясно, что глюкозе отвечает формула C6H12O6.
Таким образом, химическая формула – это изображение состава вещества с помощью символов химических элементов, числовых индексов и некоторых других знаков, а молекулярную формулу вещества можно получить, зная простейшую формулу вещества и его молекулярную массу.
Примеры решения задач
| Задание | При сжигании 8,4 г углеводорода получили 26,4 г углекислого газа и 10,8 г воды. Относительная плотность паров углеводорода по воздуху равна 42. Найдите молекулярную формулу углеводорода. |
| Решение | Значение молярной массы углеводорода можно определить при помощи его плотности по водороду: |
По массам углекислого газа и воды находим массы углерода и водорода. Однако, для начала рассчитаем их молярные массы. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
m (C) = 26,4×12/44 = 7,2 г.
m (H) = 10,8 × 2×1 / 18 = 1,2 г.
Обозначим количество моль элементов, входящих в состав соединения за «х» (углерод) и «у» (водород). Тогда, мольное отношение будет выглядеть следующим образом:
Следовательно, простейшая формула углеводорода имеет вид CH2и молярную массу 14 г/моль [M(CH2) = Ar(C) + 2×Ar(H) = 12+ 2×1 = 12 + 2 = 14 г/моль].
Чтобы найти истинную формулу оксида хлора найдем отношение полученных молярных масс:
Значит индексы атомов углерода и водорода должны быть в 6 раз выше, т.е. формула углеводорода будет иметь вид C6H12. Это гексен.
| Задание | При сгорании 2,3 г органического вещества, состоящего из углерода, водорода и кислорода, образовалось 4,4 г углекислого газа и 2,7 г воды. Плотность паров вещества по кислороду равна 1,44 г. Определите молекулярную формулу вещества. |
| Решение | Значение молярной массы углеводорода можно определить при помощи его плотности по кислороду: |
Msubstance = 32 × 1,44 = 46 г/моль.
По массам углекислого газа и воды находим массы углерода и водорода, а также кислорода (по разнице между массой вещества и атомов углерода и водорода в нем). Однако, для начала рассчитаем их молярные массы. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
m (C) = 4,4×12/ 44 = 1,2 г.
m (H) = 2,7 × 2×1 / 18 = 0,3 г.
m(O) = msubstance — m (C) — m (H) = 2,3 – 1,2 – 0,3 = 0,8 г.
Обозначим количество моль элементов, входящих в состав соединения за «х» (углерод), «у» (водород) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом:
x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O);
x:y:z= 1,2/12 : 0,3/1: 0,8/16;
x:y:z= 0,1 : 0,3: 0,05 = 2 : 6 : 1.
Следовательно, простейшая формула органического соединения имеет вид C2H6O и молярную массу 46 г/моль [M(C2H6O) = 2×Ar(C) + 6×Ar(H) + Ar(O) = 2×12+ 6×1 + 16= 24 + 6 + 16 = 46 г/моль].
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Значит формула органического соединения будет иметь вид C2H6O.
КАК ВЫЧИСЛИТЬ ФОРМУЛУ ВЕЩЕСТВА
Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.
Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
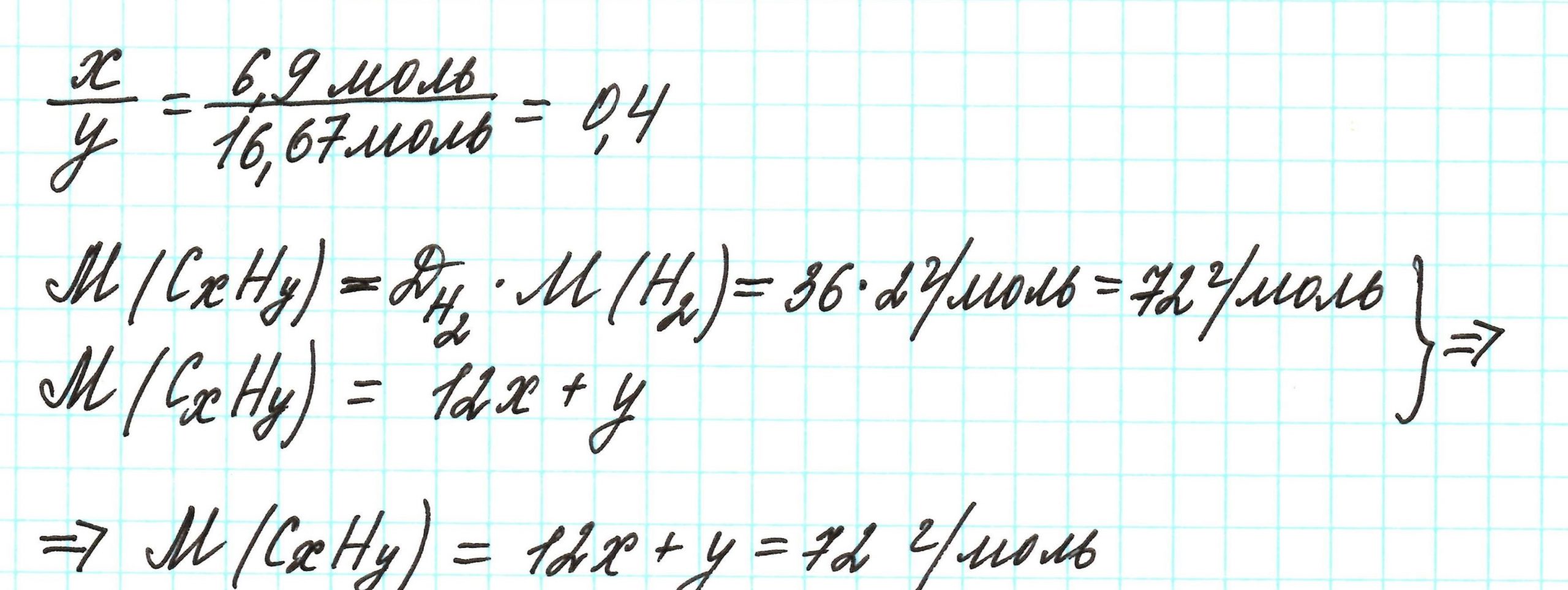
Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
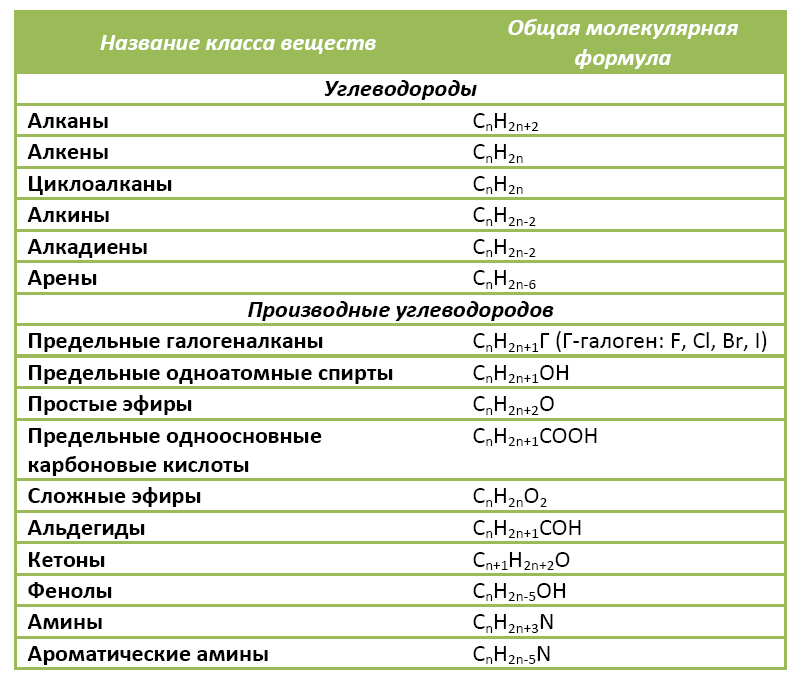
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.
Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.

5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.
Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.
Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.
Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.
Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь в нашу группу ВКонтакте.
Пожалуйста, оцените публикацию 
Урок 5. Химическая формула
В уроке 5 «Химическая формула» из курса «Химия для чайников» дадим определение химическим формулам и их индексам, а также выясним различия химических формул веществ молекулярного и немолекулярного строения. Напоминаю, что в прошлом уроке «Сложные вещества» мы дали определение химическим соединениям, рассмотрели различия органических и неорганических соединений, а также выяснили, что означает качественный и количественный состав.
Состав любого вещества выражается в виде химической формулы.
Качественный состав показывается с помощью знаков (символов) химических элементов, а количественный — с помощью индексов, которые записываются справа и чуть ниже знаков химических элементов.
Индекс — число атомов данного химического элемента в формуле вещества.
Например, химическая формула простого вещества водорода записывается так:
Химические формулы веществ молекулярного строения
Формулы двухатомных молекул: кислорода — О2 («о-два»), хлора — Сl2 («хлор-два»), азота — N2 («эн-два»). Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»).
Формулы молекул сложных веществ также отображают их качественный и количественный состав. Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — NH3 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ. Например, формула серной кислоты — H2SO4 («аш-два-эс-о-четыре»), а глюкозы — C6H12O6 («це-шесть-аш-двенадцать-о-шесть»).
Химические формулы веществ молекулярного строения (их называют молекулярными формулами) показывают состав элементарных частей, т. е. условных «кирпичиков», из которых состоят эти вещества. Такими элементарными составными частями (элементарными структурными единицами, или просто структурными единицами) в данном случае являются молекулы.
Химические формулы веществ немолекулярного строения
А если вещество имеет немолекулярное строение? Химические формулы простых веществ такого типа (например, металлов) записывают просто знаками соответствующих элементов без индексов (или, вернее, с индексом, равным единице, которая не записывается). Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al.
Состав сложных веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение чисел атомов разных химических элементов в этих веществах. Такие формулы называются простейшими. Например, простейшая формула кварца — главной составной части речного песка — SiO2. Она показывает, что в кристалле кварца на один атом кремния приходятся два атома кислорода, т. е. простейшее соотношение чисел атомов кремния и кислорода в этом веществе равно 1:2. Простейшая формула Al2O3 показывает, что в этом соединении простейшее соотношение между числами атомов алюминия и кислорода равно 2:3.
Группа атомов, состав которой соответствует простейшей формуле вещества немолекулярного строения, называется его формульной единицей.
Формульная единица, поваренной соли NaCl («натрий-хлор») — группа из одного атома натрия и одного атома хлора. Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода.
Формулы более сложных соединений немолекулярного строения читаются аналогично. Дополнительно указывается только число групп атомов, заключенных в круглые скобки: Al2(SO4)3 («алюминий-два-эс-о-четыре-трижды»), Mg(NO3)2 («магний-эн-о-три-дважды») и т. д.
Таким образом, структурными единицами веществ молекулярного строения являются молекулы. Структурными единицами веществ немолекулярного строения являются их формульные единицы.
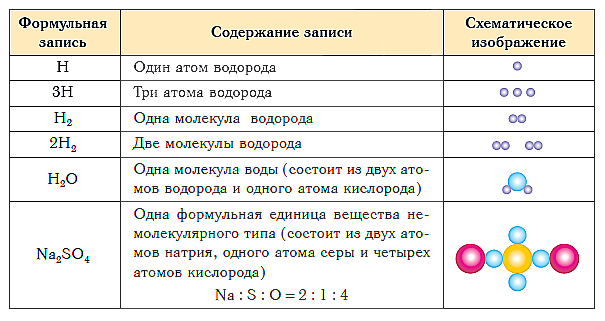
В таблице ниже показаны формульная запись и схематическое изображение состава веществ различного типа.
Краткие выводы урока:
Надеюсь урок 5 «Химическая формула» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.