Что значит полувыведение препарата
Период выведения и время полураспада лекарств
После всасывания в кровь лекарственные средства (ЛС) неравномерно распределяются в органах и тканях организма. Существенно влияют на распространение веществ биобарьеры. К ним относятся стенка капилляров, цитоплазматический, гематоэнцефалический (ГЭБ) и плацентарный барьеры.
Биологические барьеры организма
Большинство препаратов легко преодолевает стенку капилляров. Одни средства проникают через поры путем фильтрации, другие проникают через капиллярную стенку путем диффузии. Некоторые гидрофильные соединения преодолевают капиллярную стенку с помощью транспортных систем.
Выведение лекарств из организма
ЛС и их метаболиты выводятся из организма разнообразными путями: с мочой, калом, желчью, секретом потовых, сальных и бронхиальных желез, молоком матери, воздухом, выдыхаемым воздухом.
Базовую роль в экскреции лекарств играют почки. На выведение лекарств влияют фильтрация, канальцевая реабсорбция и секреция. Фильтрации в клубочках нефрона испытывают вода, глюкоза, аминокислоты, белки с молекулярной массой до 60000 и некоторые другие соединения. Не фильтруются фракции препаратов, связанные с белками плазмы. Скорость фильтрации зависит от интенсивности кровообращения в почках.
В случаях, когда почечный кровоток нарушен (шок, гломерулонефрит и др.), фильтрация существенно уменьшается.
Выделение лекарств с мочой
Активная секреция лекарственных средств происходит в проксимальных отделах нефрона. Секреция из крови через канальцевый эпителий в первичную мочу происходит с затратой энергии с участием специальных транспортных систем. Секретироваться могут как свободные, так и связанные с белками лекарственные средства. Реабсорбция лекарств происходит в дистальных отделах канальцев. Поскольку пассивная реабсорбция происходит через липидные мембраны канальцевого эпителия, то становится очевидным, что лучше реабсорбируются недиссоциированные липофильные молекулы слабых кислот и щелочей, а также нейтральные соединения. Степень реабсорбции зависит от рН мочи. Так, при кислых рН мочи слабые кислоты (барбитураты, бензодиазепины, сульфаниламиды) мало диссоциированные и легко реабсорбируются в кровь.
Выделение лекарств с калом
С калом выводятся из организма препараты, которые плохо всасываются в желудочно-кишечном тракте. Такие препараты используют преимущественно для воздействия на микрофлору кишечника или как слабительные средства.
Некоторые препараты (тетрациклин, пенициллины и др.) выделяются с желчью в тонкий кишечник, откуда они могут выводиться с калом или повторно всасываться, а затем снова выделяться в кишечник (так называемая циркуляция по энтеропеченочную кругу).
Другие способы выведения лекарств из организма
Период полувыведения
Необходимо отметить, что с увеличением дозы препарата выведение его из организма снижается и соответственно возрастает период полувыведения.
Кроме того, для количественной характеристики скорости вывода вещества из организма используют термин «клиренс» (очищение). Он отражает скорость очистки плазмы крови от вещества (например, 10 мл / мин). Различают общий, почечный и печеночный клиренс.
Большинство лекарственных средств несут в организм метаболические изменения. Этот процесс называется биотрансформацией. Суть метаболических превращений заключается в том, чтобы чужеродное, опасное для организма средство превратилось в соединение, которое может быть легко выведено с мочой, желчью или потом. Такие полярные метаболиты плохо растворяются в липидах и имеют низкую способность взаимодействовать с белками плазмы крови и тканей. Метаболиты, как правило, плохо проникают через биологические мембраны и не испытывают реабсорбции в почках и кишечнике.
Метаболизм лекарств в организме
Метаболизм лекарственных средств происходит преимущественно в микросомальном аппарате печени. Некоторые метаболические преобразования определенных лекарств могут происходить в кишечнике, легких, коже и плазме крови. Лишь некоторые препараты выводятся из организма в неизмененном виде.
Известны два базовых вида метаболизма ЛС:
Восстановление является более редким путем метаболизма лекарств. Реакции восстановления катализируют такие ферментные системы, как нитро- и азоредуктазы и др.
Процессы обезвреживания лекарств существенно замедляются у больных с патологией печени (цирроз, острые и хронические гепатиты и др.). Это приводит к росту продолжительности действия препаратов, развития явлений передозировки.
Некоторые препараты могут подавлять микросомальные ферменты печени (левомицетин, бутадион и др.) или немикросомальные ферменты (антихолинэстеразные средства, ингибиторы МАО и др.). В таких случаях действие лекарств, метаболизм которых происходит при участии соответствующих ферментов, увеличивается. В то же время существуют соединения (фенобарбитал и др.), которые повышают (индуцируют) скорость синтеза микросомальных ферментов.
Период полувыведения (полужизни)
Период полувыведения [ править | править код ]
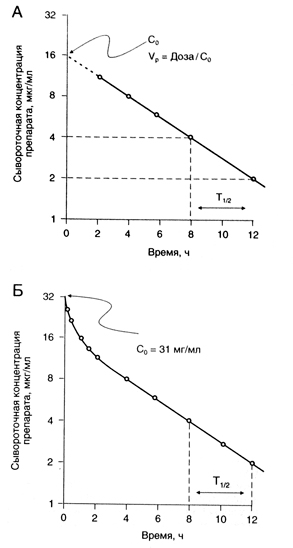
Период полувыведения (Т1/2) — это время, за которое сывороточная концентрация вещества (или его общее содержание в организме) снижается вдвое. В рамках однокамерной модели (рис. 1.4, А) определить Т1/2 очень просто. Полученное значение используют затем для расчета дозы. Однако для многих лекарственных средств приходится использовать многокамерную модель, так как динамика их сывороточной концентрации описывается несколькими экспоненциальными функциями (рис. 1.4, Б). В таких случаях рассчитывают несколько значений Т1/2.
Раньше Т1/2 рассчитывали по участку фармакокинетической кривой, отражающему стадию равновесия (стадию элиминации). С появлением более чувствительных методов измерения концентрации веществ в крови оказалось, что конечный Т1/2 гораздо больше начального. Например, для гентамицина конечный Т1/2 равен 53 ч, тогда как в Приложении II приведен T1/2 2—3 ч. Чрезвычайно длительный конечный Т1/2 индометацина (120 ч) обусловлен, вероятно, активным кишечно-печеночным кругооборотом препарата (в Приложении II приведен Т 1/2 2,4 ч). Клиническая значимость Т1/2 для того или иного периода зависит от того, какая доля вещества выводится из организма и каков объем распределения в этот период, а также от того, какой из показателей — сывороточная концентрация препарата или его общее содержание в организме — лучше коррелирует с фармакологическими эффектами. В Приложении II приведены величины Т1/2, имеющие наибольшее практическое значение.
В прошлом изменение фармакокинетики лекарственных средств при разных патологических состояниях оценивали только на основании Т1/2. В настоящее время общепризнано, что Т1/2 зависит от клиренса и объема рас- пределения вещества. В стационарном состоянии зависимость между Т1/2, клиренсом и объемом распределения приблизительно описывается следующим уравнением:
T1/2 = 0.693 x Vc / Cl(1.12)
Клиренс характеризует способность организма элиминировать вещество, поэтому при снижении этого показателя вследствие какого-либо заболевания Т1/2 должен увеличиваться. Но это справедливо лишь в том случае, если не меняется объем распределения вещества. Например, с возрастом Т1/2 диазепама увеличивается, но не за счет уменьшения клиренса, а вследствие увеличения объема распределения (Klotzetal., 1975). На клиренс и объем распределения влияет степень связывания вещества с белками плазмы и тканей, так что предсказать изменение Т1/2 при том или ином патологическом состоянии не всегда возможно. При остром вирусном гепатите Т1/2 толбутамида уменьшается, а не увеличивается, как это можно было бы ожидать, из-за снижения степени связывания препарата с белками плазмы и тканей. Объем распределения толбутамида не меняется, а клиренс увеличивается вследствие увеличения сывороточной концентрации свободного препарата (Williams et al., 1977).
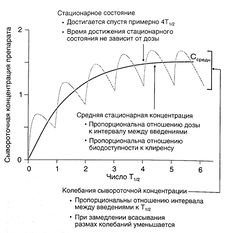
По Т1/2 не всегда можно судить об изменении элиминации препарата, зато этот показатель позволяет рассчитать время достижения стационарного состояния (в начале лечения, а также при изменении дозы или частоты введения). Сывороточная концентрация, составляющая примерно 94% средней стационарной, достигается за время, равное 4Т1/2. Кроме того, с помощью Т1/2 можно оценить время, необходимое для полного удаления вещества из организма, и рассчитать интервал между введениями (см. ниже).
Стационарное состояние [ править | править код ]
Согласно уравнению 1.1, если вещество вводится путем инфузии с постоянной скоростью, в стационарном состоянии скорость поступления вещества (скорость инфузии) равна скорости его элиминации (произведение клиренса на сывороточную концентрацию препарата — уравнение 1.3). Уравнение 1.1 можно применять и при дробном введении (например, 250 мг каждые 8 ч): в этом случае также устанавливается стационарная сывороточная концентрация препарата, но в промежутках между введениями она колеблется от минимальной до максимальной (рис. 1.5).
Описание к рис. 1.5. Динамика сывороточной концентрации лекарственного средства при дробном введении. Серая кривая описывает накопление препарата при введении с интервалами, равными Т1/2, при условии, что скорость всасывания в 10 раз больше скорости элиминации. При увеличении скорости всасывания максимальная концентрация в стационарном состоянии стремится к 2, а минимальная — к 1. Черная кривая отражает динамику сывороточной концентрации препарата, который вводят в эквивалентной дозе путем инфузии. Обе кривые соответствуют однокамерной фармакокинетической модели. Средняя концентрация в стационарном состоянии вычисляется по уравнению:
Cсредн=F x Доза / (Cl x T)
Это уравнение можно получить путем замены в уравнении 1.1 скорости поступления вещества на выражение F х Доза / Т. Ссредн соответствует концентрации препарата в стационарном состоянии при введении путем инфузии.
Ошибки в антибактериальной терапии инфекций дыхательных путей в амбулаторной практике
Проблема рациональной антибактериальной терапии инфекций дыхательных путей не теряет актуальности и в настоящее время. Наличие большого арсенала антибактериальных препаратов, с одной стороны, расширяет возможности лечения различных инфекций, а с другой
Проблема рациональной антибактериальной терапии инфекций дыхательных путей не теряет актуальности и в настоящее время. Наличие большого арсенала антибактериальных препаратов, с одной стороны, расширяет возможности лечения различных инфекций, а с другой — требует от врача-клинициста осведомленности о многочисленных антибиотиках и их свойствах (спектр действия, фармакокинетика, побочные эффекты и т. д.), умения ориентироваться в вопросах микробиологии, клинической фармакологии и других смежных дисциплинах.
Согласно И. В. Давыдовскому, «врачебные ошибки — род добросовестных заблуждений врача в его суждениях и действиях при исполнении им тех или иных специальных врачебных обязанностей». Ошибки в антибактериальной терапии инфекций дыхательных путей имеют наибольший удельный вес в структуре всех лечебно-тактических ошибок, совершаемых в пульмонологической практике, и оказывают существенное влияние на исход заболевания. Кроме того, неправильное назначение антибактериальной терапии может иметь не только медицинские, но и различные социальные, деонтологические, экономические и другие последствия.
При выборе способа антибактериальной терапии в амбулаторной практике необходимо учитывать и решать как тактические, так и стратегические задачи. К тактическим задачам антибиотикотерапии относится рациональный выбор антибактериального препарата, обладающего наибольшим терапевтическим и наименьшим токсическим воздействием.
Стратегическая задача антибиотикотерапии в амбулаторной практике может быть сформулирована как уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции.
В соответствии с этими положениями следует выделять тактические и стратегические ошибки при проведении антибактериальной терапии инфекций дыхательных путей в амбулаторной практике (см. таблицу 1).
Тактические ошибки антибактериальной терапии
I. Необоснованное назначение антибактериальных средств
Особую категорию ошибок представляет неоправданное применение антибактериальных препаратов (АП) в тех ситуациях, когда их назначение не показано.
Показанием для назначения антибактериального препарата является диагностированная или предполагаемая бактериальная инфекция.
Наиболее распространенная ошибка в амбулаторной практике — назначение антибактериальных препаратов при острых респираторных вирусных инфекциях (ОРВИ), имеющее место как в терапевтической, так и в педиатрической практике. При этом ошибки могут быть обусловлены как неправильной трактовкой симптоматики (врач принимает ОРВИ за бактериальную бронхолегочную инфекцию в виде пневмонии или бронхита), так и стремлением предотвратить бактериальные осложнения ОРВИ.
При всех трудностях принятия решения в подобных ситуациях необходимо отдавать себе отчет в том, что антибактериальные препараты не оказывают влияния на течение вирусной инфекции и, следовательно, их назначение при ОРВИ не оправдано (см. таблицу 2). В то же время предполагаемая возможность предотвращения бактериальных осложнений вирусных инфекций с помощью назначения антибактериальных препаратов не находит себе подтверждения в клинической практике. Кроме того, очевидно, что широкое неоправданное применение антибактериальных препаратов при ОРВИ чревато формированием лекарственной устойчивости и повышением риска возникновения нежелательных реакций у пациента.
Одной из распространенных ошибок при проведении антибактериальной терапии является назначение одновременно с антибиотиком противогрибковых средств с целью профилактики грибковых осложнений и дисбактериоза. Следует подчеркнуть, что при применении современных антибактериальных средств у иммунокомпетентных пациентов риск развития грибковой суперинфекции минимален, поэтому одновременное назначение антимикотиков в этом случае не оправдано. Комбинация антибиотика с противогрибковым средством целесообразна только у больных, получающих цитостатическую или противоопухолевую терапию или у ВИЧ-инфицированных пациентов. В этих случаях оправдано профилактическое назначение антимикотиков системного действия (кетоконазол, миконазол, флуконазол), но не нистатина. Последний практически не всасывается в желудочно-кишечном тракте и не способен предотвратить грибковую суперинфекцию иной локализации — полости рта, дыхательных или мочевыводящих путей, половых органов. Часто практикующееся назначение нистатина с целью профилактики дисбактериоза кишечника вообще не находит логического объяснения.
Часто врач назначает нистатин или другой антимикотик в случае обнаружения в полости рта или в моче грибов рода Сandida. При этом он ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза, а также факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.).
Выделение грибов рода Сandida из полости рта или мочевых путей пациентов в большинстве случаев служит свидетельством бессимптомной колонизации, не требующей коррегирующей противогрибковой терапии.
II. Ошибки в выборе антибактериального препарата
Пожалуй, наибольшее число ошибок, возникающих в амбулаторной практике, связано с выбором антибактериального средства. Выбор антибиотика должен производиться с учетом следующих основных критериев:
Определяющим фактором выбора препарата должен быть спектр природной активности антибиотика: необходимо, чтобы он охватывал основных возбудителей внебольничных инфекций дыхательных путей (см. таблицу 3).
Кроме того, при выборе препарата следует учитывать уровень приобретенной резистентности возбудителей в популяции. Основные тенденции, касающиеся резистентности возбудителей, отмеченной в последние годы, отражены в таблице 4. Наиболее значимые проблемы, связанные с применением основных антибактериальных средств при инфекциях дыхательных путей, могут быть сформулированы следующим образом.
С учетом вышесказанного, оптимальными средствами для лечения внебольничных инфекций дыхательных путей в настоящее время могут быть признаны β-лактамные антибиотики и новые фторхинолоны (см. таблицу 5). Использование макролидов должно быть ограничено — препараты можно назначать при нетяжелой пневмонии у детей или пациентов молодого возраста, особенно при наличии признаков атипичного течения (микоплазменная, хламидийная).
 |
| Таблица 5. Значение антибактериальных средств при инфекциях нижних дыхательных путей в амбулаторной практике. |
Следует подчеркнуть, что назначение некоторых антибактериальных препаратов, применяемое в амбулаторной практике при респираторных инфекциях, нельзя признать рациональным. К таким препаратам прежде всего относятся:
В таблице 6 приведены современные рекомендации по антибактериальной терапии внебольничных респираторных инфекций, с учетом всех требуемых критериев и доказанной эффективности в контролируемых клинических исследованиях.
Представленные рекомендации имеют наиболее общий характер. В то же время с практических позиций выбор оптимального антибактериального препарата также должен осуществляться с учетом особенностей пациента и заболевания. Так, например, у больных пневмонией молодого и среднего возраста без отягощающих факторов терапевтический эффект оказывают амоксициллин, макролиды, защищенные пенициллины и новые фторхинолоны. Однако у больных пожилого возраста в этиологии заболевания большее значение приобретают S. aureus и грамотрицательные бактерии, что объясняет снижение эффективности амоксициллина и макролидов у этой категории больных.
Также распространенной во врачебной практике ошибкой является отказ от назначения антибактериальной терапии при пневмонии беременным женщинам из-за опасения негативного влияния препаратов на плод. Следует отметить, что перечень антибактериальных препаратов, прием которых нежелателен во время беременности из-за риска эмбриотоксического действия, ограничен — тетрациклины, хлорамфеникол, сульфаниламиды, ко-тримоксазол, фторхинолоны, аминогликозиды. Другие антибиотики, в частности β-лактамы, макролиды, могут применяться у беременных женщин.
Другие возможные факторы, влияющие на выбор антибактериального препарата, представлены в таблице 7.
 |
| Таблица 7. Особые клинические ситуации при внебольничных инфекциях нижних дыхательных путей. |
Нередки ошибки при выборе антибактериального препарата в случае неэффективности первоначального. Здесь необходимо также остановиться на ошибках антибактериальной терапии, которые касаются несвоевременной оценки неэффективности первоначального антибиотика. Общепринятым критическим сроком оценки эффективности (или неэффективности) антибактериальной терапии считаются 48—72 ч с момента его назначения. К сожалению, приходится нередко сталкиваться с такими случаями, когда больной продолжает получать назначенный антибиотик в течение недели и более, несмотря на отсутствие очевидного клинического эффекта. Обычно критерием эффективности антибактериальной терапии является снижение или нормализация температуры тела больного, уменьшение признаков интоксикации. В тех случаях (не столь частых), когда лихорадка с самого начала заболевания отсутствует, приходится ориентироваться на другие признаки интоксикации (головная боль, анорексия, общемозговая симптоматика и т. д.), а также на отсутствие прогрессирования заболевания за период проводимого лечения.
Продолжение антибактериальной терапии, невзирая на ее неэффективность, имеет немало негативных последствий. При этом затягивается назначение другого, более адекватного антибиотика, что ведет к прогрессированию воспаления (особенно важно при тяжелых пневмониях, у больных с сопутствующей патологией) и развитию осложнений, а также удлиняет сроки лечения. Кроме того, повышается риск возникновения побочных (токсических) эффектов препаратов, а также развития и усиления антибиотикорезистентности. Продолжение лечения, несмотря на неэффективность проводимой терапии, подрывает доверие больного и его родственников к лечащему врачу. Очевидна и неэкономичность такой ошибочной тактики антибактериальной терапии (напрасный расход неэффективного АП, дополнительные затраты на лечение токсических эффектов и др.).
Кроме того, ошибки встречаются при замене неэффективного антибиотика на другой, т. е. при смене препарата. При этом врач забывает, что принцип выбора антибактериального препарата остается прежним, т. е. ориентироваться следует на клиническую ситуацию с учетом, однако, неэффективности первоначального препарата и ряда других дополнительных признаков. Отсутствие эффекта от первоначально назначенного антибиотика в известной степени должно служить дополнительным ориентиром, позволяющим обосновать выбор второго препарата. Так, например, отсутствие эффекта от применения β-лактамных антибиотиков (пенициллины, цефалоспорины) у больного с внебольничной пневмонией позволяет предполагать атипичную этиологию пневмонии (микоплазменной, хламидийной или легионеллезной) с учетом, разумеется, других клинических признаков.
Клинические признаки атипичной пневмонии, вызванной Mycoplasma pneumoniae или Chlamydia pneumoniae:
Наличие клинических признаков атипичной пневмонии делает обоснованным назначение антибактериальных препаратов из группы макролидов, доксициклина или фторхинолонов (левофлоксацин, моксифлоксацин, офлоксацин).
III. Ошибки в выборе режима дозирования антибактериального препарата
Ошибки в выборе оптимальной дозы антибактериального средства могут заключаться в назначении как недостаточной, так и избыточной дозы препарата. И те и другие ошибки чреваты негативными последствиями.
Если доза антибиотика недостаточна и не создает в крови и тканях дыхательных путей концентрацию, превышающую минимальную дозу для подавления основных возбудителей инфекции, что является условием эрадикации соответствующего возбудителя, то это не только может служить одной из причин неэффективности терапии, но и создает реальные предпосылки для формирования резистентности микроорганизмов. Ошибки в выборе оптимальной дозы могут быть связаны как с назначением недостаточной разовой дозы, так и с неправильным режимом дозирования (недостаточная кратность введения).
В качестве примера неадекватного режима дозирования антибиотиков при внебольничной пневмонии можно привести амоксициллин, который ранее рекомендовался в суточной дозе до 1 г. Однако современные рекомендации предполагают назначение амоксициллина в суточной дозе 1,5 и даже 3 г для преодоления возможной резистентности S. pneumoniae. Примеры неадекватных режимов дозирования антибиотиков в амбулаторной практике при респираторных инфекциях приводятся в таблице 8.
 |
| Таблица 8. Неадекватные режимы дозирования пероральных антибактериальных препаратов в амбулаторной практике при респираторных инфекциях у взрослых. |
Неправильный выбор интервалов между введениями антибактериальных препаратов обычно обусловлен не столько сложностями парентерального введения препаратов в амбулаторных условиях или негативным настроем больных, сколько неосведомленностью практикующих врачей о некоторых фармакодинамических и фармакокинетических особенностях препаратов, которые должны определять режим их дозирования. Типичной ошибкой является назначение в амбулаторной педиатрической практике при пневмонии бензилпенициллина с кратностью введения два раза в сутки, так как более частое его введение неудобно для пациента. Следует отметить, что при нетяжелом течении пневмонии вряд ли оправдано стремление некоторых врачей к обязательному назначению парентеральных антибиотиков. Современные антибактериальные препараты характеризуются хорошей биодоступностью при приеме внутрь, а также одинаковой клинической эффективностью с парентеральными препаратами, поэтому в подавляющем большинстве случаев оправдано лечение пероральными препаратами. Если назначение парентеральных антибиотиков действительно необходимо, следует выбрать препарат с длительным периодом полувыведения (например, цефтриаксон), что позволяет назначать его один раз в сутки.
IV. Ошибки при комбинированном назначении антибиотиков
Одной из ошибок антибактериальной терапии внебольничных респираторных инфекций является необоснованное назначение комбинации антибиотиков. Врачи старших поколений помнят то время (50—70-е гг. прошлого столетия), когда при лечении пневмонии обязательным считалось назначение пенициллина и стрептомицина, о чем свидетельствовали многие учебные пособия и руководства. Это был своеобразный стандарт лечения пневмоний для того времени. Несколько позднее одновременно с антибиотиками рекомендовалось назначение сульфаниламидов, с учетом полученных в свое время З. В. Ермольевой данных о химиотерапевтическом синергизме сульфаниламидов и пенициллина.
В современной ситуации, при наличии большого арсенала высокоэффективных антибактериальных препаратов широкого спектра, показания к комбинированной антибактериальной терапии значительно сужены, и приоритет в лечении респираторных инфекций остается за монотерапией. В многочисленных контролируемых исследованиях показана высокая клиническая и бактериологическая эффективность адекватных антибактериальных средств при лечении респираторных инфекций в режиме монотерапии (амоксициллин, амоксициллин/клавуланат, цефалоспорины II-III поколений, новые фторхинолоны). Комбинированная антибактериальная терапия не имеет реальных преимуществ ни в выраженности эффекта, ни в предотвращении развития резистентных штаммов.
Основными показаниями к комбинированной антибактериальной терапии являются тяжелое течение пневмонии — в этом случае общепринятым стандартом лечения становится комбинированное назначение парентерального цефалоспорина III поколения (цефотаксим или цефтриаксон) и парентерального макролидного антибиотика (эритромицин, или кларитромицин, или спирамицин); последние включаются в комбинацию для воздействия на вероятных атипичных микроорганизмов (легионелла или микоплазма). Следует отметить, что в настоящее время в клинической практике появились новые антибактериальные препараты (левофлоксацин, моксифлоксацин) с высокой активностью в отношении как типичных, так и атипичных возбудителей, что позволяет назначать их в режиме монотерапии даже при тяжелой пневмонии.
Другой клинической ситуацией, оправдывающей комбинированное назначение антибиотиков, является пневмония у иммунокомпрометированных пациентов (лечение цитостатиками, СПИД), при которой имеется высокая вероятность ассоциации возбудителей (см. таблицу 7).
К сожалению, часто в амбулаторной практике приходится сталкиваться с ситуациями, при которых больным с нетяжелым течением пневмонии, при отсутствии осложнений, тяжелой фоновой патологии назначается два антибиотика. Логичного обоснования этой тактики лечения нет, при этом следует учитывать возможный антагонизм препаратов, более высокий риск нежелательных реакций и увеличение стоимости лечения.
Следует отметить, что нерациональные комбинации антибактериальных препаратов имеют и официальные лекарственные формы, которые выпускаются отечественной фармацевтической промышленностью, например ампиокс, олететрин. Разумеется, применение таких препаратов недопустимо.
V. Ошибки, связанные с длительностью антибактериальной терапии и критериями клинической эффективности
В некоторых случаях проводится необоснованно длительная антибактериальная терапия. Такая ошибочная тактика обусловлена, прежде всего, недостаточным пониманием цели самой антибактериальной терапии, которая сводится прежде всего к эрадикации возбудителя или подавлению его дальнейшего роста, т. е. направлена на подавление микробной агрессии.
Собственно воспалительная реакция легочной ткани, которая проявляется различными клинико-рентгенологическими признаками (аускультативная картина, сохраняющаяся рентгенологическая инфильтрация, ускорение СОЭ) регрессирует медленнее и не требует продолжения антибактериальной терапии (см. таблицу 9). В связи с этим следует считать ошибочной тактику, согласно которой у больногос сохраняющимися рентгенологическими признаками легочной инфильтрации, крепитирующими хрипами (crepitacio redux), увеличением СОЭ при нормализации температуры тела и исчезновении (или уменьшении) признаков интоксикации продолжают проводить антибактериальную терапию.
 |
| Таблица 9. Сроки исчезновения симптомов при эффективной антибактериальной терапии внебольничной пневмонии. |
Еще более ошибочна тактика замены одного антибиотика на другой в подобных ситуациях, расцениваемых врачом как неэффективность назначенной антибактериальной терапии. У некоторых больных после исчезновения признаков интоксикации и даже регрессии воспалительных изменений в легких в течение длительного времени может сохраняться слабость, потливость, субфебрильная температура. Последняя расценивается врачом как проявление не полностью купированной бронхолегочной инфекции, что «подтверждается» рентгенологическими данными в виде изменения легочного рисунка или «остаточными явлениями пневмонии» и обычно влечет за собой назначение антибактериального препарата, несмотря на отсутствие изменений со стороны крови. Между тем подобная клиническая ситуация часто обусловлена вегетативной дисфункцией после легочной инфекции (постинфекционная астения) и не требует антибактериальной терапии, хотя, разумеется, в каждом конкретном случае необходимы тщательное обследование больного и расшифровка всей имеющейся симптоматики.
Рекомендованная длительность применения антибактериальных препаратов при бронхолегочных инфекциях приведена в таблице 10.
 |
| Таблица 10. Длительность антибактериальной терапии бактериальных респираторных инфекций в амбулаторной практике. |
Л. И. Дворецкий, доктор медицинских наук, профессор
С. В. Яковлев, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва