Что значит переходные элементы
Переходные элементы
Переходные металлы (переходные элементы) — химические элементы побочных подгрупп I — VIII групп Периодической системы элементов Д.И. Менделеева (3 — 12 групп в длиннопериодном варианте таблицы).
Переходные металлы выделяют на основании незавершённости внутренних электронных оболочек их атомов или ионов. Термин «переходные» связан с тем, что в периодах эти элементы располагаются между s- и р-элементами. Переходные металлы, в свою очередь, подразделяют на d-элементы, у которых происходит заполнение 3d-, 4d-, 5d- и 6d-подоболочек, и f-элементы, у которых заполняется 4f- (лантаноиды) либо 5f-подоболочка (актиноиды). Цинк, кадмий и ртуть, обычно причисляемые к переходным металлам, строго говоря, таковыми не являются, поскольку их катионы имеют завершённый d-подуровень.
Незавершённость внутренних электронных оболочек предопределяет наличие у переходных металлов ряда специфических свойств: способность к образованию координационных (комплексных) соединений, ферромагнетизм некоторых металлов, парамагнетизм многих соединений и т.д.
| Группа | III B (3) | IV B (4) | V B (5) | VI B (6) | VII B (7) | VIII B (8) | VIII B (9) | VIII B (10) | I B (11) | II B (12) |
|---|---|---|---|---|---|---|---|---|---|---|
| 4-й период | Sc 21 | Ti 22 | V 23 | Cr 24 | Mn 25 | Fe 26 | Co 27 | Ni 28 | Cu 29 | Zn 30 |
| 5-й период | Y 39 | Zr 40 | Nb 41 | Mo 42 | Tc 43 | Ru 44 | Rh 45 | Pd 46 | Ag 47 | Cd 48 |
| 6-й период | * | Hf 72 | Ta 73 | W 74 | Re 75 | Os 76 | Ir 77 | Pt 78 | Au 79 | Hg 80 |
| 7-й период | ** | Rf 104 | Db 105 | Sg 106 | Bh 107 | Hs 108 | Mt 109 | Ds 110 | Rg 111 | Uub 112 |
| *Лантаноиды | La 57 | Ce 58 | Pr 59 | Nd 60 | Pm 61 | Sm 62 | Eu 63 | Gd 64 | Tb 65 | Dy 66 | Ho 67 | Er 68 | Tm 69 | Yb 70 | Lu 71 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| **Актиноиды | Ac 89 | Th 90 | Pa 91 | U 92 | Np 93 | Pu 94 | Am 95 | Cm 96 | Bk 97 | Cf 98 | Es 99 | Fm 100 | Md 101 | No 102 | Lr 103 |
Полезное
Смотреть что такое «Переходные элементы» в других словарях:
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ, химические элементы, расположенные в побочных подгруппах больших периодов периодической системы; металлы. Из 109 элементов 65 переходные. Переходные элементы, кроме железа, мало распространены в природе … Современная энциклопедия
Переходные элементы — ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ, химические элементы, расположенные в побочных подгруппах больших периодов периодической системы; металлы. Из 109 элементов 65 переходные. Переходные элементы, кроме железа, мало распространены в природе. … Иллюстрированный энциклопедический словарь
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ, металлические элементы, имеющие незаполненные внутренние электронные оболочки. Переходные элементы характеризуются переменной ВАЛЕНТНОСТЬЮ и образованием окрашенных ионов. Сюда входят элементы с атомным номером от 21 до 112.… … Научно-технический энциклопедический словарь
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — В соответствии с периодической классификацией элементов существует 44 элемента, образующих подгруппы А. В каждой из этих подгрупп (или семейств) на внешней (валентной) электронной оболочке число электронов равно номеру группы. При переходе от… … Энциклопедия Кольера
переходные элементы — pereinamieji elementai statusas T sritis chemija apibrėžtis d ir f elementai. atitikmenys: angl. transition elements rus. переходные элементы … Chemijos terminų aiškinamasis žodynas
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — (переходные металлы; хим. элементы, расположенные в побочных подгруппах больших периодов периодической системы; являются d и f элементами. Назв. переходные связано с тем, что в периодах П. э. вклиниваются между s и р элементами. Всего известно 65 … Химическая энциклопедия
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ (переходные металлы; хим. элементы, расположенные в побочных подгруппах больших периодов периодической системы; являются d- и f-элементами. Назв. «переходные» связано с тем, что в периодах переходные элементы вклиниваются между s- и р-элементами. Всего известно 65 переходных элементов, включая элемент 109 в 7-м периоде; 4-, 5- и 6-й периоды содержат по 10 d-элементов, 6-й период включает также 14 f-элементов (лантаноиды); в незавершенном 7-м периоде известно 7 d-элементов, начиная с Ac, и 14 f- элементов (актиноиды). В отличие от s- и p-элементов, у к-рых заполняются внеш. оболочки (соотв. ns- и np-оболочки), у переходных элементов заполняются внутренние (п — 1) d-оболочки (d-элемен-ты) или (n — 2)f-оболочки (f-элементы).
П ереходные элементы, кроме Fe и Ti, мало распространены в земной коре.
Все переходные элементы металлы. Mн. особенности, характерные для d-элементов, наблюдаются также и для f-элементов, к-рые более похожи на d-элементы, чем на s- и р-элементы. О св-вах f-элементов см. Актиноиды, Редкоземельные элементы. Св-ва d-элементов в виде простых в-в весьма разнообразны; так, среди них имеется наиб. легкоплавкий металл-Hg и наиб. тугоплавкий-W. Как правило, d-металлы отличаются высокой энтальпией возгонки, значит, электрич. проводимостью, уникальными магн. св-вами. Химия d-элементов во многом отличается от химии s- и p-элементов, что связано с большим числом степеней окисления d-элементов (напр., Ru проявляет все степени окисления от 0 до +8) и образованием координац. соединений. В отличие от s- и р-элементов, d-элементы имеют много общих черт.
Большинство соед. d-элементов координационные, в частности карбонилы, «сэндвичевые». Для d-элементов характерно образование кластеров, а также нестехиометрич. соед. (оксиды, сульфиды и др.). Соед. d-элементов, как правило, окрашены. Окраска объясняется расщеплением уровней энергии d-электронов в поле лигандов; это делает возможным переход (при поглощении квантов света) d-электронов с низшего уровня на высший. Доля ковалентной связи в соед. d-элементов больше, чем в соед. s-металлов (но меньше, чем в соед. р-элементов), что сказывается на св-вах соединений переходных элементов они более легкоплавки, более летучи и более подвержены гидролизу, чем аналогичные соед. s-эле-ментов.
Mн. d-элементы в виде металлов имеют очень высокую каталитич. активность, особенно выделяются в этом отношении Pt и Pd; велика каталитич. активность и мн. с оединений П.Э. С И. Дракин
Переходный металл: свойства и список
Элементы в периодической таблице часто делятся на четыре категории: элементы основной группы, переходные металлы, лантаноиды и актиноиды. В основные элементы группы включают активные металлы в двух колонках по крайней левой части таблицы Менделеева и металлов, полуметаллов и неметаллов в шести колонках на крайней правой. Эти переходные металлы являются металлическими элементами, которые выступают в качестве своего рода моста или перехода между частями сторонами периодической таблицы.
Что это такое

Из всех групп химических элементов переходные металлы могут быть наиболее сложными для идентификации, потому что существуют различные мнения относительно того, что именно туда должно быть включено. Согласно одному из определений, к ним относят любые вещества с частично заполненной d-электронной подоболочкой (обиталью). Это описание относится к группам с 3-й по 12-ю в периодической таблице, хотя элементы f-блока (лантаноиды и актиноиды, расположенные ниже основной части периодической таблицы) также являются переходными металлами.
Их название связано с именем английского химика Чарльза Бери, который использовал его в 1921 году.
Место в периодической таблице
Переходными являются все металлы рядов, расположенных в группах от IB до VIIIB периодической таблицы:
Последняя группа включает лантаноиды и актиноиды(так называемые f-элементы, которые представляют собой их особую группу, все остальные относятся к d-элементам).
Переходные металлы: список
Перечень этих элементов представлен:
Группа лантаноидов представлена:
Особенности
В процессе образования соединений атомы металлов могут использоваться как валентные s- и p-электроны, так и d-электроны. Поэтому d-элементы в большинстве случаев характеризуются переменной валентностью, в отличие от элементов главных подгрупп. Это свойство обуславливает их способность к образованию комплексных соединений.
Наличие определенных свойств обуславливает название этих элементов. Все переходные металлы ряда являются твердыми с высокими температурами плавления и кипения. При перемещении слева направо по периодической таблице пять d-орбиталей становятся более заполненными. Их электроны слабо связаны, что способствует высокой электропроводности и податливости переходных элементов. Им свойственна также низкая энергия ионизации (она требуется при удалении электрона от свободного атома).
Химические свойства
Переходные металлы проявляют широкий спектр состояний окисления или положительно заряженных форм. В свою очередь, они позволяют переходным элементам образовывать много различных ионных и частично ионных соединений. Образование комплексов приводит к расщеплению d-орбиталей на два энергетических подуровня, что позволяет многим из них поглощать определенные частоты света. Таким образом, образуются характерные окрашенные растворы и соединения. Эти реакции иногда усиливают относительно низкую растворимость некоторых соединений.
Переходные металлы характеризуются высокой электропроводностью и теплопроводностью. Они податливы. Обычно образуют парамагнитные соединения из-за неспаренных d-электронов. Также им свойственна высокая каталитическая активность.
Следует также отметить, что существует некоторая полемика о классификации элементов на границе между основной группой и элементами переходного металла в правой части таблицы. Этими элементами являются цинк (Zn), кадмий (Cd) и ртуть (Hg).
Проблемы систематизации
Разногласия относительно того, следует ли классифицировать их как относящиеся к основной группе или переходные металлы, свидетельствуют о том, что различия между этими категориями не ясны. Между ними есть определенное сходство: они выглядят как металлы, они податливы и пластичны, они проводят тепло и электричество и образуют положительные ионы. Тот факт, что двумя лучшими проводниками электричества являются переходный металл (медь) и элемент, относящийся к основной группе (алюминий), показывает степень, в которой физические свойства элементов двух этих групп перекрываются.
Сравнительная характеристика
Существуют также различия между основными и переходными металлами. Например, последние являются более электроотрицательными, чем представители основной группы. Поэтому они с большей вероятностью образуют ковалентные соединения.
Еще одно отличие между основной группой и ионами переходных металлов заключается в легкости, с которой они образуют стабильные соединения с нейтральными молекулами, такими как вода или аммиак.
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ
Полезное
Смотреть что такое «ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ» в других словарях:
Переходные элементы — Переходные металлы (переходные элементы) химические элементы побочных подгрупп I VIII групп Периодической системы элементов Д.И. Менделеева (3 12 групп в длиннопериодном варианте таблицы). Переходные металлы выделяют на основании незавершённости… … Википедия
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ, химические элементы, расположенные в побочных подгруппах больших периодов периодической системы; металлы. Из 109 элементов 65 переходные. Переходные элементы, кроме железа, мало распространены в природе … Современная энциклопедия
Переходные элементы — ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ, химические элементы, расположенные в побочных подгруппах больших периодов периодической системы; металлы. Из 109 элементов 65 переходные. Переходные элементы, кроме железа, мало распространены в природе. … Иллюстрированный энциклопедический словарь
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ, металлические элементы, имеющие незаполненные внутренние электронные оболочки. Переходные элементы характеризуются переменной ВАЛЕНТНОСТЬЮ и образованием окрашенных ионов. Сюда входят элементы с атомным номером от 21 до 112.… … Научно-технический энциклопедический словарь
переходные элементы — pereinamieji elementai statusas T sritis chemija apibrėžtis d ir f elementai. atitikmenys: angl. transition elements rus. переходные элементы … Chemijos terminų aiškinamasis žodynas
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — (переходные металлы; хим. элементы, расположенные в побочных подгруппах больших периодов периодической системы; являются d и f элементами. Назв. переходные связано с тем, что в периодах П. э. вклиниваются между s и р элементами. Всего известно 65 … Химическая энциклопедия
Что значит переходные элементы
Химия
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
Характеристика переходных элементов
Понятие переходный элемент обычно используется для обозначения любого из d- или f-элементов. Эти элементы занимают переходное положение между электроположительными s-элементами и электроотрицательными p-элементами. d-элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно.
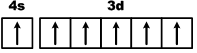
Первый переходный ряд включает 10 элементов, от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей. Хром и медь имеют на 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или заполненные d-подоболочки обладают большей устойчивостью, чем частично заполненные.
В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной.
Cr 24 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5
Для атома хрома электроно-графическая формула выглядит так:
Это явление называется проскок (провал) электрона.
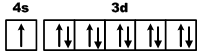
В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов (аналогичным образом объясняется аномалия серебра).
Cu 29 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10
Все d-элементы являются металлами. Большинство из них имеет характерный металлический блеск. По сравнению с s-металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы).
d-элементы и их соединения обладают рядом характерных свойств: переменные состояния окисления; способность к образованию комплексных ионов; образование окрашенных соединений.
d-элементы характеризуются также более высокой плотностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду.
d-элементы — хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон сверх полузаполненной или заполненной d-оболочки. Например, медь.
Химические свойства. Электроотрицательность и энергии ионизации металлов первого переходного ряда возрастают в направлении от хрома к цинку. Это означает, что металлические свойства элементов первого переходного ряда постепенно ослабевают в указанном направлении. Такое изменение их свойств проявляется и в последовательном возрастании окислительно-восстановительных потенциалов с переходом от отрицательных к положительным значениям.
Хром — твердый голубовато-белый металл. При высоких температурах горит в кислороде с образованием Сr2О3, реагирует с парами воды
и с галогенами, образуя галогениды состава СrГ3. Хром (так же, как алюминий) пассивируется холодными концентрированными Н2SО4 и НNО3. Однако при сильном нагревании эти кислоты растворяют хром:
СrСl2 + 2 NaОН = Сr(ОН)2↓ + 2 NaСl.
Соли Cr 3+ сходны с аналогичными солями алюминия. При действии щелочей на соли Сr 3+ выпадает студнеобразный осадок гидроксида хрома (III) зеленого цвета:
обладающий амфотерными свойствами. Он растворяется как в кислотах с образованием солей хрома (III)
так и в щелочах с образованием комплексной соли
Наиболее важными соединениями хрома в высшей степени окисления +6 хромат калия К2СrО4 и дихромат калия К2Сr2О7.