Что значит пептидная связь
Пептидная связь
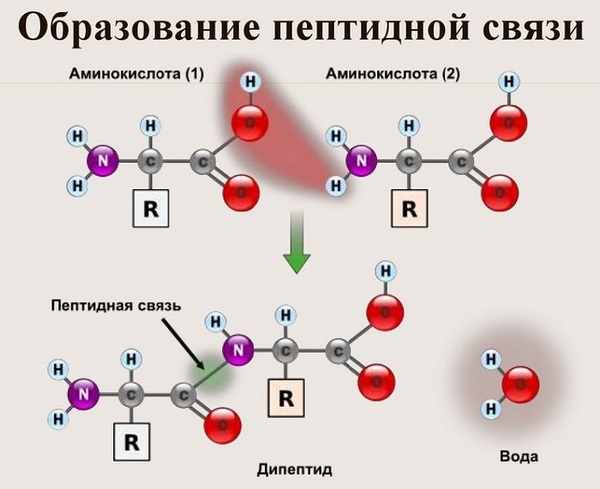
Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
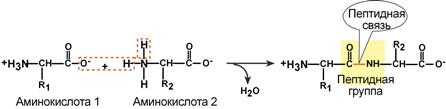
Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R.
Свойства пептидной связи
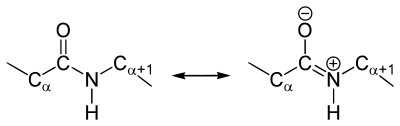
Как и в случае любых амидов, в пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной:
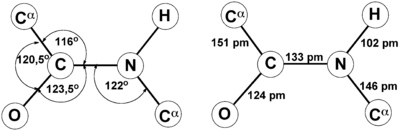
Это проявляется, в частности, в уменьшении её длины до 1,33 ангстрема:
Это обусловливает следующие свойства:
Для обнаружения белков и пептидов, а также их количественного определения в растворе используют биуретовую реакцию.
Ссылки
Полезное
Смотреть что такое «Пептидная связь» в других словарях:
ПЕПТИДНАЯ СВЯЗЬ — ( CO NH ) химическая связь, соединяющая аминогруппу одной аминокислоты с карбоксильной группой другой в молекулах пептидов и белков … Большой Энциклопедический словарь
пептидная связь — – амидная связь (NH CO ), образующаяся между амино и карбоксильной группами аминокислот в результате реакции дегидратации … Краткий словарь биохимических терминов
пептидная связь — Ковалентная связь между альфа аминогруппой одной аминокислоты и альфа карбоксильной группой другой аминокислоты [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN peptide bond … Справочник технического переводчика
Пептидная связь — * пептыдная сувязь * peptide bond ковалентная связь между двумя аминокислотами, возникающая в результате соединения α аминогруппы одной молекулы с α карбоксильной группой др. молекулы, с одновременным удалением воды … Генетика. Энциклопедический словарь
пептидная связь — ( СО NH ), химическая связь, соединяющая аминогруппу одной аминокислоты с карбоксильной группой другой в молекулах пептидов и белков. * * * ПЕПТИДНАЯ СВЯЗЬ ПЕПТИДНАЯ СВЯЗЬ ( CO NH ), химическая связь, соединяющая аминогруппу одной аминокислоты… … Энциклопедический словарь
пептидная связь — peptide bond пептидная связь. Pазновидность амидной связи, образуется между α карбоксильной и α аминогруппой двух аминокислот. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А., Москва: Изд во ВНИРО,… … Молекулярная биология и генетика. Толковый словарь.
пептидная связь — peptidinis ryšys statusas T sritis chemija apibrėžtis Amidinis ryšys, jungiantis elementariąsias grandis baltymo ar peptido molekulėje. atitikmenys: angl. peptide bond rus. пептидная связь … Chemijos terminų aiškinamasis žodynas
ПЕПТИДНАЯ СВЯЗЬ — Связь между аминной группой одной аминокислоты и карбоксильной группой другой … Толковый словарь по психологии
Строение аминокислот. Изоэлектрическая точка. Характеристика пептидной связи
Даже и не знаю с чего начать, давайте попробуем вот так. Белки — это полимерные молекулы, которые состоят из молекул поменьше — мономеров. Этими мономерами будут аминокислоты. Поэтому, если нам хочется построить дом, то сначала нужно разобраться с кирпичами, правильно? Вот в этой статье и будем разбираться с аминокислотами: какие они бывают, сколько их и какие у них свойства. Дальше синтезируем пептид и определим — почему некоторые молекулы называются пептидами, а другие белками. Поймем почему про пептидную связь пишут, что она частично-двойная. А в конце небольшой подарок — торсионные углы. Вроде неплохо получилось? Тогда поехали.
Строение аминокислот
По названию все понятно, аминокислота — это молекула, которая содержит аминогруппу и карбоксильную группу. Но посмотрите на центральный углерод, что за бабник? У него целых четыре разных заместителя — водород, аминогруппа, карбоксильная группа и радикал. Он называется…. Альфа-углерод, такой альфа-самец прямо.
Такое общее строение у всех аминокислот, которые входят в состав белков, но они кое-чем отличаются. Да-да, радикалом. Основных аминокислот — 20 штук, хотя если честно, то 19. А если еще честнее, то их больше, но не будем путаться. У одной аминокислоты особенное строение, она даже не аминокислота вовсе, а иминокислота. Вот наша легенда — пролин.
Вернемся к различиям между аминокислотами. Есть несколько классификаций радикалов, но мы возьмем самую полезную для нас — по полярности. А если говорить простыми словами, то по растворимости радикала в воде. И тут все очень логично — радикалы делятся на неполярные и полярные. Первые нерастворимы в воде, а вторые растворимы. Когда будем говорить о строении белка, то поймем почему нас интересует только эта классификация.
Неполярные радикалы аминокислот
У этих ребят нет групп, которые могут образовать водородные связи с водой, поэтому они нерастворимы. Вместо этого у них есть алифатические и ароматические группы. Радикалы выделены фиолетовым цветом.
Опа, а глицин то получается не альфа-самец, у него два одинаковых заместителя — водороды.
Полярные радикалы аминокислот
Перед этим остановимся на одной вещичке. Я писал формулы аминокислот так, как будто они не находятся в растворе. Но если мы заглянем в клетку, pH в цитоплазме которой 7 и 0, то увидим такую картину.
Полярные радикалы можно разделить на две группы: полярные незаряженные и полярные заряженные.
В этих аминокислотах есть сильно электроотрицательные атомы — азот, кислород и сера. С их помощью молекулы образуют водородные связи и растворяются в воде. Но заряда у них нет.
Заряд у радикала может быть положительным или отрицательным, поэтому здесь небольшое деление.
Кстати, лучше растворимы в воде заряженные радикалы. Но разница между полярными заряженными и незаряженными не слишком большая. И еще одно — аспартат и глутамат это название аспарагиновой и глутаминовой кислот в растворе.
Аминокислоты делятся на полярные и неполярные. Полярные аминокислоты могут быть заряженными или незаряженными.
Аминокислоты называли по месту их выделения или физическим свойствам, поэтому у них такие странные названия. Гликос с греческого — сладкий, вот и глицин сладковат. Так что придется зазубрить это.
Изоэлектрическая точка
Вы уже заметили, что у аминокислот есть положительная и отрицательная части. Не так много молекул имеют такую особенность. Так что аминокислоты — это такой гибрид, поэтому их так и назвали — гибридные ионы. Правда на немецком…. А звучит это так: «Цвиттер-ион». Но как всегда есть один нюанс — у гибридного иона общий заряд молекулы равен нулю.
И вы уже смекнули, что не у всех аминокислот будет общий заряд равен нулю. Для неполярных и полярных незаряженных аминокислот это верно, но че делать с заряженными? До этого мы разбирали заряд аминокислот в клетке, то есть при нейтральном pH. Но что будет с ними, если поместить их в другие значения среды, например, в сильнощелочную или кислотную? Аминокислоты будут менять свой заряд и сейчас посмотрим как.
Думаю, что нужно кое-что уточнить. Вы понимаете, что эти реакции обратимы. Когда я добавляю кислоту или щелочь, неважно, то я смещаю реакцию в какую-то сторону. Пусть я добавляю кислоту. С каждой каплей реакция смещается в сторону образования глицина +1, но только при pH равном 2,34 в растворе будет большая часть глицина +1. Хотя на pH +3 большая часть будет глицина с зарядом 0. Надеюсь, что понятно объяснил.
Как же назвать pH при котором происходит переход из одной формы в другую? Очень просто, показатель константы диссоциации или pKa. Химики не корите, не слишком точно конечно, но запомнить легче. Получается, что в молекуле глицина pKa карбоксильной группы=2,34, а pKa аминогруппы=9,6. Я написал про молекулу глицина, потому что в остальных аминокислотах значения немного отличаются.
А теперь о том, ради чего все это затевалось — изоэлектрическая точка.
Изоэлектрическая точка — это pH среды, при которой заряд молекулы равен нулю. Да, вот так вот просто. Ее, кстати, можно посчитать — для этого нужно сложить pKa двух ближних функциональных групп и поделить на их количество. А их количество — две.
Сделаем тоже самое с молекулами посложнее, начнем с гистидина.
У гистидина есть заряженная группа, поэтому у него побольше вариантов заряда, чем у глицина. Мы видим, что у гистидина карбоксильная группа присоединяет водород при pH =1,82, а аминогруппа отдает протон водорода при pH=9,17. Вот про эти отличия я и говорил до этого, но так-то они не слишком большие. Радикал же отдает протон водорода при pH=6.
Сделаем тоже самое с глутаматом.
Думаю, что смысл понятен. У каждой аминокислоты своя собственная изоэлектрическая точка. Точки уже давно подсчитаны — достаточно найти их в интернете.
Сделаем красивый вывод:
Любая аминокислота цвиттер-ион, но только в изоэлектрической точке
Зачем это нужно? Ну давайте посмотрим. Мы знаем, что каждая аминокислота несет определенный заряд, но этот заряд меняется от pH среды. Если мы поместим аминокислоты в нейтральную среду и закинем туда катод и анод, то положительно заряженные аминокислоты направятся к аноду, а отрицательные к катоду. Остальные аминокислоты можно будет разделить с помощью изменения pH среды, ведь в изоэлектрической точке у аминокислоты не будет заряда. Нет заряда — нет движения к катоду или аноду, аминокислота стоит на месте. Вот мы и разделили аминокислоты в растворе, можно их изучить.
Образование пептидов
Теперь давайте соединим между собой парочку аминокислот, пусть это будет глицин и аланин. Соединяем их с помощью реакции дегидратации — отщепляем молекулу воды и получаем пептид.
Какие группы вступали в реакцию? Да, аминогруппа и карбоксильная группа. Получается, что пептидная связь — это связь между аминогруппой одной аминокислоты с карбоксильной группой другой аминокислоты. Так как соединены две аминокислоты, то название молекулы — дипептид. Ничего не мешает мне присоединить еще одну.
И это уже трипептид. Если соединены до 10 пептидов, то это олигопептид. От 10 до 50 — полипептид, ну а если больше 50, то это белок. Как видите реакция обратима, можно провести гидратацию по пептидной связи и пептид разрушится. На самом деле реакция гидратации идет намного лучше, а вот для дегидратации нужен источник энергии — АТФ, и рибосомальная РНК. Так что для синтеза пептидов/белков организм неплохо так тратится.
Ну и вы заметили, что я располагаю радикалы с разных сторон — то сверху, а то снизу. Это транс положение, оно более устойчиво, но можете писать как хотите.
Белок — это пептид, который содержит более 50 остатков аминокислот
Пептидная связь
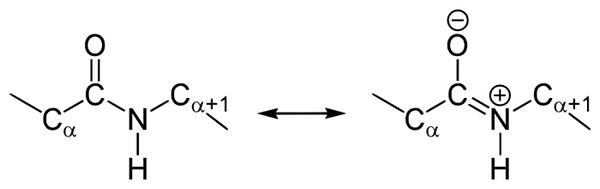
У пептидной связи есть свои секретики, но мы не дадим ей хранить их просто так. Главный секрет в том, что двойная связь находится не у кислорода, а у азота… Хотя это не совсем двойная связь, но близка к ней. Как же это происходит? У азота есть неподеленная электронная пара, электроны могут перейти от азота к кислороду, а двойная связь перейдет от кислорода к азоту — неплохой такой обменчик. Это явление называется резонанс пептидной связи, именно из-за него во всех учебниках пишут про «частично-двойной характер пептидной связи».
Так как все углы по 120 градусов, то все 6 атомов — 3 углерода, азот, водород и кислород, лежат в одной плоскости, как будто на ладошке. За счет того, что углерод и азот образуют две связи — одну пи и одну сигму, вращение вокруг этих связей практически невозможно. Но об этом чуть позже, сейчас давайте упростим эту схему.
Это мы сделали только с одной пептидной связью, но что если добавить вторую? Получится кое что интересненькое…
Следующая пептидная связь такая же, как и предыдущая. Получается, что опять 6 атомов лежат в одной плоскости, вы видите, что один атом углерода принадлежит сразу к двум плоскостям и это удивительно! Можно даже подумать, что все эти пептидные связи будут лежать в одной и той же плоскости, но это не так, а виной этому — вращение вокруг связей.
Диэдральные или торсионные углы
Название пугающее, но сейчас как устроим этим углам! Так, мы уже говорили о том, что вокруг пептидной связи не повращаться из-за того, что она частично двойная. Но ведь есть и другие связи, вокруг которых можно устроить веселуху.
Понимаю, что представить это не так уж и легко, но можно попробовать сделать! Получится конечно не совсем так, но принцип поймем. Возьмем ручку и два колпачка, засунем бумажку под каждый колпачок и начнем крутить. Условимся, что мои пальцы — альфа-углеродный атом, то есть место пересечения двух плоскостей.
Теперь мы поняли, как происходит вращение, но это еще не все. Существуют определенные углы между плоскостями и всего их два. Представьте, что нам захочется найти угол между углеродами, у которых карбоксильная группа, двух плоскостей. Или угол между двумя атомами азота, опять же, двух разных плоскостей. Задачка кажется сложной… Но перед этим, а зачем я вообще мучаю вас этим? Дело в том, что когда мы дойдем до конформации белковых молекул, то благодаря этим углам мы поймем: как и почему образуется альфа-спираль, тоже самое с бета-складчатостью. Так что потерпите немного!
Если посмотреть на эту схему, то можно кое-что прикинуть: если мы будем вращать связь между N и C, то углерод с карбоксильной группой изменит положение относительно углерода другой плоскости, а вот азот останется на том же месте — угол между двумя азотами не изменится. А вот если начнем вращать связь между C и C, то все будет наоборот: угол между азотами изменится, но вот углероды с карбоксильной группой останутся на месте. Сложновато, но чуть дальше я дам пространственную картинку. Пока что мы пришли к выводу, что связь между N и C влияет на угол между углеродами — этот угол называется фи. А вот связь между C и C влияет на угол между атомами азота — угол пси.
Теперь можно и добавить атомы водорода в схему, они скоро нам понадобятся.
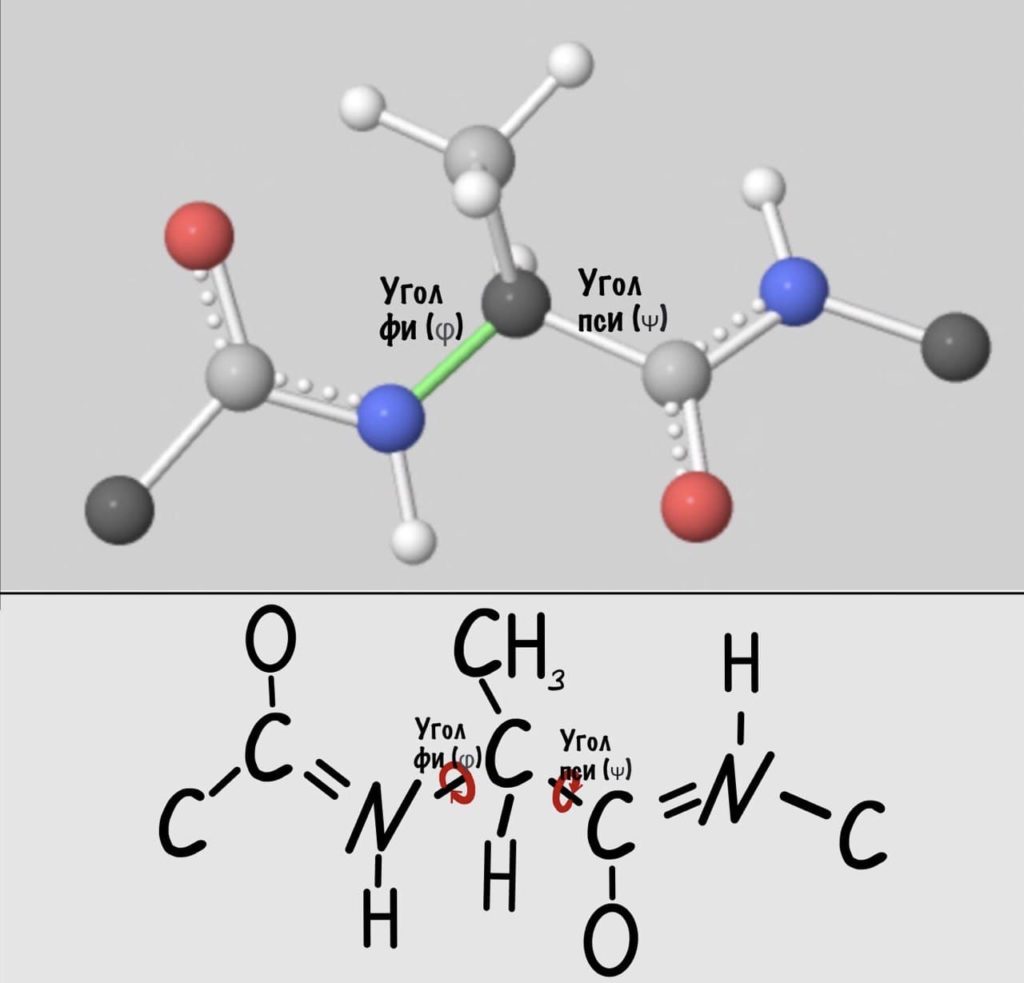
А теперь главный вопрос — как измерить эти углы? Хорошо, что уже это придумали… И мы можем сделать это вместе — заходите сюда и поехали! Первым делом нам нужно перевернуть молекулу так, чтобы расположить атом углерода с карбоксильной группой сверху. Зачем такие выкрутасы? Расскажу позже. А теперь посмотрим прямо в альфа атом углерода, да так что за ним спрятался азот. Как-то это странно звучит, но давайте попробуем.
Еще это можно посмотреть графически с помощью проекций Ньюмана.
Так, повторим что такое угол фи — это угол между двумя карбоксильными атомами углерода. На рисунке уже их видно.
Поняли зачем так крутили молекулу? Да, просто так нам удобнее смотреть угол. А теперь начнем вращать и посмотрим как меняются углы.
Угол пси по такой же логике. Крутим молекулу, чтобы атом азота оказался сверху и смотрим прямо в альфа атом углерода.
Еще разок построим проекцию Ньюмана, она немного отличается, и сразу же отметим углы.
Думаю, что принцип понятен. Дальше можете покрутить сами, правильно? Я не сказал про одно большое «НО» — не каждый угол возможен, так как у атомов есть электронные оболочки, которые заряжены отрицательно. Если электронные оболочки подходят слишком близко, то они отталкиваются и угол меняется. Какие углы возможны? Для этого еще разок зайдите сюда и включите на панельке справа силы Ван-дер-Вальса и show clashes.
Подробнее о влиянии этих углов в следующей статье.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
Аминокислоты соединяются пептидной связью
Пептидная связь – это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
Образование пептидной связи
При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс «-ил», только последняя аминокислота сохраняет свое название неизменным. Например,
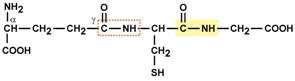
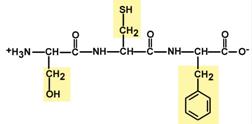
Строение трипептида глутатиона
Особенностью глутатиона является связывание глутамата и цистеина не истинной пептидной связью, а через γ-карбоксильную группу радикала глутаминовой кислоты.
К свойствам пептидной связи относятся:
1. Копланарность
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы «Н» и «О» расположены по разные стороны от пептидной связи.
2.Транс-положение заместителей
Радикалы аминокислот по отношению к оси пептидной C—N-связи находятся по «разные» стороны, в транс-положении.
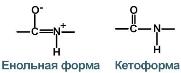
3. Две равнозначные формы
Пептидная связь находится в кетоформе и енольной форме.
4. Способность к образованию водородных связей.
Атомы кислорода и водорода, входящие в пептидную группу, обладают способностью образовывать водородные связи с атомами кислорода и водорода других пептидных групп.
5. Пептидная связь имеет частично характер двойной связи.
Длина пептидной связи меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено. Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).
Пептидная связь: образование, строение, свойства
Содержание:
Именно пептидная связь является основой построения всех белковых молекул, из которых, в конечном счете, образуется вся живая материя. Особенности строения пептидной связи, ее структура оказали огромное влияние на саму возможность существования жизни на нашей планете. О том, что такое пептидная связь, как она образуется и какими свойствами обладает, читайте дальше.
Определение
Пептидная связь это связь, возникающая между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-COOH). Две соединенные одна с другой кислоты образуют дипептид, три – трипепетид и так далее. Длинные цепи подобного рода зовутся полипептидами и белками.
Также академическое определение пептидной связи звучит так: пептидная связь – это вид химической связи, возникающей вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты.
Само же слово «пептид» происходит от греческого «питательный» и означает семейство веществ, молекулы которых построены из двух или более остатков аминокислот, соединенных в цепь пептидными связями —C(O)NH—.
Образование
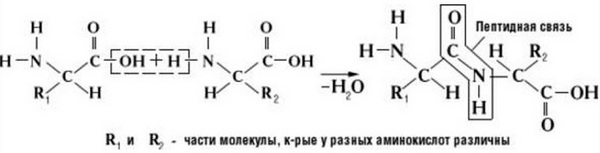
Как образуется пептидная связь? Образование пептидной связи происходит внутри клеток на рибосомах при активном участии ферментов с затратой энергии. Аминокислоты при этом, будучи мономерами, играют роль таких себе строительных блоков белков. Для синтеза белка живыми организмами используется 20 видов различных аминокислот.
Что же касается самого процесса образования пептидной связи между аминокислотами, то она образуется при оттягивании электронной плотности с атома водорода аминогруппы одной аминокислоты и атомом кислорода карбоксильной группы другой аминокислоты.
Вот так процесс образования пептидной связи в молекуле выглядит схематически.
Как следствие разрываются соединения между N и H в аминогруппе и между C и OH в карбоксильной группе. Соединение протона и гидроксильной группы в результате образует воду, а два аминокислотных остатка – дипептид.
Свойства
Пептидная связь, которая имеет место при первичной структуре белков, не является полностью одинарной. Длина ее равна 0,132 нм. Это среднее значение между истинной двойной и одинарной связями.
Важными свойствами пептидной связи являются копланарность и трансположение, далее подробно их поясним.
Копланарность означает, что все атомы, входящие в пептидную группу находятся на одной плоскости, а атомы H и О располагаются по разные стороны от пептидной связи. Но стоит заметить, что радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Трансположение означает, что кислород и водород пептидной связи находятся в транс-ориентации. Также в транс-ориентации ориентированы аминокислотные R-группы во всех белковых и пептидных молекулах естественного происхождения.
Строение
Структура подобной пептидной связи и формула отражена на картинке.
Методы определения связей
Наилучшим методом для определения пептидных связей является биуретовая реакция. Такое название она имеет потому, что впервые эта реакция была использована для получения биурета, который хотя и не является аминокислотой, но обладает при этом двумя пептидными связями.
Сам механизм определения сводится к тому, что аминокислоты, способные образовать как минимум две пептидные связи в щелочной среде при добавлении сульфата меди образуют медьсодержащее комплексное соединение фиолетового цвета.
Рекомендованная литература и полезные ссылки
Видео
Пептидный связь
Пептидные связи чаще всего встречаются в природе в составе пептидов и белков, они соединяют между собой остатки аминокислот. Пепдидни связи также является основой пептидной нуклеиновой кислоты (ПНА). Полиамиды, такие как нейлон и арамид, — синтетические молекулы (полимеры), которые также содержат пептидные связи.
Образование пептидной связи
Пептидный связь образуется в результате реакции конденсации между карбоксильной и аминогруппой. При этом аминогруппа играет роль нуклеофила, замещая гидроксил карбоксильной группы:
Реакция конденсации, в результате которой происходит формирование пептидной связи, требует вклада свободной энергии. Как в химическом синтезе, так и в биосинтезе белков, это обеспечивается активацией карбоксильных групп, в результате чего отхождения гироксильнои группы облегчается.
Резонансные формы пептидной группы
В 1930-1940-х годах Лайнус Полинг и Роберт Кори проводили рентгеноструктурный анализ нескольких аминокислот и дипептидов. Им удалось установить, что пептидная группа жесткую планарную структуру, шесть атомов лежат в одной плоскости: α-атом углерода и C = O группа первой аминокислоты и N-H группа и α-атом углерода второй аминокислоты. Полинг объяснил это существованием двух резонансных форм пептидной группы, на что указывала меньше длина C-N связи в пептидной группе (133 пм), чем того же связи в простых аминов (149 пм). Итак вследствие частичного разделения электронной пары между карбонильным кислорода и амидной азотом, пептидный связь на 40% имеет свойства двойного:
В пептидных группе вращения вокруг C-N связи не происходит вследствие его частичной двойственности. Вращение разрешено только вокруг связей С-С α и N-С α. В результате остов пептида может быть представлен как серия полей, разделенных совместными точками вращения (С α атомы). Такая структура ограничивает количество возможных конформаций пептидных цепей.
Кроме того, эффект резонанса стабилизирует группу добавляя энергию примерно 84 ккал / моль, что делает ее менее химически активным, чем много подобных групп (например эфиров). Эта группа незаряженная за физиологических значений pH, но вследствие существования двух резонансных форм карбонильный кислород несет частичный отрицательный заряд, а амидный азот — частичный положительный. Таким образом возникает диполь с дипольным моментом, около 3,5 Дебай (0,7 электрон-ангстрем). Эти дипольные моменты могут ориентироваться параллельно в определенных типах вторичной структуры (например α-спирали).
Стереоизомерия
Возможные конфигурации
Возможны конформации
Конформация пептида определяется тремя торсионными углами, отражающие вращения вокруг трех последовательных связей в пептидной остове: ψ (пси) — вокруг C α1-С, ω (омега) — вокруг С-N, и φ (фи) — вокруг N- С α2.
Поскольку связи N-С α2 и C α1-С по обе стороны от пептидной являются обычными одинарными связями, вращения вокруг них неограничен, в результате чего пептидные цепи могут принимать различные пространственные конформации. Однако возможны не все комбинации торсионных углов, при некоторых из них происходит пространственное столкновения атомов. Допустимые значения визуализируют на двухмерном графике, называется диаграммой Рамахандрана.
Методы определения
Пептидная группа имеет характерную полосу поглощения в диапазоне 190-230 нм.
Качественной реакцией на пептидный связь является биуретовая реакция с концентрированным раствором меди (II) сульфата (CuSO 4) в щелочной среде. Продуктом является комплекс сине-фиолетовой окраски между атомом меди и амтомамы азота.
Биуретовая реакция может быть использована для колориметрического измерения концентрации белков и пептидов, однако из-за низкой чувствительности этого метода значительно чаще используют его модификации. Одной из таких модификаций является метод Лоури, в котором биуретовая реакция сочетается с окислением остатков ароматических аминокислот.