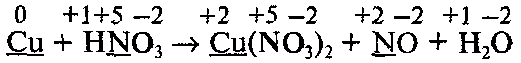Что значит овр досуг
Окислительно-восстановительные реакции (ОВР)
Все химические реакции можно разделить на два типа:
1) Реакции, которые протекают без изменения степеней окисления элементов: степени окисления всех элементов в молекулах исходных веществ равны степеням окисления этих элементов в молекулах продуктов реакции. Например:
2) Реакции, которые протекают с изменением степеней окисления элементов: степени окисления всех или некоторых элементов в молекулах исходных веществ не равны степеням окисления этих элементов в молекулах продуктов реакции. Например:
Реакции второго типа называются окислительно-восстановительными.
Окислительно-восстановительные реакции (ОВР) — это химические реакции, при протекании которых степени окисления элементов изменяются.
Изменение степеней окисления в ходе ОВР обусловлено полным или частичным переходом электронов от атомов одного элемента к атомам элемента.
Так, в реакции 4.1.2 каждый атом магния отдает 2 электрона:
Mg 0 = Mg +2 + 2ē (или: Mg 0 — 2ē = Mg +2 ) (4.1.4)
Эти электроны переходят к молекуле кислорода. Каждый атом кислорода в молекуле О2 присоединяет 2 электрона, поэтому молекула кислорода присоединяет 4 электрона:
Атом марганца, который в исходном веществе (KМnО4) имеет степень окисления +7, присоединяет 5 электронов и превращается в атом марганца со степенью окисления +2 (такую степень окисления он имеет в молекуле продукта реакции MnCl2):
Mn +7 + 5ē = Mn +2 (4.1.7)
Рассмотренный выше механизм ОВР объясняет, почему эти реакции называют реакциями с переносом электронов. Реакции, при протекании которых степени окисления не изменяются, называются реакциями без переноса электронов. Таким образом, любая ОВР представляет собой совокупность процессов отдачи и присоединения электронов.
Процесс отдачи электронов называется окислением. В результате процесса окисления алгебраическая величи на степени окисления элемента повышается.
В рассмотренных примерах процессы 4.1.4 и 4.1.6 являются процессами окисления.
Процесс присоединения электронов называется восстановлением. В результате процесса восстановления алгебраическая величина степени окисления понижается.
Процессы 4.1.5 и 4.1.7 являются примерами процессов восстановления.
Частицы (атомы, молекулы, ионы), которые отдают электроны, называются восстановителями.
В реакциях 4.1.2 и 4.1.3 восстановителями являются соответственно Mg и НCl.
Частицы, которые присоединяют электроны, называются окислителями.
В реакциях 4.1.2 и 4.1.3 окислителями являются соответственно O2 и KМnО4.
Следовательно, в общем виде окислительно-восстановительную реакцию можно представить следующей схемой:
Восстановитель + Окислитель = Продукты реакции
Восстановитель участвует в процессе окисления, т. е. окисляется. А окислитель участвует в процессе восстановления, т. е. восстанавливается.
Важнейшие окислители и восстановители
Какие же вещества могут быть окислителями и какие восстановителями? Это зависит от величины степеней окисления элементов, которые входят в состав данных веществ. Как известно, некоторые элементы имеют постоянные степени окисления во всех или в большинстве сложных веществ. Для таких элементов изменение степеней окисления нехарактерно. Поэтому свойства веществ обычно не зависят от присутствия этих элементов. Элементы с переменной степенью окисления, как правило, легко ее изменяют, т. е. могут участвовать в процессах отдачи или присоединения электронов. Поэтому свойства сложных веществ обусловлены наличием в их составе элементов с переменной степенью окисления.
Если в состав вещества входит элемент с высшей степенью окисления, он может только понижать ее, т. е. участвовать в процессе восстановления. Следовательно, данное вещество может только присоединять электроны и выступать только в роли окислителя.
Например, свойства перманганата калия KМnО4 определяются степенью окисления марганца (калий и кислород — элементы с постоянной степенью окисления). Марганец в KМnО4 имеет высшую степень окисления +7, поэтому KМnО4 может быть только окислителем.
Если в состав вещества входит элемент с низшей степенью окисления, он может только повышать ее, т. е. участвовать в процессе окисления. Следовательно, данное вещество может только отдавать электроны и выступать только в роли восстановителя.
Например, свойства аммиака NH3 определяются степенью окисления азота (для водорода степень окисления +1 является практически постоянной). Азот в NH3 имеет низшую степень окисления —3, поэтому NH3 может быть только восстановителем.
Если в состав вещества входит элемент с промежуточной степенью окисления, он может как повышать, так и понижать ее, т. е. может участвовать и в процессе окисления, и в процессе восстановления. Следовательно, данное вещество может быть и окислителем, и восстановителем. Это зависит от второго участника реакции.
Например, свойства сульфита натрия Na2SО3 определяются степенью окисления серы, которая имеет промежуточную степень окисления +4. Поэтому Na2SО3 проявляет окислительно-восстановительную двойственность. В реакции с перманганатом калия:
сульфит натрия окисляется до сульфата натрия, т. е. выступает в роли восстановителя. Это обусловлено тем, что KМnО4 может быть только окислителем (см. выше). А в реакции с сероводородом:
сульфит натрия восстанавливается до свободной серы, т. е. выступает в роли окислителя, так как H2S может быть только восстановителем (сера в H2S находится в низшей степени окисления).
Важнейшими окислителями являются:
б) сложные вещества, молекулы которых содержат элементы в высшей степени окисления — перманганат калия KМnО4, хроматы и дихроматы (например, дихромат калия K2СrО7), азотная кислота HNO3 и ее соли — нитраты, концентрированная серная кислота H2SO4, оксид свинца (IV) РbО2, хлорная кислота HClO4 и ее соли — перхлорат и др.
Важнейшими восстановителями являются:
Среди веществ, содержащих элементы в промежуточных степенях окисления, есть вещества, для которых более характерными являются или окислительные, или восстановительные свойства. Обычно являются окислителями галогены Сl2 и Br2, хлорноватистая кислота НClО и ее соли — гипохлориты, хлораты (KСlO3 и др.), оксид марганца (IV) МnO2, соли трехвалентного железа (FeCl3 и др.). Как правило, в роли восстановителей выступают водород Н2, углерод С, оксид углерода (II) СО, сульфиты металлов (Na2SO3 и др.), соли двухвалентного железа (FeSO4 и др.).
Типы окислительно-восстановительных реакций
Различают 3 типа окислительно-восстановительных реакций.
1) Межмолекулярные окислительно-восстановительные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав молекул различных веществ. Примерами данного типа реакций являются
2) Внутримолекулярные окислительно-восстановительные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав одного вещества. Например:
К этому типу ОВР относятся многие реакции термического разложения веществ.
З) Реакции самоокисления-самовосстановления, называемые также реакциями диспропорционирования. Это ОВР, при протекании которых один и тот же элемент, находящийся в промежуточной степени окисления, и окисляется и восстанавливается. Часть атомов данного элемента отдает электроны другой части атомов этого же элемента. Например:
Составление уравнений окислительно-восстановительных реакций
Для составления уравнений окислительно-восстановительных реакций часто используется специальный метод — метод электронного баланса. В основе его лежит следующее правило: общее число электронов, которые отдает восстановитель, должно быть равно общему числу электронов, которые присоединяет окислитель.
Рассмотрим применение метода электронного баланса на примере реакции, которая выражается следующей схемой:
а) Определим степени окисления всех элементов в молекулах исходных веществ и продуктов реакции:
б) Подчеркнем символы элементов, которые изменяют степени окисления в ходе реакции:
в) Составим уравнения процессов окисления и восстановления:
Обратите внимание, что в левой части уравнения процесса окисления взято два атома брома, так как продуктом окисления является двухатомная молекула брома Br2.
г) Находим множители для уравнений процессов окисления и восстановления, при умножении на которые числа отданных и присоединенных электронов будут равны. Так как наименьшим общим кратным чисел «5» и «2» является «10», то уравнение процесса восстановления нужно умножить на «2», а уравнение процесса окисления — на «5»:
д) Найденные множители запишем как коэффициенты перед формулами веществ, которые содержат элементы, участвующие в процессах окисления и восстановления:
е) После этого уравниваем числа атомов элементов, которые не изменяют степени окисления. В данном случае это атомы калия, серы, водорода и кислорода.
Обычно числа атомов водорода и кислорода уравнивают в последнюю очередь. Во многих случаях равенство чисел атомов кислорода в левой и в правой частях уравнения ОВР свидетельствует о том, что это уравнение составлено правильно (в составленном уравнении 40 атомов кислорода и в левой, и в правой частях).
Рассмотрим некоторые более сложные примеры составления уравнений ОВР.
Составим уравнение реакции, которая протекает по следующей схеме:
Определим степени окисления всех элементов и подчеркнем символы элементов, которые изменяют свои степени окисления:
Составим уравнения процессов окисления и восстановления и найдем множители, на которые нужно умножить эти уравнения:
Обратите внимание, что не все атомы азота, которые входят в состав HNО3, изменяют свою степень окисления: часть атомов азота без изменения степени окисления переходит в молекулы Cu(NO3)2 Поэтому найденные методом электронного баланса коэффициенты напишем перед всеми формулами, содержащими Сu и N, кроме формулы HNO3:
Коэффициент перед формулой HNO3 равен общему числу атомов азота в правой части уравнения, т. е. равен 8 (из них 6 атомов, которые не изменяют степень окисления):
В последнюю очередь уравниваем числа атомов водорода и кислорода:
В некоторых ОВР более двух элементов изменяют свои степени окисления. В качестве примера рассмотрим следующую реакцию:
Два элемента — фосфор и сера — в ходе этой реакции окисляются, один элемент — азот — восстанавливается:
Общее число электронов, которые участвуют в процессах окисления, равно 22; в процессе восстановления участвует 1 электрон. Поэтому общий множитель для двух уравнений процессов окисления равен 1, а множитель для уравнения процесса восстановления равен 22. Запишем эти множители в качестве коэффициентов перед формулами соответствующих веществ:
В заключение уравняем числа атомов водорода и кислорода:
Досуг лейтенантов бригады ОВР
Досуг лейтенантов бригады ОВР
Читайте также
Глава 2 Досуг в палате реанимации: побег в Сибирь
Глава 2 Досуг в палате реанимации: побег в Сибирь 1Иногда в минуту уныния мне кажется, что моя сибирская эпопея была бессмысленна. Давным-давно мы поспорили с моим школьным товарищем: надо ли ради познания жизни специально подвергать себя испытаниям, или можно стать
«Я не хотел делить досуг с тобой, тоска…»
«Я не хотел делить досуг с тобой, тоска…» Я не хотел делить досуг с тобой, тоска; Я вышел в ржавый сад, где пахнет влажной глиной, И вот над головой простые облака, Крутая синева и клекот журавлиный. Уже четвертый час, но еще сыро тут, Еще не сумерки, но здесь уже лилово, И
Люди бригады
Возрождение бригады
Возрождение бригады Как капля ртути, упав, разбивается на десятки мелких шариков, так раздробилась под Харьковом восьмая истребительная противотанковая бригада. Группы, вышедшие из окружения, стекались в Новом Осколе. Многих своих товарищей не досчитались бойцы: кто
9. Побег из бригады.
9. Побег из бригады. У реки, где расположен лагерь военнопленных, заключенные финны строили водонасосную станцию. От нее к заводу рыли траншею для водопровода. Война поглотила все людские резервы Финляндии, и заключенные, за исключением политических, были отправлены на
Досуг и развлечения учащихся
Досуг и развлечения учащихся В жизни ученических интернатов, удаленных от крупного культурного центра, в целях наилучшей их постановки большое внимание уделялось развлечениям учащихся, чтобы заполнить их досуг и чтобы дать выход неиссякаемой юношеской энергии.Среди
«Самодеятельный» культурный досуг
«Самодеятельный» культурный досуг Самой распространенной формой самодеятельного досуга были у нас солдатские байки, или, попросту, треп. Лишь два-три батарейца обладали талантом краснобайства, и к ним часто обращались с просьбой развлечь народ, рассказать что-нибудь
Организованный досуг фронтовиков
Организованный досуг фронтовиков Помимо самодеятельных развлечений, в спокойные периоды бывали у нас и настоящие концерты. Их давали, правда, очень редко, коллективы фронтового и армейского эстрадных ансамблей. Эти концерты запомнились надолго. Дивизионный ансамбль
Досуг крейсерских лейтенантов
Досуг крейсерских лейтенантов О том, что нас месяцами не отпускали с борта крейсера под предлогом организационного периода, я уже упоминал. В свободное от службы время лейтенантство развлекалось, как могло. В частности мой друг командир группы космической связи
Досуг
Досуг Николай II Николай IIВечером мы обычно играем в игры. Как это напоминает мне милый Уолтон. Помнишь, любовь моя, эти первые вечера, когда мы играли во все эти игры и даже жульничали с картами (ты, по крайней мере, ни разу не попалась, шалунья!).25 сентября/7 октября 1894
Переучиваем лейтенантов
Переучиваем лейтенантов После дебюта по обучению летного состава меня переводят в третью эскадрилью заместителем. Командир эскадрильи – мой однокашник по училищу Коля Колпаков.Коля перевелся в наш полк из Кюрдамира. Он успел к тому времени выйти победителем
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
Типичные восстановители – это, как правило:
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители :
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
C 0 + 4H N +5 O3(конц) = C +4 O2 ↑ + 4 N +4 O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты, например:
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование ) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
Mn +7 + 1e = Mn +6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Е сли среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
KMnO4 + неМе (низшая с.о.) = неМе 0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме 0 = Ме (стабильная с.о.) + др. продукты
Схема восстановления хроматов/бихроматов
Соединения хрома VI окисляют:
Хромат/бихромат + неМе (отрицательная с.о.) = неМе 0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме 0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As +5 + другие продукты
Разложение нитратов
Например:
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония :
При нагревании нитрат аммония разлагается. При температуре до 270 о С образуется оксид азота (I) («веселящий газ») и вода:
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород :
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
Нитрат никеля (II) разлагается до нитрита при нагревании до 150 о С под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Взаимодействие металлов с серной кислотой
Например :
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием ;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Cu 0 + 2H2 S +6 O4(конц) = Cu +2 SO4 + S +4 O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S 2- (в зависимости от температуры, степени измельчения и активности металла).
Пероксид водорода
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например :