Что значит одинаковое число валентных электронов
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
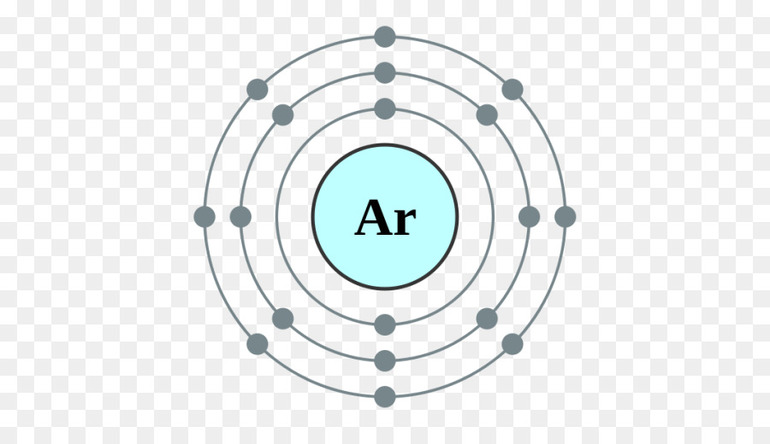
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Электроны и валентность
Международный союз теоретической и прикладной химии определил валентность как максимальное число одновалентных атомов (первоначально — водорода или хлора), которые могут объединяться с атомом или фрагментом рассматриваемого элемента.
Современная альтернативная трактовка звучит несколько иначе: валентность — это число атомов водорода, которые могут объединяться с элементом в бинарном гидриде, или удвоенное количество атомов кислорода, объединяющихся с элементом в его оксиде или оксидах. Это определение отличается от формулировки МСТПХ, поскольку большинство веществ имеет более чем одну валентность.
Модель ядерного атома Резерфорда (1911) показала, что внешнюю оболочку атома занимают заряженные частицы, это свидетельствует о том, что электроны ответственны за взаимодействие атомов и образование химических связей.
В 1916 году Гилберт Н. Льюис объяснил валентность и химическую связь с точки зрения тенденции атомов достигать стабильного октета из 8 электронов в валентной оболочке.
Согласно Льюису, ковалентная связь приводит к октетам при совместном использовании электронов, а ионная связь — при передаче электронов от одного атома к другому. Термин ковалентность приписывается Ирвингу Лэнгмюру. Префикс ко— означает «вместе», то есть атомы разделяют валентность. Поэтому определение валентности по формуле соединения стало возможным.
В 1930-х годах Линус Полинг предположил, что существуют также полярные ковалентные связи, которые являются промежуточными, а степень ионного характера зависит от разницы электроотрицательности двух связанных атомов.
Полинг также рассматривал гипервалентные молекулы, в которых элементы имеют кажущиеся валентности, например, в молекуле гексафторида серы (SF6). Учёный считал, что сера образует 6 истинных двух электронных связей с использованием sp 3 d 2 гибридных атомных орбиталей, которые объединяют одну s, три p и две d орбитали.
Для основных элементов в периодической таблице Менделеева валентность может варьироваться от 1 до 7. Многие вещества имеют общую валентность, связанную с их положением в таблице. Для описания ионов в зарядовых состояниях 1, 2, 3 и т. д. (соответственно) используются греческие/латинские цифровые префиксы (моно- / уни- / би- / три-).
Виды с одним зарядом являются одновалентными. Например, Cs + — одновалентный катион, тогда как Ca 2+ является двухвалентным, а Fe 3+ — трёхвалентным. Существуют также поливалентные катионы, которые не ограничены определённым количеством валентных связей.
В отличие от Cs и Ca, Fe может существовать в других зарядовых состояниях, особенно 2+ и 4+, и поэтому известен как многовалентный (поливалентный) ион.
Переходные металлы и металлы, как правило, многовалентны, но, к сожалению, не существует простой схемы, предсказывающей их валентность.
Определение количества
Можно определить количество электронов с помощью специального онлайн-калькулятора. Однако его нахождение под рукой не всегда возможно. Поэтому следующий вариант — обратиться к атомной конфигурации элемента и просто сосчитать число заряженных частиц в самой внешней оболочке атома. Однако это чрезвычайно утомительное занятие, так как, возможно, придётся пролистать много учебников, чтобы найти конфигурации, с которыми исследователь не знаком.
Количество ВЭ элемента и его валентность определить по таблице Менделеева проще всего. Нужно обратить внимание на вертикальный столбец, в котором указана классификация.
Исключением являются переходные металлы — 3−12 группы.
Цифра в порядковом номере группы показывает, сколько валентных электронов связано с нейтральным атомом вещества, указанного в этом конкретном столбце.
Пример в таблице:
| Группа | ВЭ |
|---|---|
| 1 (I) (щелочные металлы) | 1 |
| 2 (II) (щёлочноземельные металлы) | 2 |
| 3−12 (переходные металлы) | 3−12 |
| 13 (III) (борная группа) | 3 |
| 14 (IV) (углеродная) | 4 |
| 15 (V) (группа азота) | 5 |
| 16 (VI) (кислородная группа) | 6 |
| 17 (VII) (галогены) | 7 |
| 18 (VIII или 0) (благородные газы) | 8 |
Надо сказать, что периодическая таблица — это аккуратное расположение всех элементов, которые известны науке на данный момент.
Они располагаются слева направо в порядке возрастания их атомарных номеров или числа протонов (электронов), которые они содержат.
Все вещества в таблице Менделеева делятся на четыре категории:
Последние два — это внутренние переходные элементы, образующие мост в группах 2 и 13. Таблица содержит строки — периоды — и 18 столбцов, известных как группы. Есть ещё подтаблица, которая содержит 7 строк и 2 столбца с более редкими веществами.
Номер строки (периода) элемента показывает количество оболочек, окружающих его ядро.
Химические реакции
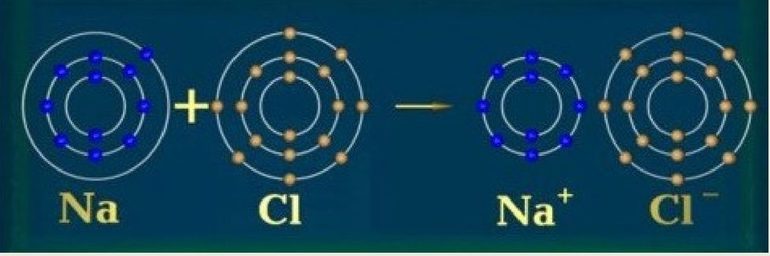
Вторая группа — щёлочноземельные металлы, например, магний, — менее реактивны. Чтобы получить положительный ион (Mg 2+ ), каждому их атому нужно отдать два ВЭ.
В любой группе (в столбце таблицы Менделеева) металлов реакционная способность становится больше, если двигаться от лёгкого вещества к более тяжёлому, то есть увеличивается с каждым нижним рядом таблицы. Происходит это просто потому, что у тяжёлых элементов больше оболочек. Их ВЭ приходится существовать в условиях более высоких главных квантовых чисел.
Они находятся дальше от атомного ядра и, следовательно, обладают более высокой потенциальной энергией, это означает, что связь между ними менее тесная.
Атом неметалла настроен привлекать дополнительные ВЭ, чтобы образовать полную валентную оболочку. Это может быть достигнуто одним из двух способов:
Наиболее реактивными видами неметаллических элементов являются галогены. К ним можно отнести хлор (Cl) или, например, фтор (F).
Если двигаться от лёгкого элемента к тяжёлому, в пределах каждой группы неметаллов их реакционная способность будет уменьшаться. Это потому, что ВЭ будут терять тесную связь, поскольку приобретают более высокую энергию. По факту, самый лёгкий элемент в группе 16 — кислород — наиболее реакционноспособный неметалл, после фтора, конечно.
В таких простых случаях, когда соблюдается правило октета, валентность атома равна количеству разделённых электронов, потерянных или полученных для того, чтобы сформировался стабильный октет. Однако есть также много молекул, для которых валентность менее чётко определена, но это скорее исключения.
Электронная конфигурация
Заряженные частицы, определяющие химическую реакцию атома, — это те, чьё среднее расстояние от ядра самое большое, то есть они обладают самой высокой энергией. Для элемента основной группы ВЭ определяются как те, что находятся в электронной оболочке с наибольшим главным квантовым числом n.
Однако переходные элементы имеют частично заполненные (n — 1) d энергетические уровни, к слову, довольно близкие по энергии к уровню ns. Поэтому, в отличие от веществ основной группы, ВЭ для переходного металла определяется как частица, которая находится вне ядра благородного газа.
Вне аргоноподобного ядра, возможно, есть семь валентных электронов (4s 2 3d 5 ), это вполне согласуется с тем фактом, что, например, степень окисления марганца может достигать +7 (в перманганатном ионе MnO — 4).
Чем правее вещество расположено в ряду переходных металлов, тем энергия его заряженной частицы в субоболочке ниже, и тем меньше валентных свойств у такого электрона.
Например, хотя обычно у атома никеля десятая валентность (4s 2 3d 8 ), его степень окисления никогда не превышает четырёх. Для цинка 3d-оболочка является полной и ведёт себя подобно электронам ядра.
Поскольку количество ВЭ, участвующих в химических реакциях фактически, предсказать сложно, концепция этой частицы несёт мало пользы для переходных металлов, если сравнивать с элементами из основной группы. Однако подсчёт электронов для понимания химии переходных металлов является альтернативным инструментом.
Электрическая проводимость
Ответственность за электрическую проводимость вещества в том числе лежит и на электронах. Вследствие чего элементы классифицируются следующим образом:
В твёрдом состоянии металлические элементы обычно имеют высокую электропроводность. Поскольку валентный электрон металла обладает небольшой энергией ионизации, находясь в твёрдом состоянии, он относительно свободно покидает атом, чтобы связываться с другими.
Когда электрон свободный, он может перемещаться под воздействием электрического поля, то есть создавать электрический ток, отвечая за электропроводность металла. Примером хороших проводников могут служить серебро, равно как и золото, алюминий и, конечно, медь.
Как изолятор действует неметаллический элемент, поскольку имеет низкую электропроводность. В таблице Менделеева такие вещества находятся справа. Их валентная оболочка заполнена наполовину (исключение составляет бор). Когда на атом воздействует некоторое электрическое поле, заряженная частица не может его легко покинуть, поэтому такой элемент может проводить слабый постоянный или переменный электрический ток. Например, сера и алмаз — одни из таких веществ.
Изолятором также может быть твёрдое соединение, которое содержит металлы, если для образования ионных связей используются ВЭ атомов металла. К примеру, натрий, хоть он и представляет собой мягкий металл, однако твёрдый хлорид натрия является изолятором.
Поскольку для образования ионной связи ВЭ натрия переносятся в хлор, электроны не имеют возможности легко перемещаться.
Полупроводники обладают промежуточной между металлами и неметаллами электрической проводимостью. Интересно, что при увеличении температуры у этих веществ улучшается проводимость. Германий и кремний можно отнести к типичным элементарным полупроводникам, каждый их атом имеет 4 ВЭ. Надо сказать, что лучше всего свойства полупроводников объясняются с помощью теории зон.
Таблица валентности химических элементов
Таблица валентности химических элементов.
Таблица валентности химических элементов:
Ниже приводится таблица валентности химических элементов с примерами соединений.
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Таблица валентности химических элементов:
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентные возможности атомов
Атомы химических элементов и их валентные возможности
В начале прошлого века научная общественность была потрясена открытием британского физика Э. Резерфорда, который в своем докладе «Рассеяние α- и β-лучей и строение атома» говорил об открытии атомного ядра.
Данное открытие в тандеме со знанием о электронах сместило главенствующую тогда теорию о валентности, заменив ее на теорию о химических связях.
Однако понятие о валентности не пропало из научного мира. Вклад в научное развитие этого термина внесли Э. Франкленд, Ф. А. Кекуле и А. М. Бутлеров.
Согласно проделанным открытиям, атомы химических элементов состоят из:
Свойства атомов химических элементов определяет количество электронов на их последнем (внешнем) электронном слое. Именно они участвуют в образовании химических связей разных типов. Такие электроны называются валентными.
Валентность — количество связей образованных атомом при участии его валентных электронов.
Для определения валентных возможностей атома необходимо рассмотреть распределение электронов на его энергетических уровнях.
Только атомы образовавшие химические связи могут характеризоваться понятием валентности.
Валентность обозначают римскими цифрами от I до VIII.
Число валентных электронов или число общих электронных пар определяет валентность.
Понятие валентности сопряжено со степенью окисления и часто совпадает с его значением.
Чем определяются, какие факторы влияют
Валентность атома определяется количеством валентных электронов:
Атомы могут иметь основное и возбужденное состояние, из-за чего большинство химических элементов имеют переменную валентность.
В основном состоянии валентность зависит от неспаренных электронов последнего (иногда и предпоследнего) энергетических уровней. Обычное состояние фиксируется в Периодической таблице Менделеева.
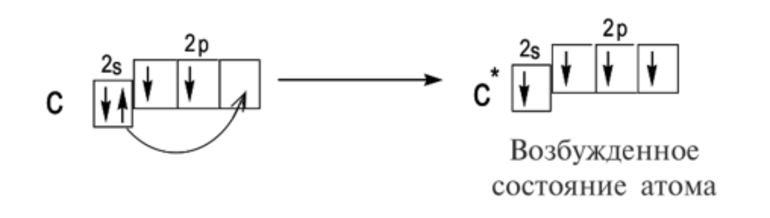
Например, валентность углерода в основном состоянии равна II из-за двух неспаренных электронов на 2p-орбитали.
Дополнительная энергия, которую может получать атом, приводит его в возбужденное состояние. В таком случае уже соединенные электроны могут распариваться и участвовать в образовании новых связей. Валентность повышается.
Валентность углерода в возбужденном состоянии может повышаться до четырех, так как в таком состоянии у него распариваются 2s-электроны.
В формуле возбужденное состояние атома обозначается звездочкой.
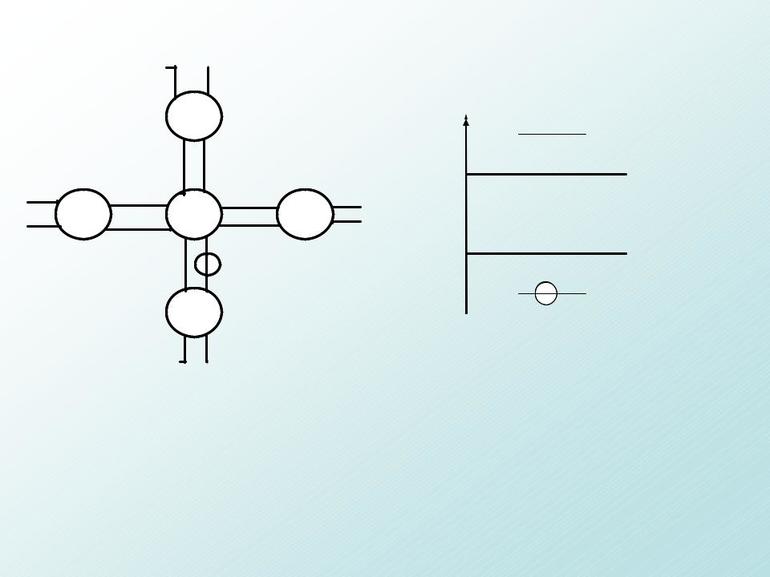
Определение валентности элемента по электронно-графическим формулам
Для определения количества электронов на энергетических уровнях необходимо полагаться на номер и место химического элемента в Периодической системе Д. И. Менделеева.
Определив количество электронов, необходимо распределить их по свободным орбиталям в порядке заполнения по шкале энергии:
В одной ячейке или на одной орбитали могут располагаться либо 1 электрон, либо 2 электрона с противоположными спинами — разными направлениями вращения.
Орбитали разных уровней могу размещать в своих свободных ячейках разное количество электронов:
По количеству электронов, оставшихся неспаренными в ячейках, можно узнать валентность атомов химических элементов. Электронные формулы обычно записываются не полностью, а в кратком варианте, указывая только крайние электронные уровни каждого слоя.
Можно сформулировать следующие закономерности электронного строения атома:
Селен, углерод, фосфор, сера, азот, хлор и другие примеры
Рассмотрим заполнение электронных уровней на примерах.
Углерод С обладает номером 6 в Периодической системе химических элементов Д. И. Менделеева, соответственно, он обладает 6 электронами.
Они полностью заполняют уровни 1s / 2s и частично уровень 2р. В обычном состоянии углерод обладает валентностью II. Свободная орбиталь 2р подуровня позволяет орбитали 2s распариваться. Тогда валентность углерода может изменяться на IV.
Азот N обладает номером 7 в ПСХЭ Менделеева и 7 электронами.
Они полностью занимают уровни 1s / 2s и частично 2р. В обычном состоянии азот обладает валентностью III. Перейти в возбужденное состояние путем распаривания 2s-электронов атом не способен, так как относится ко второму периоду, а на втором энергетическом уровне больше нет свободных подуровней и орбиталей, способных принять распарившиеся электроны. Максимальная валентность азота равна IV (за счет образования связи, не только по обменному, но и по донорно-акцепторному механизму), валентность V — не достигается.
Особенностью азота является несоответствие его валентности номеру группы ПС. Азот не обладает валентностью равной V, однако обладает соответствующей степенью окисления +5. НЕсоответствие значений валентностей и степеней окисления атомов азота в некоторых его соединениях является еще одной особенностью этого элемента.
Кислород О обладает номером 8 в ПСХЭ Менделеева и 8 электронами. Возбужденного состояния у кислорода так же нет.
Электроны полностью занимают уровни 1s / 2s и частично 2р. Валентность кислорода равна II — постоянная валентность.
Фтор F обладает номером 9 в ПСХЭ Менделеева и 9 электронами. Они полностью занимают уровни 1s / 2s и частично 2р. Фтор обладает только валентностью I, которая не меняется.
Алюминий Al обладает номером 13 в ПСХЭ Менделеева и 13 электронами. Они полностью занимают уровни 1s / 2s, 2p / 3s и частично уровень 3р. Несмотря на электронную конфигурацию основного (стационарного) состояния атома, валентность I практически не встречается. У алюминия постоянная валентность III (из этого следует что энергия перехода в возбужденное состояние для этого элемента не высока и атомы алюминия всегда пребывают именно в возбужденном состояние).
Фосфор P обладает номером 15 в ПСХЭ Менделеева и 15 электронами.
Они полностью заполняют уровни 1s / 2s, 2p / 3s и частично уровень 3р. В обычном состоянии фосфор обладает валентностью III. Распаривание 3s электронов создает возбужденное состояние, в котором пять валентных электронов занимают 5 ячеек, и валентность в таком случае поднимается до V.
Сера S занимает 16 место в ПСХЭ Менделеева и обладает 16 электронами.
Они полностью занимают 1s / 2s, 2p / 3s и частично 3р. В обычном состоянии сера обладает валентностью II. Распаренные электроны могут занимать ячейки подуровня 3d, валентность поднимается до IV и VI.
Хлор Cl обладает номером 17 в ПСХЭ Менделеева и 17 электронами.
Они полностью занимают уровни 1s / 2s, 2p / 3s и частично 3р. В обычном состоянии валентность хлора равна I. В возбужденном состоянии хлор может повышать свою валентность до III, V или VII. Формально данный ХЭ может обладать валентностью IV и VI.
Селен Se обладает номер 34 в ПСХЭ Менделеева, соответственно, он обладает 34 электронами.
Они полностью заполняют уровни 1s / 2s, 2p / 3s, 3p / 4s, 3d, отдав 30 электронов. Еще 4 заполняют орбиталь 4р — (1 ячейка занята полностью, еще 2 содержат по одному электрону). Валентность селена в обычном состоянии равна II.
Однако селен относится к элементам с переменной валентностью, поэтому также может обладать значением валентности IV и VI.
Элементы, имеющие несколько значений валентности
Значение валентности зависит от состояния атома — обычного или возбужденного.
Не все атомы химических элементов могут переходить в возбужденное состояние. По этому признаку они делятся на химические элементы с переменной и постоянной валентностью.
Постоянная валентность наблюдается у щелочных, щелочноземельных металлов, водорода, кислорода, фтора и алюминия.
Все остальные химические элементы обладают переменной валентностью, обусловленными существованием как возбужденных, так и обычных (стационарных) состояний.
Что такое степень окисления
Степень окисления — условная величина электрического заряда атома, входящего в состав химического соединения. Расчет значений этой величины основывается на предположении, что при образовании химической связи происходит полная передача электрона от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью. В результате таких представлений каждому атому можно приписать целочисленный электрический заряд. В неорганической химии степень окисления очень часто совпадает с валентностью.
Степень окисления зачастую не совпадает с реальным значением электрического заряда атома, (совпадение наблюдается только в случае ионных соединений). Она используется лишь для систематизации и классификации химических элементов. Степень окисления широко используется при составлении формул, международных названий элементов, объяснения их окислительно-восстановительных свойств.
СО обозначается арабскими цифрами (валентность римскими).
В чем отличие валентности и степени окисления
Валентность и степень окисления не являются равнозначными понятиями, хоть их числовое значение может совпадать.
Валентность используется для определения числа химических связей атома, причем как полярных, так и неполярных.
Степень окисления используется для выражения значения электрического заряда, сосредоточенного на атоме.