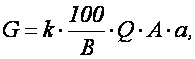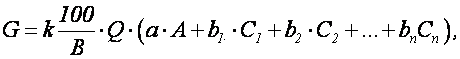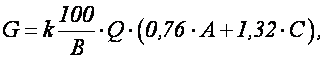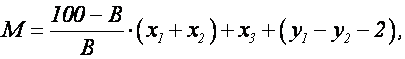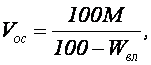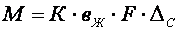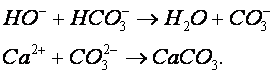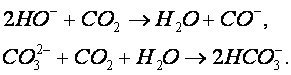Что значит нейтрализация раствора
Реакция нейтрализации в химии: объяснение, примеры, уравнения и решение
Содержание:
Реакция нейтрализации – это реакция между кислотой и основанием с формированием растворимой соли и воды.
Кислота + основание = соль + вода
Как правило, эти взаимодействия сопровождаются выделением тепла. Количество выделенной энергии — это тепловой эффект взаимодействия между соединениями. Реакция нейтрализации — это один из типов реакции обмена.
Характеристика нейтрализации
Реакцию нейтрализации можно записать сокращенным ионным уравнением:
Если поместить лакмусовую бумажку в пробирку с кислотой, то она становится красной. Если ее поместить в пробирку со щелочью, то она становится синей. При взаимодействии щелочи и кислоты лакмус приобретает фиолетовый оттенок, что указывает на нейтральную среду.
Если получившийся раствор нагреть, то вода испарится, а в колбе останутся кристаллы соли.
Примеры реакций нейтрализации
Реакции нейтрализации — это реакции ионного обмена. Необратимые реакции характерны для реакций сильной кислоты и сильного основания.
Полное ионное уравнение
Сокращенное ионное уравнение
Обратимые реакции наблюдаются при взаимодействии сильного основания и слабой кислоты.
Полное ионное уравнение
Сокращенное ионное уравнение
Также обратимые реакции характерны для взаимодействий слабого основания и сильной кислоты.
Полное ионное уравнение
Сокращенное ионное уравнение
Не характерно для данной реакции.
Задачи на реакции нейтрализации
Задача. Сколько мл гидроксида натрия NaOH необходимо для нейтрализации 0,1 моль серной кислоты H2SO4, при том что плотность гидроксида натрия NaOH равна 0,968 г/мл.
Дано:
Решение:
Ответ: V(NaOH)=8,264 мл
Найти: V(NaOH)-?
Применение реакций нейтрализации
Реакции нейтрализации активно используются в титровании. Их используют при определении уровня кислотности желудочного сока. Если в лаборатории проливается щелочь, то ее нейтрализуют и убирают. Таким образом, реакции нейтрализации активно используются человеком.
Общие принципы
Сущность реакции нейтрализации заключается в том, что кислота и основание вступают во взаимодействие. Они обмениваются активными компонентами. Происходит нейтрализация обоих составляющих. В итоге получается вода и соль, имеющие нейтральную реакцию среды.
Общий принцип взаимодействия выглядит следующим образом: кислота соединяется со щёлочью, обменивается активными компонентами, в результате чего получается нейтральная соль и вода.
Наиболее простым примером реакции нейтрализации может стать взаимодействие гидроксида натрия с соляной кислотой. Формула представлена так:
NaOH + HCl → NaCl + H2O.
Перед соединением этих веществ можно проверить их реакцию с помощью лакмусовой бумаги:
Если получившийся раствор нагреть, вода постепенно испарится. В колбе останется осадок — поваренная соль (хлорид натрия).
Чтобы лучше понять, что такое реакция нейтрализации в химии, важно помнить, что 2 сложных вещества обмениваются между собой частями. В итоге получается 2 новых сложных компонента. Таким образом, нейтрализация — это частный случай большой группы реакций обмена.
Некоторые основания не растворяются в воде, но хорошо растворяются в кислотах. В результате взаимодействия тоже образуется вода и соль. Примером может быть реакция между нерастворимым гидроксидом меди и серной кислотой. В итоге получается медный купорос и вода.
Виды реакции
Процесс химической нейтрализации может происходить между веществами с разной активностью: сильной кислотой и таким же основанием или между слабой кислотой и сильной щёлочью. В химии выделяют 2 типа реакции:
Реакции нейтрализации относятся к разряду экзотермичных. При взаимодействии выделяется много энергии в виде тепла. Количество выделенной энергии — относительный показатель, который получил название теплового эффекта химической реакции.
Мера энергии, накопленной веществом при образовании, называется энтальпией. В экзотермических реакциях значение энтальпии всегда бывает отрицательным.
Названия солей
Все международные химические названия солей, полученных в результате нейтрализации, строятся по единому принципу и состоят из двух слов. Первое слово — это наименование кислотного остатка. Оно является производным от латинского названия кислоты:
Второе слово в названии соли — это наименование металла. У некоторых элементов периодической таблицы валентность изменяется. В этом случае она указывается в скобках.
В качестве примера можно привести названия солей:
Это утверждение верно и для обратной ситуации — по названию соли можно определить её химическую формулу. Вначале записывается символ, которым металл обозначается в периодической таблице. Затем добавляется формула кислотного остатка.
Следующий шаг — определение валентности обеих частей. Теперь нужно найти для них наименьшее общее кратное и разделить его на валентность каждой части соли. Значит, в результате получается количество атомов металла в формуле и количество кислотных остатков.
Кислотный остаток может иметь сложную структуру и содержать в себе несколько разных атомов (азотная, серная, фосфорная кислоты и пр.). При составлении формулы соли кислотный остаток вписывается в скобки. За ними цифровым индексом обозначается количество остатков.
Титрование и химический эквивалент
Реакция нейтрализации связана с процедурой титрования. В химии так принято называть определение количества щёлочи или кислоты в растворе. Для этого берётся реагент с заданной заранее молярной концентрацией. Вычисляется, сколько его нужно для осаждения искомого вещества. При титровании используется понятие химической эквивалентности:
Если реагируют одинаковые химические эквиваленты, нейтрализация называется полной. В этом случае в растворе не останется кислоты или щёлочи, не вступившей в реакцию. Масса эквивалента кислоты или основания в граммах называется грамм-эквивалентом.
Все кислоты, которые выделяют из 1 молекулы 1 ион водорода, подчиняются следующей закономерности: их химический эквивалент равняется 1 молю вещества. Молекулярная масса таких соединений равна 1 грамм-эквиваленту.
Если вещество выделяет из 1 молекулы 2 иона водорода, его грамм-эквивалент равен половине молекулярной массы, а 1 моль соответствует 2 химическим эквивалентам.
С этим химическим процессом связано ещё одно понятие — нормальность или нормальная концентрация вещества. Этот фактор отражает, сколько эквивалентов содержит 1 литр раствора.
Применение на практике
Методы нейтрализации положены в основу титриметрического анализа. Титрование используется во многих сферах:
Нередко эта химическая реакция используется в быту. При проливе уксусной или другой кислоты на кожу может возникнуть ожог. В качестве первой помощи необходимо тщательно промыть место чистой водой, после чего обработать содовым раствором. Той же тактики придерживаются при ожоге едкой щёлочью. В качестве нейтрализатора используется лимонная или уксусная кислота в слабом разведении.
Реакция нейтрализации – примеры, типы и применение
Взаимодействие кислоты и основания с образованием соли и воды называется реакцией нейтрализации. Обычно подобные реакции протекают с выделением тепла.
Общее описание
Суть нейтрализации состоит в том, что кислота и основание, обмениваясь активными частями, нейтрализуют друг друга. В результате образуется новое вещество (соль) и нейтральная среда (вода).
Простым и наглядным примером реакции нейтрализации является взаимодействие соляной кислоты и гидроксида натрия:
HCl + NaOH → NaCl + H2O.
Если опустить лакмусовую бумажку в раствор соляной кислоты и гидроксида натрия, то она окрасится в фиолетовый цвет, т.е. покажет нейтральную реакцию (красный – кислая среда, синий – щелочная среда).
Раствор двух активных соединений превратился в воду за счёт обмена натрием и хлором, поэтому ионное уравнение данной реакции выглядит следующим образом:
После нагревания получившегося раствора вода испарится, а в пробирке останется поваренная соль – NaCl.
Рис. 1. Образование соли после выпаривания.
В подобных реакциях вода – обязательный продукт.
Примеры
Реакция нейтрализации может происходить между сильными и слабыми кислотами и щелочами. Рассмотрим два типа реакций:
Примером первого вида реакций является взаимодействие сильной кислоты с сильным основанием:
Обратимые реакции протекают при нейтрализации слабой кислоты сильным основанием, а также слабого основания слабой кислотой:
Слабые нерастворимые или слаборастворимые основания (Fe(OH)3, Fe(OH)2, Mg(OH)2, Zn(OH)2) также нейтрализуются сильной кислотой. Например, гидроокись меди не растворяется в воде, но при взаимодействии с азотной кислотой образует соль (нитрат меди) и воду:
Cu(OH)2 + 2HNO3 ↔ Cu(NO3)2 + 2H2O.
Рис. 2. Взаимодействие гидроокиси меди с кислотой.
Реакции нейтрализации экзотермичные, они протекают с выделением тепла.
Использование
Реакции нейтрализации – основа титриметрического анализа или титрования. Это метод количественного анализа концентрации веществ. Метод используется в медицине, например, для определения кислотности желудочного сока, а также в фармакологии.
Кроме того, важно практическое применение нейтрализации в лаборатории: при проливе кислоты её можно нейтрализовать щёлочью.
Что мы узнали?
Реакция, при которой кислота и основание образуют соль и воду, называется нейтрализацией. Эта реакция возможна между любыми кислотами и основаниями: сильной кислотой и сильной щёлочью, слабой кислотой и слабым основанием, сильным основанием и слабой кислотой, слабым основанием и сильной кислотой. Реакция протекает с выделением тепла. Нейтрализация применяется в медицине и фармакологии.
Глава 1. Основы очистки сточных вод
6. Химические методы очистки сточных вод
6.1. Нейтрализация
Сточные воды, содержащие минеральные кислоты или щелочи, перед сбросом их в водоемы или перед использованием в технологических процессах нейтрализуют. Практически нейтральными считаются воды, имеющие рН = 6,5-8,5. Следовательно, подвергать нейтрализации следует сточные воды с рН менее 6,5 и более 8,5, при этом необходимо учитывать нейтрализующую способность водоемов, а также щелочной резерв городских сточных вод. Из условий сброса производственных сточных вод в водоем или городскую канализацию, следует, что большую опасность представляют кислые стоки, которые встречаются к тому же значительно чаще, чем щелочные (количество сточных вод с рН > 8,5 невелико). В большинстве кислых сточных вод содержатся соли тяжелых металлов, которые необходимо выделить из этих вод.
Реакция нейтрализации – это химическая реакция между веществами, имеющими свойства кислоты и основания, которая приводит к потере характерных свойств обоих соединении. Наиболее типичная реакция нейтрализации в водных растворах происходит между гидратированными ионами водорода и ионами гидроксида, содержащимися соответственно в сильных кислотах и основаниях: Н + +ОН – = Н2О. В результате концентрация каждого из этих ионов становится равной той, которая свойственна самой воде (около 10 –7 ), т.е. активная реакция водной среды приближается к рН = 7.
Нейтрализацию можно проводить различным путем: смешением кислых и щелочных сточных вод, добавлением реагентов, фильтрованием кислых вод через нейтрализующие материалы, абсорбцией кислых газов щелочными водами или абсорбцией аммиака кислыми водами. Выбор метода нейтрализации зависит от объема и концентрации сточных вод от режима их поступления, наличия и стоимости реагентов. В процессе нейтрализации могут образовываться осадки, количество которых зависит от концентрации и состава сточных вод, а также от вида и расхода используемых реагентов. Применяют следующие способы нейтрализации: взаимная нейтрализация кислых и щелочных сточных вод (нейтрализация смешением); нейтрализация путем добавления реагентов, фильтрование через нейтрализующие материалы; нейтрализация кислыми дымовыми газами.
Выбор способа нейтрализации зависит от многих факторов, например, вида и концентрации кислот, загрязняющих производственные сточные воды; расхода и режима поступления отработанных вод на нейтрализацию; наличия реагентов; местных условий и др.
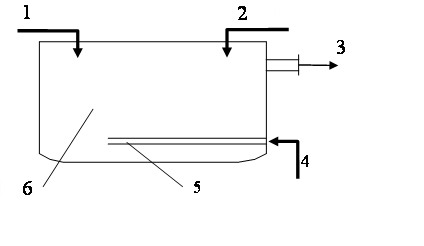
Нейтрализация смешением. Этот метод применяют, если на одном предприятии или на соседних предприятиях имеются кислые и щелочные воды, не загрязненные другими компонентами. Кислые и щелочные воды смешивают в емкости с мешалкой и без мешалки. В последнем случае перемешивание ведут воздухом (рис. 1.47) при его скорости в линии подачи 20-40 м/с.
Рис. 1.47. Нейтрализатор смешения:
1 – кислые сточные воды; 2 – щелочные сточные воды; 3 – нейтрализованная сточная вода; 4 – воздух;
5 – распределитель воздуха;
При переменной концентрации сточных вод в схеме предусматривают установку усреднителя или обеспечивают автоматическое регулирование подачи в камеру смешения. Расчет соотношения сточных вод, направляемых в камеру смешения, проводят по стехиометрическим уравнениям.
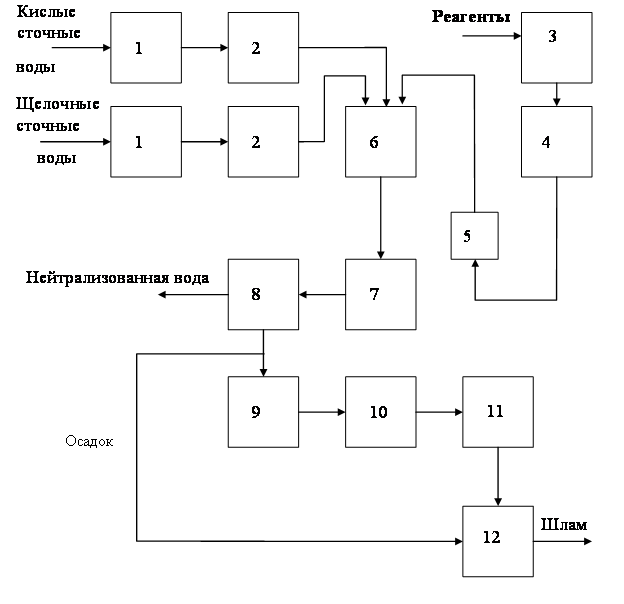
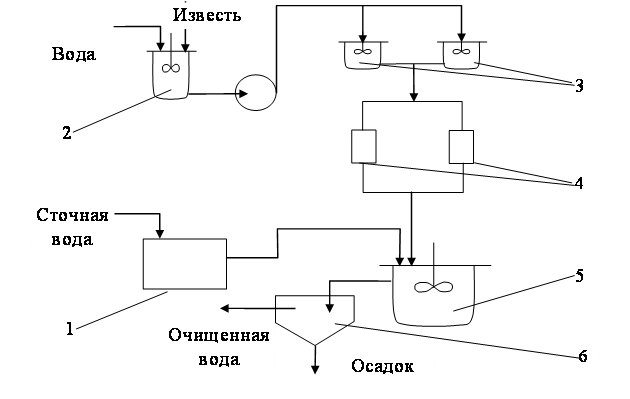
При избытке кислых или щелочных сточных вод добавляют соответствующие реагенты. Принципиальная схема водно-реагентной нейтрализации приведена на рис. 1.48. Нейтрализованную воду используют в производстве, а осадок обезвоживают на шламовых площадках или вакуум-фильтрах.
Рис. 1.48. Схема станции реагентной нейтрализации воды:
1 – песколовки; 2 – усреднители; 3 – емкость для реагентов; 4 – растворный бак; 5 – дозатор; 6 – смеситель; 7 – нейтрализатор; 8 – отстойник; 9 – осадкоуплотнитель; 10 – вакуум-фильтр; 11 – накопитель обезвоженных осадков; 12 – шламовая площадка
Нейтрализация путем добавления реагентов. Если на промышленном предприятии имеются только кислые или щелочные воды или невозможно обеспечить их взаимную нейтрализацию применяется реагентный метод нейтрализации. Этот метод наиболее широко используется для нейтрализации кислых сточных вод. Выбор реагента зависит от вида кислот, их концентрации, растворимости солей, образующихся в результате химической реакции.
Для нейтрализации минеральных кислот применяется любой щелочной реагент, чаще всего известь-пушонка, известковое молоко, карбонаты кальция и магния в виде суспензии. Эти реагенты сравнительно дешевы и общедоступны, но имеют ряд недостатков: обязательно устройство усреднителей перед нейтрализационной установкой; затруднительно регулирование дозы реагента по рН нейтрализованной водой; сложное реагентное хозяйство.
Скорость реакции между раствором кислоты и твердыми частицами суспензии относительно невелика и зависит от размеров частицы и растворимости образующегося в результате реакции нейтрализации соединения. Поэтому окончательная активная реакция устанавливается не сразу, а по истечении некоторого времени – 10-15 мин. Сказанное выше относится к сточным водам, содержащим сильные кислоты (H2SO4, H2SO4), кальциевые соли которых труднорастворимы в воде.
При нейтрализации сточных вод, содержащих серную кислоту (H2SO4), реакция в зависимости от применяемого реагента протекает по уравнениям:
Образующийся в результате нейтрализации сульфат кальция (гипс) кристаллизуется из разбавленных растворов в виде CaSO4·2H2O. Растворимость этой соли при температуре 0-40 0 С колеблется от 1,76 до 2,11 г/л.
При более высокой концентрации сульфат кальция выпадает в осадок, поэтому при нейтрализации сильных кислот, кальциевые соли которых труднорастворимы в воде, необходимо устраивать отстойники-шламонакопители. Существенным недостатком метода нейтрализации серной кислоты известью является образование пресыщенного раствора гипса (коэффициент пресыщения может достигать 4-6), выделение которого из сточной воды может продолжаться несколько суток, что приводит к зарастанию трубопроводов и аппаратуры. Присутствие в сточных водах многих химических производств высокомолекулярных органических соединений усиливает устойчивость пресыщенных растворов гипса, поскольку эти соединения сорбируются на гранях кристаллов сульфата кальция и препятствуют их дальнейшему росту.
Для уменьшения коэффициента пресыщения используется метод рециркуляции образующегося в результате нейтрализации осадка сульфата кальция. Концентрация ионов кальция в сточной воде уменьшается при увеличении дозы рециркулирующего осадка: продолжительность перемешивания этой воды должна быть не менее 20-30 мин. Для уменьшения зарастания трубопроводов, по которым транспортируются нейтрализованные известью сернокислотные стоки, применяют методы промывки, увеличивают скорость транспортирования, а также заменяют металлические трубопроводы на пластмассовые.
Поскольку в кислых и щелочных сточных водах практически всегда присутствуют ионы тяжелых металлов, то дозу реагентов следует определять с учетом выделений в осадок тяжелых металлов.
Количество реагента, необходимого для нейтрализации сточных вод определяется по формуле
где k – коэффициент запаса расхода реагента по сравнению с теоретическим k = 1,1 – для известкового молока, k = 1,5 – для известкового теста и сухой извести; В – количество активной части в товарном продукте, %; Q – количество сточных вод подлежащих нейтрализации, м 3 ; а – расход реагента для нейтрализации (табл. 1.7), г/кг
Расход реагентов для нейтрализации 100 % кислот и щелочей
При нейтрализации кислых и щелочных сточных вод содержащих соли тяжелых металлов, количество реагента будет определяться по формуле
где С1, С2,…,Сn – концентрации металлов в сточных водах, кг/м; b1, b2,…,bn, – концентрации реагентов, требуемых для перевода металла из растворенного состояния в осадок (табл. 1.8), кг/кг.
Расход реагентов, требуемых для удаления металлов
Например, при нейтрализации гашеной известью сточных вод, поступающих после травления черных металлов серной кислотой происходят следующие реакции:
На основании приведенных выше реакций или данных в табл. 1.7 и 1.8, а также по содержанию серной кислоты и железа в отработанных травильных растворах можно определить количество гашеной извести, необходимой для нейтрализации кислых сточных вод и осаждения железа
Количество сухого вещества, которое образуется при нейтрализации 1м 3 сточной воды, содержащей свободную серную кислоту и соли тяжелых металлов, определяется по формуле
где М – масса сухого вещества, кг; В – содержание активного вещества в используемой извести, %; х1, х2 – количество активного вещества, необходимое соотвественно для осаждения металла и для нейтрализациии свободной серной кислоты, кг; х3 – количество образующихся гидроксидов металлов, кг; у1, у2 – количество сульфата кальция, образующиеся соответственно при осаждении металла и при нейтрализации свободной серной кислоты, кг.
Если значение третьего члена в приведенной формуле отрицательно, то он не учитывается.
Объем осадка, образующегося при нейтрализации сточной воды можно найти по уравнению
Для нейтрализации кислых вод могут быть использованы: NaOH, КОН, Na2CO3. NH4OH (аммиачная вода), СаСО3. доломит (СаСО3. MgСО3 ) цемент. Однако наиболее дешевым реагентом является гидроксид кальция (известковое молоко) с содержанием активной извести Са(ОН)2 5-10 %. Соду и гидроксид натрия следует использовать, если они являются отходами производства. Иногда для нейтрализации применяют различные отходы производства. Например, шлаки сталеплавильного, феррохромового и доменного производств используют для нейтрализации вод, содержащих серную кислоту.
Реагенты выбирают в зависимости от состава и концентрации кислой сточной воды. При этом учитывают, будет ли в процессе образовываться осадок или нет. Различают три вида кислотосодержащих сточных вод: 1) воды, содержащие слабые кислоты (Н2СО3, СН3СООН); 2) воды, содержащие сильные кислоты (НСl, HNO3). Для их нейтрализации может быть использован любой названный выше реагент. Соли этих кислот хорошо растворимы в воде; 3) воды, содержащие серную и сернистую кислоты. Кальциевые соли этих кислот плохо растворимы в воде и выпадают в осадок.
Известь для нейтрализации вводят в сточную воду в виде гидроксида кальция (известкового молока; «мокрое» дозирование) или в виде сухого порошка («сухое» дозирование). Схема установки для нейтрализации кислых вод известковым молоком показана на рис. 1.49.
Рис. 1.49. Схема установки нейтрализации кислых вод гидроксидом кальция:
1 – усреднитель; 2 – аппарат для гашения; 3 – растворные баки; 4 – дозаторы;
5 – нейтрализатор; 6 – отстойник
Для гашения извести используют шаровые мельницы мокрого помола, в которых одновременно происходят тонкое измельчение и гашение. Для смешения сточных вод с известковым молоком применяют гидравлические смесители различных типов: дырчатые, перегородчатые, вихревые, с механическими мешалками или барботажные с расходом воздуха 5-10 м 3 /ч на 1 м 2 свободной поверхности.
При нейтрализации сточных вод, содержащих серную кислоту, известковым молоком в осадок выпадает гипс CaSO4·2H:2O. Растворимость гипса мало меняется с температурой. При перемещении таких растворов происходит отложение гипса на стенках трубопроводов и их забивка. Для устранения забивки трубопровода необходимо промывать их чистой водой или добавлять в сточные воды специальные умягчители, например гексаметафосфат. Увеличение скорости движения нейтрализованных вод способствует уменьшению отложений гипса на стенках трубопровода.
Для нейтрализации щелочных сточных вод используют различные кислоты или кислые газы. Метод реагентной нейтрализации кислых и щелочных сточных вод широко используется на предприятиях химической промышленности.
Нейтрализация кислых вод фильтрованием через нейтрализующие материалы. В этом случае для нейтрализации кислых вод проводят фильтрование их через слой магнезита, доломита, известняка, мела, мрамора, твердых отходов (шлак, зола) и др. Процесс ведут в фильтрах-нейтрализаторах, которые могут быть горизонтальными или вертикальными крупность фракций материала загрузки 3-8 мм. Для вертикальных фильтров используют куски известняка или доломита размером 30-80 мм. При высоте слоя материала 0,85-1,2 м скорость должна быть не более 5 м/с и зависит от вида загрузочного материала, а продолжительность контакта не менее 10 мин. У горизонтальных фильтров скорость течения сточных вод 1-3 м/с. Нейтрализация соляно- и азотнокислых, а также сернокислых сточных вод при концентрации серной кислоты не более 1,5 г/л происходит на непрерывно действующих фильтрах.
Процесс нейтрализации может быть проведен в реакторах с мешалкой, в распылительных, пленочных и тарельчатых колоннах.
Дымовые газы вентилятором подают в кольцевое пространство вокруг вала мешалки и распределяют мешалкой в виде пузырьков и струй в сточной воде, поступающей внутрь реактора. Благодаря большой поверхности контакта между водой и газами происходит быстрая нейтрализация сточной воды. Присутствие в газах SO2 способствует нейтрализации щелочных сточных вод.
При проведении процесса в тарельчатых колоннах степень нейтрализации увеличивается с ростом скорости газа и уменьшением плотности орошения.
Количество кислого газа, необходимого для нейтрализации, может быть определено по уравнению массоотдачи
где М – количество кислого газа, необходимого для нейтрализации; К – фактор ускорения; вЖ – коэффициент массоотдачи в жидкой фазе; F – поверхность контакта фаз; ∆С – движущая сила процесса.
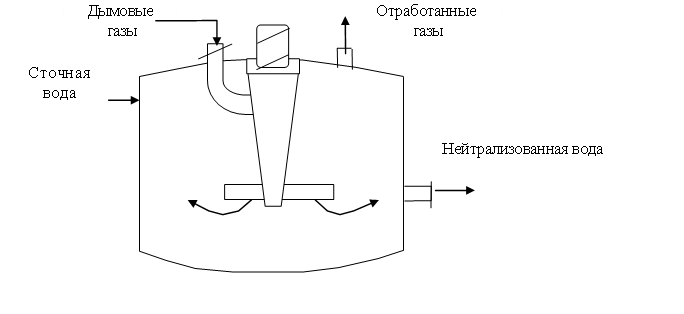
Нейтрализация щелочных вод дымовыми газами использована в ряде производств, в том числе и в асбестоцементном производстве. Сточные воды этих производств имеют рН = 12-13. Щелочность воды обусловлена постоянным выщелачиванием в нее гидроксида кальция. Нейтрализацию проводили диоксидом углерода дымовых газов (5-6 % СО2) в тарельчатом абсорбере.
Особенностью нейтрализации дымовыми газами сточных вод асбестоцементного предприятия является образование карбоната кальция, который может находиться в состоянии пересыщения и отлагается на внутренней поверхности оборудования. Для предотвращения образования в абсорбере карбонатных отложений процесс нейтрализации следует проводить по циркуляционной схеме (рис. 1.50).
Сточная вода из усреднителя должна поступать в смеситель, где предварительно нейтрализуется частью воды, выходящей из абсорбера.
В смесителе протекают следующие реакции:
Рис. 1.50. Нейтрализатор дымовых вод щелочными газами
Образующийся осадок карбоната кальция осаждается в циркуляционной емкости. Предварительную нейтрализацию сточной воды проводят с целью получения на входе в абсорбер смеси с таким водородным показателем, при котором смесь при окончательной нейтрализации в абсорбере дымовыми газами не образует карбонатных отложений. При этом в абсорбере протекают следующие реакции:
Отношение объемных расходов циркулирующей и сточной воды, при котором образуется смесь, невыделяющая карбонатных отложений, зависит от состава сточной воды и составляет от 2,5 до 4.
Для нейтрализации применяют абсорберы с крупнодырчатыми провальными тарелками с большим свободным сечением. Например, тарелки со свободным сечением более 30 % и отверстиями размером 20 × 50 мм.
Нейтрализация щелочных вод дымовыми газами является примером ресурсосберегающей технологии, позволяющей исключить использование кислот, создать бессточную схему водопотребления (рис. 1.51) При этом ликвидируется сброс сточных вод, сокращается потребление свежей воды, экономится тепловая энергия на подогрев свежей воды, а также очищаются дымовые газы от кислых компонентов (СО2, SO2 и др.) и пыли.
Рис. 1.51. Бессточная схема водопотребления асбестоцементного завода:
1 – фильтр; 2, 5 – отстойники; 3 – усреднитель; 4 – смеситель; 6 – колонна;