Что значит неорганические кислоты
Неорганические кислоты

Всего получено оценок: 243.
Всего получено оценок: 243.
Сложные вещества, состоящие из атомов водорода и кислотного остатка, называются минеральными или неорганическими кислотами. Кислотным остатком являются оксиды и неметаллы, соединённые с водородом. Главное свойство кислот – способность образовывать соли.
Классификация
Основная формула минеральных кислот – HnAc, где Ac – кислотный остаток. В зависимости от состава кислотного остатка выделяют два типа кислот:
Основной список неорганических кислот в соответствии с типом представлен в таблице.
Название
Формула
Кремниевые – метакремниевая и ортокремниевая
Кроме того, в соответствии со свойствами кислоты классифицируются по следующим признакам:
Получение
Основные методы получения кислот представлены в таблице.
Метод
Описание
Примеры
Взаимодействие простых веществ
Образование бескислородных кислот
Взаимодействие оксидов с водой
Образование кислородных кислот
Взаимодействие солей с растворами кислот
Получение слабых кислот
Под действием электричества водные растворы солей образуют сильные кислоты
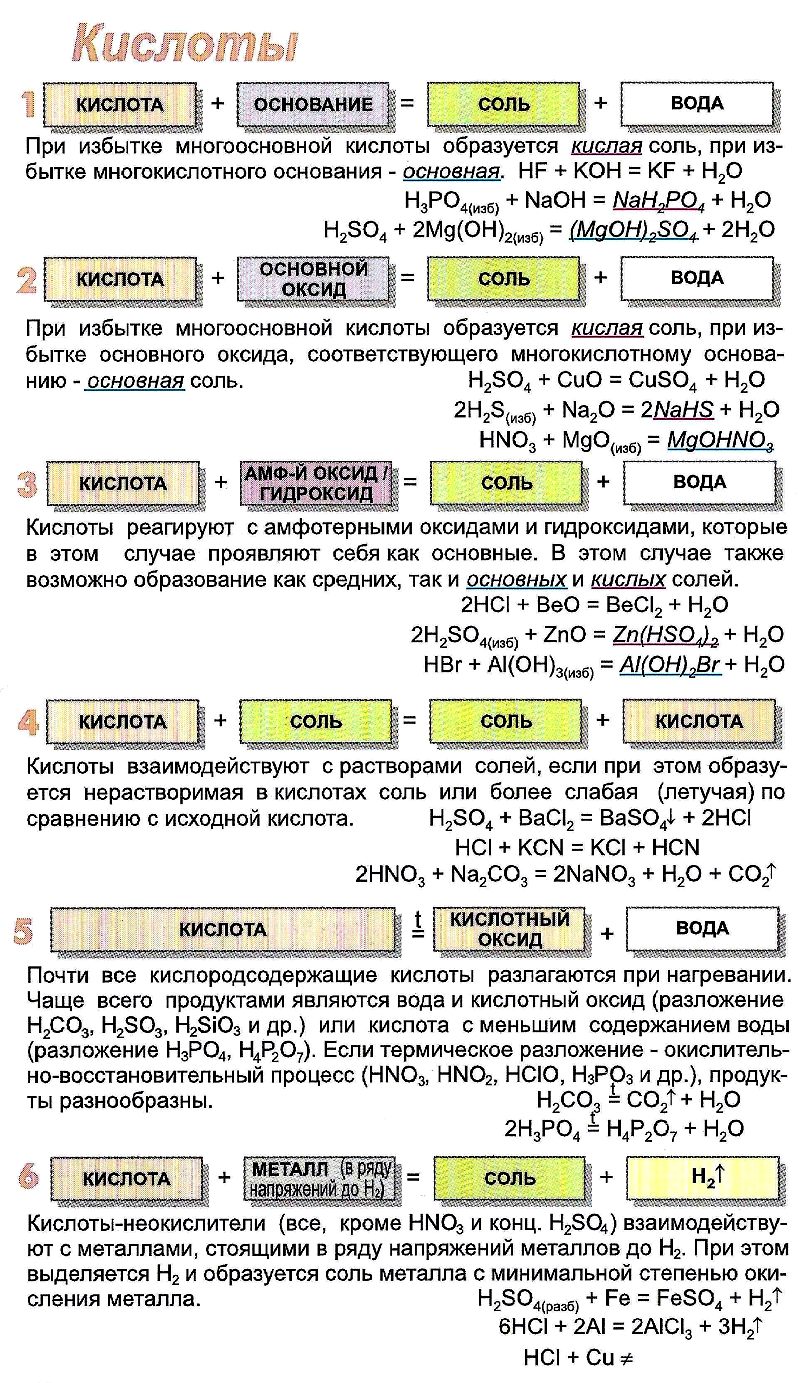
Свойства
Большинство кислот – жидкости с кислым вкусом. Вольфрамовая, хромовая, борная и несколько других кислот находятся в твёрдом состоянии при нормальных условиях. Некоторые кислоты (Н2СО3, H2SO3, HClO) существуют только в виде водного раствора и относятся к слабым кислотам.

Кислоты – активные вещества, реагирующие:
Все реакции сопровождаются образованием солей.
Возможна качественная реакция с изменением цвета индикатора:
Химические свойства минеральных кислот определяются способностью диссоциироваться в воде с образованием катионов водорода и анионов водородных остатков. Кислоты, реагирующие с водой необратимо (диссоциируются полностью) называются сильными. К ним относятся хлорная, азотная, серная и хлороводородная.
Что мы узнали?
Неорганические кислоты образованы водородом и кислотным остатком, которым являются атомы неметалла или оксид. В зависимости от природы кислотного остатка кислоты классифицируются на бескислородные и кислородсодержащие. Все кислоты имеют кислый вкус и способны диссоциироваться в водной среде (распадаться на катионы и анионы). Кислоты получают из простых веществ, оксидов, солей. При взаимодействии с металлами, оксидами, основаниями, солями кислоты образуют соли.
Что значит неорганические кислоты
Вспомним определение кислот в свете атомно-молекулярного учения. Кислоты — это сложные вещества, состоящие из атомов водорода, способного замещаться на металл, и кислотного остатка.
Почему в определении есть уточнение: «способного замещаться на металл»? Зная состав органических кислот, нетрудно объяснить это уточнение. Например, уксусная кислота содержит только один такой атом, хотя в её составе четыре атома водорода:
Mg + 2СН3СООН –> (CH3COO)2Mg + H2↑
Mg + 2CH3COOH = 2СН3СОO – + Mg 2+ + H2↑
Дадим определение кислотам в свете теории электролитической диссоциации. Кислоты — это электролиты, которые диссоциируют с образованием катионов водорода и анионов кислотного остатка.
Газообразные аммиак и хлороводород взаимодействуют друг с другом с образованием твёрдых микроскопических частиц хлорида аммония, воспринимаемых наблюдателем как частички дыма: NH3 + НСl = NH4Cl
Этот эксперимент плохо объясняется с точки зрения теории электролитической диссоциации. Аналогичное явление наблюдается и при взаимодействии аммиака с газообразным метиламином с образованием хлорида метиламмония: CH3NH2 + НСl —> [CH3NH3]Cl
Мы подошли к рассмотрению кислот в свете протонной теории. Она получила такое название, поскольку, когда атом водорода теряет свой единственный электрон и превращается в катион водорода, остаётся ядро, состоящее из протона. Дадим определение кислотам с точки зрения протонной теории. Кислоты — это доноры катионов водорода.
Вспомним донорно-акцепторный механизм образования ковалентной связи при формировании катиона аммония:
Катионы водорода обусловливают изменение окраски индикаторов — фиолетового лакмуса и метилового оранжевого на красный, а также общие химические свойства кислот.
Химические свойства кислот.
Например, нитрат-анион NO3 – обладает сильными окислительными свойствами. Поэтому азотная кислота, несмотря на присутствие в растворе катионов водорода, совсем по-другому реагирует с металлами. Независимо от положения металла в электрохимическом ряду напряжений водород в таких реакциях не выделяется. Продуктами восстановления азотной кислоты могут быть оксиды азота, азот и даже аммиак (соли аммония):
Сu + 4НNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2Н2O
3Сu + 8HNO3(paзб.) = 3Cu(NO3)2 + 2NO↑ + 4Н2O
Взаимодействие концентрированной серной кислоты с металлами протекает с участием сульфат-аниона, и, как в случае с азотной кислотой, водород в таких реакциях не образуется:
Сu + 2Н2SO4(конц.) = CuSO4 + SO2↑ + 2Н2O
Окислительные свойства проявляют и органические кислоты. Например, муравьиная кислота, будучи веществом с двойственной природой — альдегидокислотой, даёт реакцию серебряного зеркала:
НСООН + Ag2O —> СO2 + Н2O + 2Ag↓
Дополнительные материалы (таблицы )
Конспект урока по химии «Неорганические и органические кислоты». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Неорганические кислоты
Неоргани́ческие (минера́льные) кисло́ты — неорганические вещества, обладающие комплексом физико-химических свойств, которые присущи кислотам. Вещества кислотной природы известны для большинства химических элементов за исключением щелочных и щёлочноземельных металлов.
Содержание
Свойства и классификация неорганических кислот
Формы существования и агрегатное состояние
Большинство неорганических кислот при обычных условиях существуют в жидком состоянии, некоторые – в твёрдом состоянии (ортофосфорная, борная, вольфрамовая, поликремниевые (гидраты SiO2) и др.). Кислотами также являются водные растворы некоторых газообразных соединений (галогеноводородов, сероводорода H2S, диоксида азота NO2, диоксида углерода CO2 и др.). Некоторые кислоты (например, угольную Н2СО3, сернистую Н2SO3, хлорноватистую HClO и др.) невозможно выделить в виде индивидуальных соединений, они существуют только в растворе.
Атомы водорода в кислородсодержащих кислотах чаще всего связаны с кислородом полярной ковалентной связью. Известны кислоты с несколькими (чаще двумя) таутомерными или изомерными формами, которые различаются положением атома водорода:
Отдельные классы неорганических кислот образуют соединения, в которых атомы кислотообразующего элемента образуют молекулярные гомо- и гетерогенные цепные структуры. Изополикислоты — это кислоты, в которых атомы кислотообразующего элемента связаны через атом кислорода (кислородный мостик). Примерами выступают полисерные H2S2O7 и H2S3O10 и полихромовые кислоты H2Cr2O7 и H2Cr3O10. Кислоты с несколькими атомами разных кислотообразующих элементов, соединенных через атом кислорода, называются гетерополикислотами. Существуют кислоты, молекулярная структура которых образована цепочкой одинаковых кислотообразующих атомов, например в политионовых кислотах H2SnO6 или в сульфанах H2Sn, где n≥2.
Отдельно выделяют пероксокислоты — кислоты, содержащие пероксогруппы [–O–O–], например пероксомоносерная H2SO5 и пероксодисерная H2S2O8 кислоты. Тиокислотами называют кислоты, содержащие вместо атомов кислорода атомы серы, например тиосерная кислота H2SO3S. Существуют и комплексные кислоты, например: H2[SiF6], H[AuCl4], H4[Fe(CN)6] и др.
Равновесные процессы в водных растворах
Химические свойства кислот определяются способностью их молекул диссоциировать в водной среде с образованием гидратированных ионов H + и анионов кислотных остатков А – :



10 3 ), очень сильные (≥10 8 ).
Данная закономерность обусловлена усилением поляризации связи Н-О вследствие сдвига электронной плотности от связи к электроотрицательному атому кислорода по подвижным π-связям Э=O и делокализацией электронной плотности в анионе.
Неорганические кислоты обладают свойствами, общими для всех кислот, среди которых: окрашивание индикаторов, растворение активных металлов с выделением водорода (кроме HNO3), способность реагировать с основаниями и основными оксидами с образованием солей, например:


Число атомов водорода, отщепляемых от молекулы кислоты и способных замещаться на металл с образованием соли, называется основностью кислоты. Кислоты можно разделить на одно-, двух- и трехосновные. Кислоты с более высокой основностью неизвестны.
Одноосновными являются многие неорганические кислоты: галогеноводородные вида HHal, азотная HNO3, хлорная HClO4, роданистоводородная HSCN и др. Серная H2SO4, хромовая H2CrO4, сероводородная H2S служат примерами двухосновных кислот и т. д.
Многоосновные кислоты диссоциируют ступенчато, каждой ступени отвечает своя константа кислотности, причем всегда каждая последующая Кa меньше предыдущей ориентировочно на пять порядков. Ниже показаны уравнения диссоциации трехосновной ортофосфорной кислоты:


Исключение составляет борная кислота H3BO3, которая в водном растворе существует в виде одноосновного гидроксокомплекса:
Окислительно-восстановительные свойства
Все пероксокислоты и многие кислородсодержащие кислоты (азотная HNO3, серная H2SO4, марганцовая HMnO4, хромовая Н2CrO4, хлорноватистая HClO и др.) — сильные окислители. Окислительная активность этих кислот в водном растворе выражена сильнее, чем у их солей; при том окислительные свойства сильно ослабевают при разбавлении кислот (например, свойства разбавленной и концентрированной серной кислоты). Неорганические кислоты также всегда менее термически устойчивы, чем их соли. Указанные различия связаны с дестабилизирующим действием сильнополяризованного атома водорода в молекуле кислоты. Наиболее выразительно это проявляется в свойствах кислородсодержащих кислот-окислителей, например, хлорной и серной. Этим же объясняется невозможность существования вне раствора ряда кислот при относительной стабильности их солей. Исключение составляет азотная кислота и её соли, проявляющие сильно выраженные окислительные свойства вне зависимости от разбавления раствора. Такое поведение связано с особенностями строения молекулы HNO3.
Номенклатура
Номенклатура неорганических кислот прошла долгий путь развития и складывалась постепенно. Наряду с систематическими названиями кислот широко применяются традиционные и тривиальные. Некоторые распространённые кислоты могут в различных источниках иметь разные названия: например, водный раствор HCl может именоваться соляной, хлороводородной, хлористоводородной кислотой.
Традиционные русские названия кислот образованы прибавлением к названию элемента морфем -ная или -овая (хлорная, серная, азотная, марганцовая). Для разных кислородсодержащих кислот, образованных одним элементом, используется -истая для более низкой степени окисления (сернистая, азотистая). В ряде случаев для промежуточных степеней окисления дополнительно используются морфемы -новатая и -новатистая (см. ниже названия кислородсодержащих кислот хлора).
Традиционные названия некоторых неорганических кислот и их солей приведены в таблице:
| Формула кислоты | Традиционное название | Тривиальное название | Название соли |
|---|---|---|---|
| H3AsO4 | Мышьяковая | Арсенаты | |
| H3ВO3 | Борная | Бораты | |
| Н2СО3 (CO2•H2O) | Угольная | Карбонаты | |
| НCN | Циановодородная | Синильная | Цианиды |
| Н2CrO4 | Хромовая | Хроматы | |
| НМnO4 | Марганцовая | Перманганаты | |
| HNO3 | Азотная | Нитраты | |
| HNO2 | Азотистая | Нитриты | |
| Н3РО4 | Ортофосфорная | Фосфорная | Ортофосфаты |
| H2SO4 | Серная | Сульфаты | |
| Н2SiO3 (SiO2•H2О) | Метакремниевая | Кремниевая | Метасиликаты |
| H4SiO4 (SiO2•2H2O) | Ортокремниевая | Ортосиликаты | |
| H2S | Сероводородная | Сульфиды | |
| HF | Фтороводородная | Плавиковая | Фториды |
| НCl | Хлороводородная | Соляная | Хлориды |
| НВr | Бромоводородная | Бромиды | |
| HI | Иодоводородная | Иодиды |
Для менее известных кислот, содержащих кислотообразующие элементы в переменных степенях окисления, обычно применяются систематические названия.
HClO4 — тетраоксохлорат(VII) водорода (хлорная кислота) HClO3 — триоксохлорат(V) водорода (хлорноватая кислота) HClO2 — диоксохлорат(III) водорода (хлористая кислота) HClO — оксохлорат(I) водорода (хлорноватистая кислота) H2Cr2O7 — гептаоксодихромат(VI) диводорода (дихромовая кислота) H2S4O6 — гексаоксотетрасульфат диводорода (тетратионовая кислота) Н2В4О6 — гексаоксотетраборат диводорода (тетраметаборная кислота) HAuCl4 — тетрахлороаурат(III) водорода (золотохлористоводородная кислота) H[Sb(OH)6] — гексагидроксостибат(V) водорода
Ниже приведены корни латинских названий кислотообразующих элементов, не совпадающие с корнями русских названий тех же элементов: Ag — аргент(ат), As — арсен(ат), Аu — аур(ат), Cu — купр(ат), Fe — ферр(ат), Hg — меркур(ат), Pb — плюмб(ат), Sb — стиб(ат), Si — силик(ат), Sn — станн(ат), S — сульф(ат).
В формулах тиокислот, образованных из оксикислот замещением атомов кислорода на атомы серы, последние помещают в конце: H3PO3S — тиофосфорная кислота, H2SO3S — тиосерная кислота.
Общие методы получения кислот
Существует множество методов получения кислот, в т. ч. общих, среди которых в промышленной и лабораторной практике можно выделить следующие:
Применение
Минеральные кислоты широко применяют в металло- и деревообработке, текстильной, лакокрасочной, нефтегазовой и других отраслях промышленности и в научных исследованиях. К числу веществ, производимых в наибольшем объёме, относятся серная, азотная, фосфорная, соляная кислоты. Суммарное годовое производство в мире этих кислот исчисляется сотнями миллионов тонн в год.
В металлообработке они часто используются для травления железа и стали и в качестве очищающих агентов перед сваркой, металлизацией, окраской или гальванической обработкой.
Серная кислота, метко названная Д. И. Менделеевым «хлебом промышленности», применяется в производстве минеральных удобрений, для получения других минеральных кислот и солей, в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ, в нефтяной, металлообрабатывающей, текстильной, кожевенной, пищевой и др. отраслях промышленности, в промышленном органическом синтезе и т. п.
Соляная кислота применяется для кислотной обработки, очищения руд олова и тантала, для производства патоки из крахмала, для удаления накипи с котлов и теплообменного оборудования ТЭЦ. Она также используется в качестве дубильного вещества в кожевенной промышленности.
Азотная кислота применяется при получении аммонийной селитры, использующейся в качестве удобрения и в производстве взрывчатых веществ. Кроме того, она применяется в процессах органического синтеза, в металлургии, при флотации руды и для переработки отработанного ядерного топлива.
Ортофосфорную кислоту широко используют при производстве минеральных удобрений. Она используется при пайке в качестве флюса (по окисленой меди, по чёрному металлу, по нержавеющей стали). Входит в состав ингибиторов коррозии. Также применяется в составе фреонов в промышленных морозильных установках как связующее вещество.
Пероксокислоты, кислородсодержащие кислоты хлора, марганца, хрома находят применение как сильные окислители.
Кислоты органические и неорганические
Классификация кислот
Кислоты прежде всего классифицируют на неорганические и органические (карбоновые). Слабые кислотные свойства проявляют такие органические соединения как спирты и фенолы. Неорганические и карбоновые кислоты, в свою очередь, имеют свои собственные классификации. Так, все неорганические кислоты можно классифицировать:
Карбоновые кислоты классифицируют:
Физические свойства кислот
При н.у. большинство неорганических кислот существуют в жидком состоянии, некоторые – в твёрдом состоянии (H3PO4, H3BO3).
Органические кислоты с числом атомов углерода до 3 представляют собой легкоподвижные бесцветные жидкости с характерным резким запахом; кислоты с 4-9 атомами углерода — маслянистые жидкости с неприятным запахом, а кислоты с большим количеством атомов углерода— твёрдые вещества, нерастворимые в воде.
Строение карбоксильной группы
Рис. 1 Строение карбоксильной группы
Получение кислот
Неорганические и органические кислоты получают разными способами. Так, неорганические кислоты можно получить:
Органические кислоты получают путем:
R – CH2 –OH → R –C(O)H → R-COOH,
где R – углеводородный радикал.
Химические свойства кислот
К общим химическим свойствам и органических и неорганических кислот относят:
— способность изменять окраску индикаторов, например, лакмус при попадании в раствор кислоты приобретает красную окраску (это обусловлено диссоциацией кислот);
— взаимодействие с активными металлами
— взаимодействие с основными и амфотерными оксидами
— взаимодействие с основаниями
RCOOH + NaOH = RCOONa + H2O
— взаимодействие с солями слабых кислот
CH3COONa + HCl = CH3COOH + NaCl
Специфические свойства неорганических кислот
К специфическим свойствам неорганических кислот относят окислительно-восстановительные реакции, связанные со свойствами анионов кислот:
Специфические свойства органических кислот
К специфическим свойствам органических кислот относят образование функциональных производных путем замещения гидроксильной группы (1, 2, 3, 4), а также галогенирование (5), восстановление (6) и декарбоксилирование (7).
R –C(O)-OH + PCl5 = R –C(O)-Cl (хлорангидрид) + POCl3 + HCl (1)
R –C(O)-OH + H-O-C(O)-R = R – C(O) – O – C(O) – R (ангидрид) (2)
R-COOH + LiAlH4 (водный раствор, подкисленный HCl) = R-CH2-OH +AlCl3 + LiCl (6)
Примеры решения задач
5) CH3COONa + HCl = СН3СООН + NaCl
6) СН3СООН + С2Н5ОН 
| Задание | Определите массу пирита (FeS2), необходимую для получения такого количества SO3, чтобы при растворении последнего в растворе серной кислоты с массовой долей 91 % массой 500 г получить олеум с массовой долей 12,5 %. |
| Решение | Запишем уравнения реакций: |
Найдем молярные массы веществ, необходимых для дальнейших расчетов:
Масса воды в 100 г раствора серной кислоты (ω = 91 %) составит:
Из уравнения реакции (3) следует, что
0,5 моль H2O прореагирует с 0,5 моль SO3 и образуется 0,5 моль H2SO4
Рассчитаем массу SO3
Тогда общая масса H2SO4 составит
Для получения олеума (ω = = 12,5 %) на 140 г H2SO4 потребуется SO3:
m(SO3) = 12,5•140/87,5 = 20 г
Таким образом, всего SO3 расходуется
Из уравнений реакций (2, 3) следует, что на образование 0,75 моль SO3 расходуется