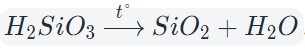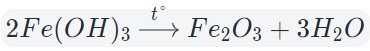Что значит формула высшего оксида
Формула оксидов.
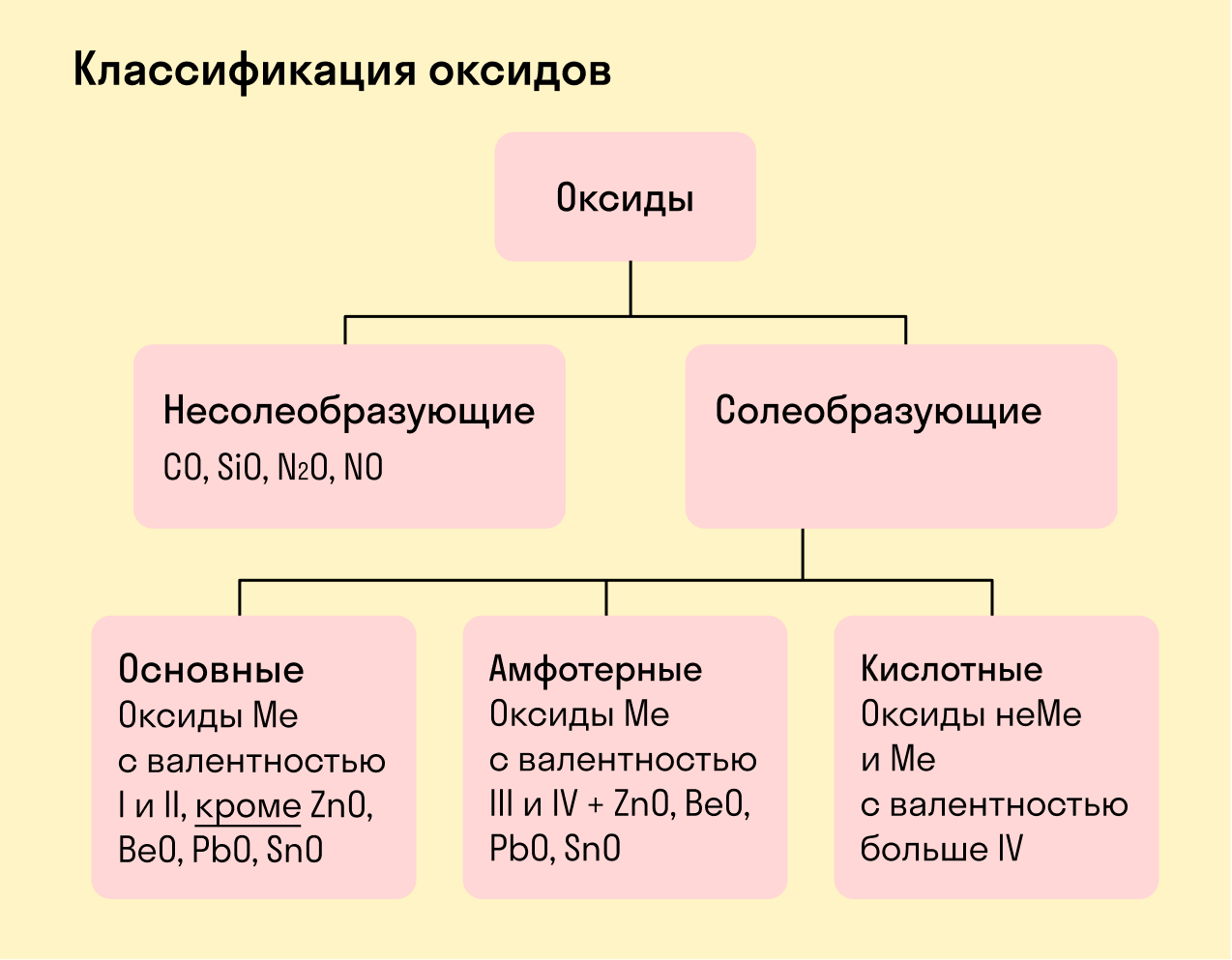
Классификация оксидов.
По классификации оксидов, солеобразующими оксидами являются те оксиды, которые могут взаимодействовать с кислотами либо основаниями с возможностью появления соответствующей соли и воды. Солеобразующими оксидами называют:
Основные оксиды, зачастую образующиеся из металлов со степенью окисления +1, +2. Могут реагировать с кислотами, с кислотными оксидами, с амфотерными оксидами, с водой (только оксиды щелочных и щелочно-земельных металлов). Элемент основного оксида становится катионом в образующейся соли. Na2O, CaO, MgO, CuO.
Примечание: металл менее активный, чем алюминий.
Амфотерные оксиды, образуют металлы со степенью окисления от +3 до +5 (к амфотерным оксидам относятся также BeO, ZnO, PbO, SnO). Реагируют с кислотами, щелочами, кислотными и основными оксидами.
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства: ZnO + 2HCl → ZnCl2 + H2O
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
Несолеобразующие оксиды не вступают в реакцию ни с кислотами, ни с основаниями, а значит, солей не образуют. N2O, NO, CO, SiO.
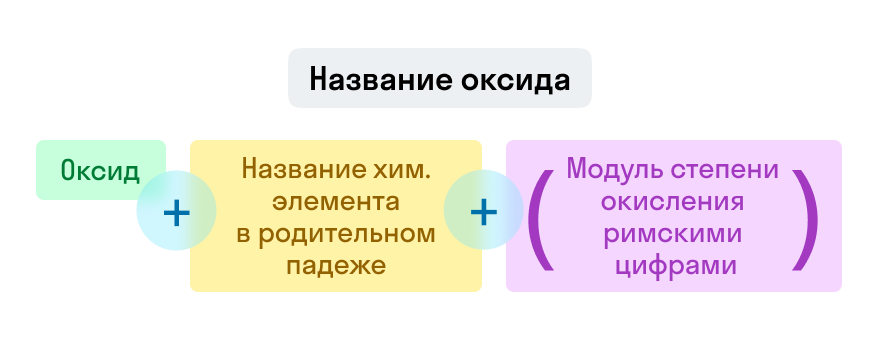
В соответствии с номенклатурой ИЮПАК, названия оксидов складываются из слова оксид и названия второго химического элемента (с меньшей электроотрицательностью) в родительном падеже:
Если элемент может образовывать несколько оксидов, то в их названиях следует указать степень окисления элемента:
Можно использовать латинские приставки для обозначения числа атомов элементов, которые входят в молекулу оксида:
Часто используются также тривиальные названия некоторых оксидов:
Высшие оксиды и гидроксиды химических элементов третьего периода
Высшие оксиды и гидроксиды химических элементов третьего периода. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе.
Высшие оксиды и гидроксиды – это соединения, в состав которых входит элемент данной группы с высшей степенью окисления.
Высшие оксиды и гидроксиды химических элементов третьего периода
В периоде слева направометаллические свойства химических элементов ослабевают,
Основные оксиды взаимодействуют с водой, с кислотными оксидами, с кислотами.
гидроксид натрия сульфат натрия хлорид магния
Их гидраты (основания) взаимодействуют с кислотными оксидами, с кислотами, с солями.
NaOH + HCl = NaCl + H2O (хлорид натрия и вода)
Амфотерный оксид Al2O3 не взаимодействует с водой, реагирует со щелочами и кислотами.
Al2O3 + 2NaOH = 2NaAlO2+ H2O (при сплавлении оксида со щелочью получается соль
алюминат натрия и вода).
Кислотные оксиды реагируют с водой, с основными оксидами, с основаниями.
Гидраты кислотных оксидов (кислоты) реагируют с основными оксидами, с основаниями, ссолями более слабых, летучих и нерастворимых кислот, с металлами, стоящими в рядунапряжений до водорода. H2SO4 + CuO = CuSO4+ H2O (сульфат меди и вода).
Дата добавления: 2016-05-05 ; просмотров: 34074 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Оксиды
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
Виды оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na +1 2O, Ca +2 O, Ba +2 O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al +3 2O3, Fe2 +3 O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S +6 O3, N2 +5 O5, Mn2 +7 O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
Названия оксидов строятся по систематической номенклатуре следующим образом:
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида
Бытовое (тривиальное название)
Возможное научное название
Химические свойства основных оксидов
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль
Кислотный оксид + основание = соль + вода
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль
Кислотный оксид + амфотерный оксид = соль + вода
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль
Амфотерный оксид + кислота = соль + вода
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль
Амфотерный оксид + щелочь (расплав) = средняя соль + вода
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Таблица оксидов
Таблица оксидов.
Оксиды: основные оксиды, кислотные оксиды, амфотерные оксиды:
Оксид (именуемые также окисел, окись) – это бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
Химический элемент кислород по электроотрицательности находится на втором месте после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. Исключение составляет, например, дифторид кислорода OF2.
В зависимости от химических свойств различают:
— несолеобразующие оксиды: оксид углерода (II) СО, оксид азота (I) N2O, оксид азота (II) NO, оксид кремния (II) SiO и оксид серы (II) SO.
В зависимости от количества атомов элементов в оксиде, кроме кислорода различают:
— простые, включающие в молекулу атомы одного элемента, кроме кислорода, и находящихся в в одной степени окисления. Например, оксид лития Li2O.
— сложные оксиды, включающие в молекулу атомы двух и более элементов, кроме кислорода. Например, оксид лития-кобальта (III) Li2O·Co2O3;
— двойные оксиды, в которые атомы одного и того же элемента входят в двух или более степенях окисления. Например, оксид марганца (II, IV) Mn5O8. Во многих случаях такие оксиды могут рассматриваться как соли кислородсодержащих кислот.
Таблица оксидов:
CO2 (оксид углерода (IV), диоксид углерода, углекислый газ),
C6O6 (диангидрид этилентетракарбоновой кислоты)
C12O12 (гексагидроксибензол трисоксалат),
и др.
NO (оксид азота (II), мон(о)оксид азота, окись азота, нитрозил-радикал),
N2O3 (оксид азота (III), азотистый ангидрид, сесквиоксид азота),
NO2 (диоксид азота, оксид азота (IV), двуокись азота),
N2O5 (оксид азота (V), пентаоксид азота, пентаоксид диазота, нитрат нитрила, нитрат нитрония, азотный ангидрид),
N2O4 (димер диоксида азота, тетраоксид диазота, азотный тетраоксид),
и др.
SiO2 (оксид кремния (IV), диоксид кремния, кремнезём)
P2O3 или P4O6 (оксид фосфора (III), фосфористый ангидрид, гексаоксид тетрафосфора),
P2O5 или P4O10 (оксид фосфора (V), пентаоксид фосфора, фосфористый ангидрид, гексаоксид тетрафосфора)
SO2 (оксид серы (IV), диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид),
SO3 (оксид серы (VI), трёхокись серы, серный газ, ангидрид серной кислоты)
ClO2 (диоксид хлора, оксид хлора (IV), двуокись хлора),
ClOClO3 ( перхлорат хлора ),
Cl2O6 (дихлоргексаоксид, оксид хлора (V, VII), перхлорат хлорила),
Cl2O7 (оксид хлора (VII), дихлорогептаоксид, хлорный ангидрид),
и др.
Ti2O3 (оксид титана(III), трёхокись титана),
TiO2 (оксид титана (IV), диоксид титана, двуокись титана, титановые белила)
V2O3 (оксид ванадия (III), трехокись ванадия),
VO2 (оксид ванадия (IV), диоксид ванадия, двуокись ванадия),
V2O5 (оксид ванадия (V), пентаоксид диванадия)
Cr2O3 (оксид хрoма (III), сесквиоксид хрома, хромовая зелень, эсколаит),
CrO2 (оксид хрома (IV), диоксид хрома, двуокись хрома),
CrO3 (оксид хрома (VI), триоксид хрома, трёхокись хрома, хромовый ангидрид)
Mn3O4 (оксид марганца (II,III), окисел марганца),
Mn5O8 (оксид марганца (II,IV), окисел марганца),
Mn2O3 (оксид марганца (III), окисел марганца),
MnO2 (оксид марганца (IV), диоксид марганца),
MnO3 (оксид марганца (VI), окисел марганца),
Mn2O7 (оксид марганца (VII))
Fe2O3 (оксид железа (III), окись железа, колькотар, крокус, железный сурик, гематит),
Fe3O4 (оксид железа (II,III), закись-окись железа, железная окалина, магнетит, магнитный железняк),
и др.
Co3O4 (оксид кобальта (II,III), окись кобальта),
Co2O3 (оксид кобальта (III), окись кобальта),
CoO2•H2O (оксид кобальта (IV), гидрат оксида кобальта)
Ni2O3 (оксид никеля (III), окисел никеля; сесквиоксид никеля)
CuO (оксид меди (II), окись меди),
Cu2O3 (оксид меди (III), триоксид димеди)
Ga2O3 (оксид галлия (III))
GeO2 (оксид германия (IV), диоксид германия, двуокись германия)
As2O5 (оксид мышьяка (V), пентоксид мышьяка)
SeO3 (оксид селена (VI), триоксид селена, селеновый ангидрид)
Nb2O3 (оксид ниобия (III), окись ниобия),
NbO2 (оксид ниобия (IV), окись ниобия),
Nb2O5 (оксид ниобия (V), окись ниобия)
MoO2 (оксид молибдена (IV), окись молибдена),
Mo2O5 (оксид молибдена (V), окись молибдена),
MoO3 (оксид молибдена (VI), триоксид молибдена, триоксомолибден, молибдит)
Tc2O7 (оксид технеция (VII), окись технеция (VII))
RuO2 (оксид рутения(IV), окись рутения (IV)),
RuO4 (оксид рутения(VIII), тетраоксид рутения)
Rh2O3 (оксид родия (III), сесквиоксид родия),