Что такое zns в химии
Сульфид цинка
Содержание
Свойства
Белый порошок, плотность 3,98—4,09 г/см³. При обычном давлении не плавится, под давлением 15 МПа (150 атм) плавится при 1850 °C. Во влажном воздухе сульфид цинка окисляется до сульфата; при нагревании на воздухе образуется ZnO и SO2. В воде нерастворим, в кислотах растворяется с образованием соответствующих солей и выделением сероводорода. В присутствии следов меди, кадмия, серебра и др. приобретает способность к люминесценции.
Распространение в природе
В природе ZnS встречается в виде минералов сфалерита (цинковая обманка) — основного сырья для получения цинка и вюрцита, отличающегося от сфалерита типом кристаллической решётки.
Получение
Сульфид цинка может быть получен пропусканием сероводорода через растворы солей цинка. Сульфид цинка может быть получен при воздействии ударных волн на смесь порошков цинка и серы.
Применение
Применяется для создания люминофоров: ZnS:Ag (с синим цветом свечения) — для цветных кинескопов; (Zn, Cd)S:Ag — для рентгеновских трубок, ZnS:Cu (с зеленым цветом свечения) — для светящихся табло, панелей.
Сульфид цинка типа сфалерита — полупроводниковый материал с шириной запрещённой зоны 3,54—3,91 эВ, используется, в частности, в полупроводниковых лазерах.
Крупные монокристаллы, активированные серебром или редкоземельными металлами, применяют в качестве сцинтилляторов для регистрации ионизирующих излучений.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Сульфид цинка» в других словарях:
сульфид цинка — сернистый цинк … Cловарь химических синонимов I
ЦИНКА СЕМЕЙСТВО — ПОДГРУППА IIB. СЕМЕЙСТВО ЦИНКА ЦИНК, КАДМИЙ, РТУТЬ Положение элементов семейства цинка как членов рядов переходных металлов, рассмотрено ранее (см. разд. Подгруппа IB и Переходные элементы). Хотя валентный электрон, отличающий их от элементов… … Энциклопедия Кольера
Цинка сульфид — Сульфид цинка, сернистый цинк, ZnS цинковая соль сероводородной кислоты. Содержание 1 Свойства 2 Распространение в природе 3 Получение 4 … Википедия
Сульфид кадмия — Сульфид кадмия … Википедия
Сульфид вольфрама(IV) — Общие Систематическое наименование Сульфид вольфрама(IV) Традиционные названия сернистый вольфрам Химическая формула WS2 Физические свойства Со … Википедия
Сульфид вольфрама(VI) — Общие Систематическое наименование Сульфид вольфрама(VI) Традиционные названия Сернистый вольфрам Химическая формула WS3 Физические свойства Со … Википедия
ЦИНКА СУЛЬФИД — (сернистый цинк) ZnS, бесцветные кристаллы. В воде почти нерастворим. В природе минералы сфалерит и вюрцит. Входит в состав литопона (белый пигмент). Полупроводниковый материал, люминофор … Большой Энциклопедический словарь
цинка сульфид — ZnS, бесцветные кристаллы. В воде почти нерастворим. В природе минералы сфалерит и вюрцит. Входит в состав литопона (белый пигмент). Полупроводниковый материал, люминофор. * * * ЦИНКА СУЛЬФИД ЦИНКА СУЛЬФИД (сернистый цинк), ZnS, бесцветные… … Энциклопедический словарь
цинка сульфид — cinko sulfidas statusas T sritis chemija formulė ZnS atitikmenys: angl. zinc sulfide rus. цинк сернистый; цинка сульфид … Chemijos terminų aiškinamasis žodynas
Что такое zns в химии
Белый порошок, плотность 3,98—4,09 г/см³. При обычном давлении не плавится, под давлением 15 МПа (150 атм) плавится при 1850 °C. Во влажном воздухе сульфид цинка окисляется до сульфата; при нагревании на воздухе образуется ZnO и SO2. В воде нерастворим, в кислотах растворяется с образованием соответствующих солей и выделением сероводорода. В присутствии следов меди, кадмия, серебра и др. приобретает способность к люминесценции.
Распространение в природе
Получение
Сульфид цинка может быть получен пропусканием сероводорода через растворы солей цинка. Сульфид цинка может быть получен при воздействии ударных волн на смесь порошков цинка и серы.
Применение
Применяется для создания люминофоров: ZnS·Ag (с синим цветом свечения) — для цветных кинескопов; (Zn, Cd)S·Ag — для рентгеновских трубок, ZnS·Cu (с зеленым цветом свечения) — для светящихся табло, панелей. Сульфид цинка — полупроводниковый материал, используемый, в частности, в полупроводниковых лазерах.
Полезное
Смотреть что такое «ZnS» в других словарях:
ZNS — 〈Abk. für〉 Zentralnervensystem * * * ZNS: Abk. für Zentralnervensystem. * * * I ZNS, Abkürzung für Zentralnerven … Universal-Lexikon
Zns — steht für: die Zentralnachweisstelle, eine ehemalige Einrichtung des Bundesarchives das Zentralnervensystem (Zentrales Nervensystem) ZnS ist die chemische Summenformel von Zinksulfid … Deutsch Wikipedia
ZNS — ⇒ Zentralnervensysteme … Deutsch wörterbuch der biologie
ZNS — 〈Abk. für〉 Zentralnervensystem … Lexikalische Deutsches Wörterbuch
ZNS — [Abk. für: Zentralnervensystem]: = Systema nervosum centrale … Das Wörterbuch medizinischer Fachausdrücke
ZNS-TV — Infobox Broadcast call letters = ZNS TV station station slogan = Only the sun covers The Bahamas better station branding = analog = 13 (VHF) (both stations) digital = no other chs = ZNS TV 1 13 (Freeport) affiliations = ZNS Network founded = 1977 … Wikipedia
ZnS — Kristallstruktur … Deutsch Wikipedia
ZNS — Die ZNS – Hannelore Kohl Stiftung ist eine Fusion verschiedener Vorgängerorganisationen. Unter dem Namen KURATORIUM ZNS gründete Hannelore Kohl 1983 die Hilfsorganisation für Unfallopfer mit Verletzungen des Zentralen Nervensystems. Zehn Jahre… … Deutsch Wikipedia
ZNS-1 — Infobox Radio station name = ZNS 1 city = Nassau, Bahamas area = Nassau and Vicinity branding = Radio Bahamas slogan = frequency = 1540 kHz repeater = airdate = share = share as of = share source = format = News/Talk power = 50,000 watts … Wikipedia
ZNS — Zincblende (Academic & Science » Chemistry) **** Zonisamide (Medical » Physiology) * Zip N Squeeze Bag (Business » Products) … Abbreviations dictionary
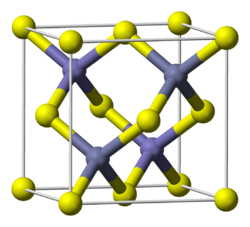
Структура сульфида цинка (ZnS), свойства, номенклатура, применение
Сульфид цинка нерастворим в воде. Это может нанести ущерб окружающей среде, так как проникает в землю и загрязняет грунтовые воды и их течения..
Сульфид цинка может быть получен, среди других реакций, коррозией и нейтрализацией.
Сульфид цинка является фосфоресцентной солью, что дает ему возможность многократного использования и применения. Кроме того, это полупроводник и фотокатализатор.
структура
Цинковая обманка является наиболее стабильной в условиях земного давления и температуры; и вюрцит, который является менее плотным, возникает в результате кристаллической перегруппировки из-за повышения температуры.
Эти две структуры могут сосуществовать в одном и том же твердом теле ZnS одновременно, хотя очень медленно вюрцит будет доминировать.
Цинковая обманка
Обратите внимание на тетраэдрическую геометрию вокруг ионов. Цинковую обманку также можно представить этими тетраэдрами, чьи отверстия внутри кристалла имеют одинаковую геометрию (тетраэдрические отверстия).
Также важно подчеркнуть, что перед желтой сферой и позади нее находятся тетраэдрические отверстия (пространство, которое отделяет их друг от друга).
вюрцит
В отличие от структуры цинковой обманки, вюрцит имеет гексагональную кристаллическую систему (верхнее изображение). Это менее компактно, поэтому твердое тело имеет меньшую плотность. Ионы в вюрците также имеют тетраэдрическую среду и соотношение 1: 1, соответствующее формуле ZnS..
свойства
цвет
Это можно представить тремя способами:
-Вюрцит, с белыми и шестиугольными кристаллами.
-Сфалерит, с бело-сероватыми кристаллами и кубическими кристаллами.
-Как от белого до серовато-белого или желтоватого порошка, так и от кубических желтоватых кристаллов.
Точка плавления
Растворимость в воде
Фактически нерастворим (0,00069 г / 100 мл при 18ºС).
растворимость
Нерастворим в щелочах, растворим в разбавленных минеральных кислотах.
плотность
твердость
Он имеет твердость от 3 до 4 по шкале Мооса.
стабильность
Когда он содержит воду, он медленно окисляется до сульфата. В сухой среде устойчив.
разложение
При нагревании при высоких температурах выделяет токсичные пары оксидов цинка и серы..
номенклатура
Следовательно, опустите номенклатуру запаса, добавьте ее валентность, заключенную в скобки и с римскими цифрами: сульфид цинка (II).
Систематические и традиционные номенклатуры
Но есть и другие способы вызова ZnS в дополнение к уже предложенному. В систематике число атомов каждого элемента указывается с помощью греческих числителей; с единственным исключением элемента справа, когда он только один. Таким образом, ZnS называется: обезьянаСульфид цинка (а не моносульфид моноцинка).
приложений
В качестве пигментов или покрытий
Его использование в сочетании с пигментами, поглощающими ультрафиолетовое излучение, такими как микротитановые или прозрачные пигменты на основе оксида железа, необходимо в погодоустойчивых пигментах..
-Когда ZnS применяется в латексных или текстурированных красках, он обладает пролонгированным микробицидным действием..
-Благодаря своей высокой твердости и устойчивости к поломкам, эрозии, дождю или пыли делает его пригодным для наружных инфракрасных окон или рам самолетов.
-ZnS используется в покрытиях роторов, используемых при транспортировке соединений, для уменьшения износа. Он также используется в производстве печатных красок, изоляционных составов, термопластичной пигментации, огнестойких пластиков и электролюминесцентных ламп..
-Сульфид цинка может быть прозрачным и может использоваться в качестве окна для видимой оптики и инфракрасной оптики. Используется в приборах ночного видения, на экранах телевизоров, экранах радаров и в люминесцентных покрытиях..
-Легирование ZnS с Cu используется в производстве электролюминесцентных панелей. Кроме того, он используется в ракетной тяге и гравиметрии..
Из-за его фосфоресценции
-Его фосфоресценция используется для окрашивания стрелок часов и, таким образом, для визуализации времени в темноте; также в красках для игрушек, в аварийных знаках и дорожных предупреждениях.
Фосфоресценция позволяет использовать сульфид цинка в электронно-лучевых трубках и на рентгеновских экранах, чтобы светиться в темных пятнах. Цвет фосфоресценции зависит от используемого активатора.
Полупроводник, фотокатализатор и катализатор
-Сфалерит и вюрцит являются широкополосными щелевыми полупроводниками. Сфалерит имеет ширину запрещенной зоны 3,54 эВ, а вюрцит имеет ширину запрещенной зоны 3,91 эВ..
-Он действует как катализатор деградации органических загрязнителей. Используется при составлении цветового синхронизатора в светодиодных лампах.
Сульфид цинка (или же сульфид цинка) является неорганическое соединение с химическая формула ZnS. Это основная форма цинка, встречающаяся в природе, где он в основном встречается в виде минерала. сфалерит. Хотя этот минерал обычно черный из-за различных примесей, чистый материал имеет белый цвет и широко используется в качестве пигмента. В своей плотной синтетической форме сульфид цинка может быть прозрачный, и он используется как окно для видимая оптика и инфракрасный оптика.
Содержание
Структура
ZnS существует в двух основных кристаллические формы, и этот дуализм часто является ярким примером полиморфизм. В каждой форме координационная геометрия Zn и S является тетраэдрической. Более стабильная кубическая форма известна также как цинковая обманка или сфалерит. Гексагональная форма известна как минерал вюрцит, хотя его также можно производить синтетическим путем. [2] Переход от формы сфалерита к форме вюрцита происходит примерно при 1020 °.° C. Тетрагональная форма также известна как очень редкий минерал, называемый полгемусит, с формулой (Zn, Hg) S.
Приложения
Люминесцентный материал
Сульфид цинка с добавлением нескольких промилле подходящих активатор, демонстрирует сильные фосфоресценция (описанный Никола Тесла в 1893 г. [3] ), и в настоящее время используется во многих приложениях, начиная с электронно-лучевые трубки через рентгеновский снимок экраны для светиться в темноте товары. Когда серебро используется как активатор, в результате получается ярко-синий цвет, максимум 450 нанометры. С помощью марганец дает оранжево-красный цвет примерно при 590 нанометрах. Медь дает долговременное свечение и имеет знакомое зеленоватое свечение в темноте. Сульфид цинка, легированный медью («ZnS plus Cu»), также используется в электролюминесцентный панели. [4] Здесь также выставлены фосфоресценция из-за загрязнений при освещении синим или ультрафиолетовый свет.
Оптический материал
Сульфид цинка также используется как инфракрасный оптический материал, пропускающий из видимого длины волн чуть более 12 микрометры. Может использоваться как планарный оптическое окно или в форме линза. Он сделан как микрокристаллический листы синтезом из сероводород газ и пары цинка, и это продается как FLIR-сорт (перспективный инфракрасный), где сульфид цинка имеет молочно-желтую непрозрачную форму. Этот материал, когда горячее изостатическое прессование (HIPed) может быть преобразован в прозрачную для воды форму, известную как Клиртран (товарный знак). Ранние коммерческие формы продавались как Иртран-2 но сейчас это обозначение устарело.
Пигмент
Сульфид цинка является обычным пигмент, иногда называемый сахтолитом. В сочетании с сульфатом бария сульфид цинка образует литопон. [5]
Катализатор
Мелкодисперсный порошок ZnS является эффективным фотокатализатор, который производит водород из воды при освещении. Вакансии серы могут быть введены в ZnS в процессе его синтеза; это постепенно превращает бело-желтоватый ZnS в коричневый порошок и повышает фотокаталитическую активность за счет улучшенного поглощения света. [1]
Свойства полупроводника
И сфалерит, и вюрцит являются внутренними, широко распространенными.запрещенная зона полупроводники. Это прототипы Полупроводники II-VI, и они принимают структуры, связанные со многими другими полупроводниками, такими как арсенид галлия. Кубическая форма ZnS имеет запрещенная зона около 3,54 электрон-вольт в 300 кельвины, но гексагональная форма имеет ширину запрещенной зоны около 3,91 электрон-вольт. ZnS может быть допированный как либо полупроводник n-типа или полупроводник p-типа.
История
Производство
Лабораторная подготовка
Его легко получить путем воспламенения смеси цинк и сера. [8] Поскольку сульфид цинка нерастворим в воде, его также можно получить в реакция осаждения. Растворы, содержащие Zn 2+ соли легко образуют осадок ZnS в присутствии сульфид ионы (например, из ЧАС2S).
Эта реакция лежит в основе гравиметрический анализ для цинка. [9]
Цинк. Химия цинка и его соединений
Положение в периодической системе химических элементов
Цинк расположены в побочной подгруппе II группы (или в 12 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение цинка и свойства
Электронная конфигурация цинка в основном состоянии :
+30Zn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2
3s 

Характерная степень окисления цинка в соединениях +2.
Физические свойства
Цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (быстро тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Нахождение в природе
Цинк играет важную роль в процессах, протекающих в живых организмах.
В природе цинк как самородный металл не встречается.
Способы получения
Цинк получают из сульфидной руды. На первом этапе руду обогащают, повышая концентрацию сульфидов металлов. Сульфид цинка обжигают в печи кипящего слоя:
2ZnS + 3O2 → 2ZnO + 2SO2
Чистый цинк из оксида получают двумя способами.
ZnO + С → Zn + CO
Далее цинк очищают от примесей.
При это получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу.
При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката:
Химические свойства
1.1. Цинк реагируют с галогенами с образованием галогенидов:
Реакция цинка с иодом при добавлении воды:
1.2. Цинк реагирует с серой с образованием сульфидов:
Zn + S → ZnS
1.4. С азотом цинк непосредственно не реагирует.
1.5. Цинк непосредственно не реагирует с водородом, углеродом, кремнием и бором.
1.6. Цинк взаимодействует с кислородом с образованием оксида:
2Zn + O2 → 2ZnO
2. Цинк взаимодействует со сложными веществами:
2.1. Цинк реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn 0 + H2 + O → Zn +2 O + H2 0
2.2. Цинк взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой и др.). При этом образуются соль и водород.
Zn + 2HCl → ZnCl2 + H2↑
Демонстрация количества выделения водорода при реакции цинка с кислотой:
Цинк реагирует с разбавленной серной кислотой:
Порошковый цинк реагирует с концентрированной серной кислотой с образованием сероводорода, сульфата цинка и воды:
2.5. Цинк – амфотерный металл, он взаимодействует с щелочами. При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Цинк реагирует с расплавом щелочи с образованием цинката и водорода:
В отличие от алюминия, цинк растворяется и в водном растворе аммиака:
Zn + CuO → Cu + ZnO
Еще пример : цинк восстанавливает медь из раствора сульфата меди (II):
CuSO4 + Zn = ZnSO4 + Cu
И свинец из раствора нитрата свинца (II):
Восстановительные свойства цинка также проявляются при взаимодействии его с сильными окислителями: нитратами и сульфитами в щелочной среде, перманганатами, соединениями хрома (VI):
Оксид цинка
Способы получения
Оксид цинка можно получить различными методами :
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
3. Оксид цинка можно получить разложением нитрата цинка :
Химические свойства
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
3. Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
ZnO + 2HCl = ZnCl2 + H2O
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Гидроксид цинка
Способы получения
1. Гидроксид цинка можно получить пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоцинката натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить исходное вещество Na2[Zn(OH)4] на составные части: NaOH и Zn(OH)2. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Zn(OH)2 не реагирует с СО2, то мы записываем справа Zn(OH)2 без изменения.
2. Гидроксид цинка можно получить действием недостатка щелочи на избыток соли цинка.
Химические свойства
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката:
4. Г идроксид цинка разлагается при нагревании :
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
Z nS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr