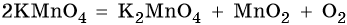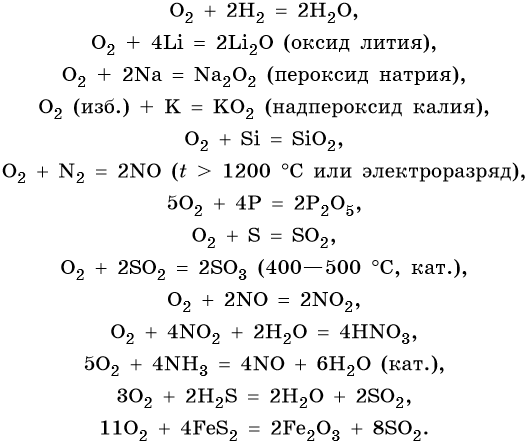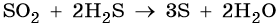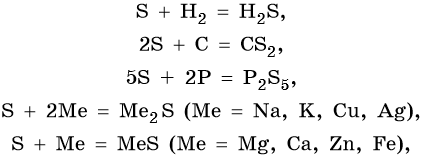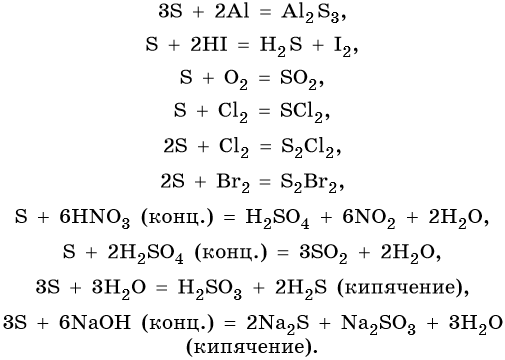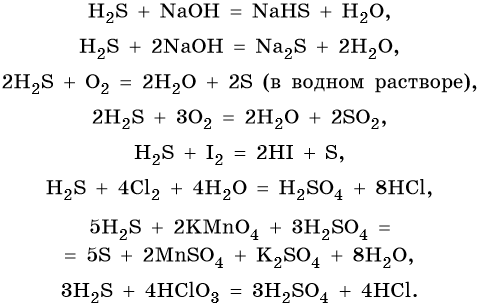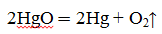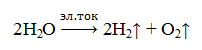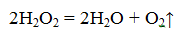Что такое via группа в химии
Халькогены
Примечания
Полезное
Смотреть что такое «Халькогены» в других словарях:
ХАЛЬКОГЕНЫ — ХАЛЬКОГЕНЫ, химические элементы VI группы периодической системы: кислород, сера, селен, теллур. Соединения халькогенов с более электроположительными химическими элементами халькогениды (оксиды, сульфиды, селениды, теллуриды) … Современная энциклопедия
ХАЛЬКОГЕНЫ — химические элементы VI группы Периодической системы кислород, сера, селен, теллур … Большой Энциклопедический словарь
ХАЛЬКОГЕНЫ — ПОДГРУППА VIA. ХАЛЬКОГЕНЫ КИСЛОРОД Элемент кислород O восьмой элемент периодической системы элементов и первый элемент подгруппы VIA (табл. 7а). Этот элемент наиболее распространен в земной коре, составляя около 50% (масс.). В воздухе, которым мы … Энциклопедия Кольера
халькогены — химические элементы VI группы периодической системы кислород, сера, селен, теллур. * * * ХАЛЬКОГЕНЫ ХАЛЬКОГЕНЫ, химические элементы VI группы Периодической системы кислород, сера, селен, теллур … Энциклопедический словарь
халькогены — chalkogenai statusas T sritis chemija apibrėžtis S, Se, Te, (Po). atitikmenys: angl. chalcogens rus. халькогены … Chemijos terminų aiškinamasis žodynas
ХАЛЬКОГЕНЫ — хим. элементы VIa гр. периодич. системы: кислород О, сераS, селен Se, теллур Те, полонийPo. Внеш. электронная оболочка атомов X. имеет конфигурацию s2p4. С увеличением ат. н. возрастают ковалентные и ионные радиусы X, уменьшаются энергия… … Химическая энциклопедия
ХАЛЬКОГЕНЫ — хим. элементы VI гр. периодич. системы элементов Менделеева: сера S, селен Se, теллур Те и радиоактивный полоний Ро. Со мн. металлами образуют халькогениды, например FeS … Большой энциклопедический политехнический словарь
ХАЛЬКОГЕНЫ — хим. элементы VI гр. периодич. системы кислород, сера, селен, теллур … Естествознание. Энциклопедический словарь
халькогены — хальког ены, ов, ед. ч. г ен, а … Русский орфографический словарь
Теллур — 52 Сурьма ← Теллур → Иод … Википедия
Элементы группы VIA
Наиболее характерные степени окисления халькогенов –2, +4, +6. Исключением является кислород, для которого характерна степень окисления –2 и –1 в пероксидах.
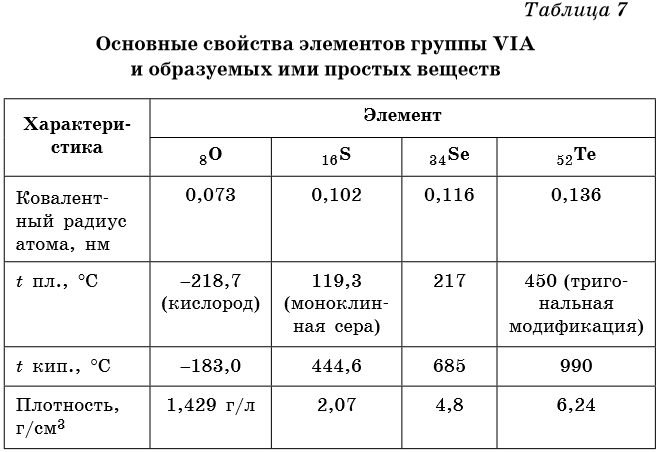
Все элементы подгруппы кислорода, за исключением полония, являются неметаллами. Некоторые физические свойства халькогенов приведены в таблице 7.
Кислород. В свободном состоянии кислород встречается в виде двух аллотропных модификаций: кислород О2 и озон О3 (аллотропия состава).
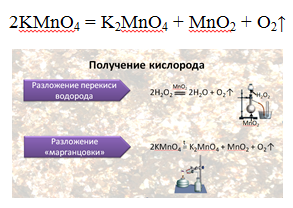
В промышленности кислород получают ректификацией жидкого воздуха, а в лаборатории — разложением перманганата калия или хлората калия, например:
Простое вещество кислород представляет собой бесцветный газ, без вкуса и запаха, малорастворимый в воде.
Озон представляет собой газ синего цвета, с резким раздражающим запахом, t кип. –111,9 °С. По сравнению с кислородом озон лучше растворим в воде.
Характерные химические свойства кислорода:
Cера. Неметалл желтого цвета. В промышленности серу получают выплавкой самородной серы, а также из газов металлургических, коксовых и иных производств:
Существует в двух аллотропных модификациях: ромбическая и моноклинная и в аморфной форме (пластическая сера). Проявляет как окислительные, так и восстановительные свойства. Возможны реакции диспропорционирования. Ее характерные химические свойства:
Сера образует летучее водородное соединение — сероводород. Его водный раствор представляет собой слабую двухосновную кислоту. Для сероводорода характерны также восстановительные свойства:
Сера образует два кислотных оксида: оксид серы (IV) SO2 и оксид серы (VI) SO3. Первому соответствует существующая только в растворе сернистая кислота H2SO3, являющаяся кислотой средней силы; второму — сильная двухосновная серная кислота H2SO4. Концентрированная серная кислота проявляет сильные окислительные свойства. Ниже приведены характерные для этих соединений реакции:
Кислород
Газ без цвета, без запаха, составляет 21% воздуха.
Общая характеристика элементов VIa группы
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.
Природные соединения
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция каталитического разложения пероксида водорода.
На подводных лодках для получения кислорода применяют следующую реакцию:
Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции с кислородом экзотермичны (горение), ускоряются при повышении температуры.
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
F + O2 → OF2 (фторид кислорода, O +2 )
В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Известна реакция горения воды во фторе.
Все органические вещества сгорают с образованием углекислого газа и воды.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Атомы элементов 16(VIa) группы (халькогены)
| Элемент | O | S | Se | Te | Po |
|---|---|---|---|---|---|
| Порядковый номер | 8 | 16 | 34 | 52 | 84 |
| Атомная масса (относительная) | 15,9994 | 32,066 | 78,96 | 127,6 | 208,9 |
| Плотность (н.у.), г/см 3 | 1,42897 | 2,070 | 4,79 | 6,24 | 9,196 |
| tпл, °C | -218,4 | 112,8 | 117 | 450 | 254 |
| tкип, °C | -182,96 | 444,674 | 585 | 990 | 962 |
| Энергия ионизации, кДж/моль | 1313,1 | 999,6 | 940,9 | 869,3 | 813 |
| Электронная формула | [He]2s 2 2p 4 | [Ne]3s 2 3p 4 | [Ar]3d 10 4s 2 4p 4 | [Kr]4d 10 5s 2 5p 4 | [Xe]4f 14 5d 10 6s 2 6p 4 |
| Электроотрицательность (по Поллингу) | 3,44 | 2,58 | 2,55 | 2,1 | 2,0 |
Электронные формулы инертных газов:
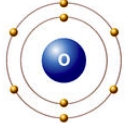
Рис. Строение атома кислорода.
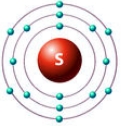
Рис. Строение атома серы.
В 16 группу (VIa группу по старой классификации) периодической таблицы химических элементов Д. И. Менделеева входят 5 элементов: кислород, сера, селен, теллур, полоний. Первые три элемента являются неметаллами; теллур проявляет металлические свойства; полоний является металлом.
Элементы, входящие в группу кислорода, еще называют халькогены («образующие руды»).
Простые вещества, образуемые халькогенами:
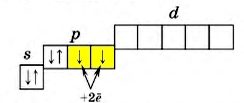
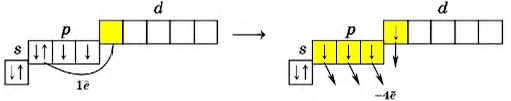
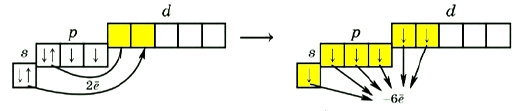
У всех халькогенов на внешнем энергетическом уровне находится 6 электронов: 2 (спаренных) на s-подуровне и 4 (два спаренных и два неспаренных) на p-подуровне + свободная орбиталь d-подуровня (исключение составляет кислород, не имеющий d-орбитали, см. Кислород и его соединения).
Наличие свободной d-орбитали значительно расширяет валентные возможности халькогенов.
Переходя в возбужденное состояние (что требует относительно небольших энергозатрат), атом халькогена «перебрасывает» один из спаренных p-электронов на d-подуровень, что дает ему возможность образовывать сразу 4 ковалентные связи, проявляя степень окисления +4 (SO2; H2SO3).
Атомы халькогенов могут «перебрасывать» в возбужденном состоянии сразу два электрона на свободный d-подуровень (1 s-электрон и 1 p-электрон), что дает им возможность образовывать сразу 6 ковалентных связей, проявляя степень окисления +6 (SO3; H2SO4).
У остальных халькогенов спаренные электроны, расположенные на s- и p-орбиталях, могут достаточно легко возбуждаться с переходом на d-подуровни, что приводит к увеличению кол-ва неспаренных электронов, и, соответственно, валентности элементов.
Окислительная способность халькогенов уменьшается по направлению от кислорода к теллуру.
Халькогенид-ионы являются восстановителями, поскольку могут только отдавать электроны, при этом восстановительная способность увеличивается по направлению от кислорода к теллуру.
Соединения халькогенов с водородом:
Все халькогеноводороды являются газами при н.у., исключение составляет только вода.
При растворении в воде халькогеноводороды образуют следующие кислоты:
Кислотные свойства усиливаются от H2S к H2Te.
Кислотным оксидам соответствуют кислоты:
Увеличение силы кислот идет снизу-вверх от H2TeO4 к H2SO4.
В кислотных оксидах и в кислотах халькогены проявляют степени окисления +4 и +6.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Общая характеристика халькогенов. Кислород
Цель: изучить особен ности строения атомов халькогенов, свойства и применение кислорода.
Задачи:
1. Организационный момент.
2. Изучение нового материала.
Халькогены — это элементы VIA группы. Родоначальником этой группы является кислород. Кроме кислорода в эту группу входят S, Se, Te, Po. Название халькогены означает «рождающие руды». Вам уже известны руды, содержащие серу, это — пирит, или железный колчедан — FeS2, киноварь — HgS, цинковая обманка — ZnS. Кислород входит в состав таких руд, как корунд — Al2O3, магнитный железняк, или магнетит — Fe3O4, красный железняк, или гематит — Fe2O3, бурый железняк, или лимонит — 2Fe2O3 · 3H2O, а также в состав других руд.
Кислород — самый распространенный элемент на Земле. Он входит в состав воды, которая покрывает поверхность земного шара, образуя его водную оболочку — гидросферу. Кислород входит в состав атмосферы, где на его долю приходится 21%. Кроме этого, он ещё входит в состав многих органических соединений.
Существует несколько способов получения кислорода. В промышленности кислород получают из жидкого воздуха.
Еще в 1774 г. Дж. Пристли, используя стеклянную двояковыпуклую линзу, направил сконцентрированный ею пучок солнечных лучей на оксид ртути (II) и получил кислород.
Одновременно с Пристли кислород получил К. Шееле путём нагревания селитры.
Название кислороду — oxygenium, «рождающий кислоты», или «кислород», этому элементу дал Лавуазье.
Кислород можно получить и при разложении воды в специальном устройстве — электролизёре. Таким образом, можно получить сразу два газа: кислород и водород.
В лаборатории для получения кислорода используют пероксид водорода (Н2О2). Эта реакция идёт в присутствии катализатора — оксида марганца IV.
Для получения кислорода в лаборатории ещё используют реакцию разложения перманганата калия — KMnO4 — «марганцовки».
Вещество
Агрегатное состояние при обычных условиях
Цвет
Запах
Температура плавления, 0 С
Температура кипения, 0 С
Кислород
Бесцветный, в жидком состоянии — голубой
Озон
Бесцветный, в жидком состоянии — синий
Резкий, характерный запах
Кислород взаимодействует почти со всеми простыми веществами, кроме галогенов, благородных газов, золота и платины.
Кислород энергично реагирует с металлами. Например, в реакции с литием, образуется оксид лития, в реакции с медью — оксид меди (II).
Кислород реагирует с неметаллами. Так в реакции с cерой образуется оксид серы (IV), в реакции с фосфором — оксид фосфора (V).
Почти все реакции с кислородом экзотермические (то есть сопровождаются выделением теплоты). Исключение составляет реакция азота с кислородом, которая является эндотермической.
Кислород окисляет не только простые, но и сложные вещества. Например, в реакции горения метана образуется вода и углекислый газ, в результате горения сероводорода образуется сернистый газ и вода.
Эта окислительная способность кислорода лежит в основе горения всех видов топлива. Кислород в этих реакциях выступает в роли окислителя.
Кислород участвует в процессах дыхания, медленного окисления различных веществ при обычной температуре. Например, медленное окисление пищи в нашем организме является источником энергии, за счёт которой живет организм. Так гемоглобин, соединенный с кислородом, оксигемоглобин доставляет во все ткани и клетки организма кислород, который окисляет белки, жиры и углеводы, образуя при этом углекислый газ и воду и освобождая при этом энергию, необходимую для деятельности организма.
Велика роль кислорода в процессах дыхания человека и животных. У растений в процессе фотосинтеза из углекислого газа и воды образуется глюкоза и кислород. За счет этого процесса сохраняется содержание свободного кислорода.
В природе постоянно осуществляется круговорот кислорода.
Проведём эксперимент: нальём два стаканчика перекиси водорода. В первый стаканчик добавим оксида марганца (IV), у нас наблюдается бурное выделение кислорода. Оксид марганца (IV) в данном случае катализатор, он ускоряет процесс разложения перекиси водорода. Если поднести к стаканчику тлеющую лучинку, то она вспыхнет из-за скопившегося кислорода.
В другой стаканчик добавим натёртую морковь, здесь тоже происходит бурное выделение кислорода, и если поднести тлеющую лучинку, то она вспыхнет. В данном случае фермент каталаза, который содержится в моркови, тоже способствует разложению перекиси водорода.
Кислород применяется в металлургической и химической промышленности для ускорения производственных процессов. Чистый кислород применяют при газовой сварке и резке металлов. Его используют и для жизнеобеспечения на подводных и космических кораблях, при работе водолазов и пожарных.
В медицине кислород применяют в случаях временного затруднения дыхания и различных заболеваниях. Кислород применяют в космической технике, как окислитель ракетного топлива, в производстве взрывчатых смесей.
Кислорол хранят в стальных баллонах, окрашенных в голубой цвет, под высоким давлением, а в лаборатории — в специальных приборах — газометрах.
Таким образом, халькогены — это элементы VIA группы. На внешнем энергетическом уровне у них 6 электронов. Они входят в состав многих руд. Кислород первый представитель группы. В реакциях он проявляет окислительные свойства. Кислород получают реакцией разложения перекиси водорода, марганцовки, воды, а в промышленности — из воздуха. Кислород участвует в круговороте веществ и применяется в химической и металлургической промышленности.
3. Закрепление.
1. С какими веществами вы познакомились сегодня на уроке?
2. Какие физические свойства характерны для кислорода?
3. Как получают кислород в промышленности?
4. Как получают кислород в лаборатории?
5. Что такое катализаторы, для чего их применяют?
6. Как осуществляется круговорот кислорода в природе?
7. Где применяют кислород?
4. Рефлексия.
«Плюс-минус»: таблица состоит из трёх граф, в графу «П» — «плюс» записывается всё, что понравилось на уроке, в графу «М» — «минус», что не понравилось.