Что такое sh2 в химии
Сульфид железа(II)
| Сульфид железа(II) | |
 | |
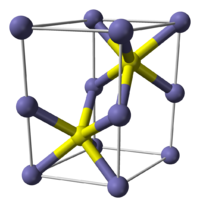 | |
| Общие | |
|---|---|
| Систематическое наименование | Сульфид железа(II) |
| Химическая формула | FeS |
| Эмпирическая формула | FeS |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 87,910 г/моль |
| Плотность | 4,84 г/см³ |
| Термические свойства | |
| Температура плавления | 1194 °C |
| Классификация | |
| Рег. номер CAS | 1317-37-9 |
Сульфид железа (II) — сложное неорганическое вещество с химической формулой FeS.
Содержание
Описание
Сульфид железа (II) — бескислородная соль. Черно-серого цвета с зеленым оттенком, тугоплавкий, разлагается при нагревании в вакууме. Во влажном состоянии чувствителен к кислороду воздуха. Нерастворим в воде. Не выпадает в осадок при насыщении растворов солей железа (II) сероводородом. Разлагается кислотами. Применяется как сырье в производстве чугуна, твердый источник сероводорода.
Получение
1. Взаимодействие железа с серой:
Химические свойства
1. Взаимодействие с концентрированной HCl:
2. Взаимодействие с концентрированной HNO3:
См. также
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | — | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Сульфид железа(II)» в других словарях:
сульфид железа(II) — односернистое железо, сернистое железо(II) … Cловарь химических синонимов I
Сульфид меди(I) — Кристалличесая структура халькозина … Википедия
Сульфид бериллия — Общие Систематическое наименование Сульфид бериллия Традиционные названия Сернистый бериллий Химическая формула BeS Эмпирическая формула BeS Физ … Википедия
Сульфид кальция — Общие … Википедия
Сульфид хрома(II) — Общие Систематическое наименование Сульфид хрома(II) Традиционные названия Сернистый хром Химическая формула CrS Физические свойства Состояние ( … Википедия
Сульфид хрома(III) — Общие Систематическое наименование Сульфид хрома(III) Традиционные названия Сернистый хром Химическая формула Cr2S3 Физические свойства … Википедия
Сульфид рутения(IV) — Общие Систематическое наименование Сульфид рутения(IV) Традиционные названия Сернистый рутений(IV) Химическая формула RuS2 Физические свойства Со … Википедия
железа(III) сульфид — geležies(III) sulfidas statusas T sritis chemija formulė Fe₂S₃ atitikmenys: angl. ferric sulfide; iron(III) sulfide rus. железа трисульфид; железа(III) сульфид ryšiai: sinonimas – digeležies trisulfidas … Chemijos terminų aiškinamasis žodynas
железа(II) сульфид — geležies(II) sulfidas statusas T sritis chemija formulė FeS atitikmenys: angl. ferrous sulfide; iron(II) sulfide rus. железа(II) сульфид; железо сернистое … Chemijos terminų aiškinamasis žodynas
железа трисульфид — geležies(III) sulfidas statusas T sritis chemija formulė Fe₂S₃ atitikmenys: angl. ferric sulfide; iron(III) sulfide rus. железа трисульфид; железа(III) сульфид ryšiai: sinonimas – digeležies trisulfidas … Chemijos terminų aiškinamasis žodynas
Сульфид железа (II)
| Сульфид железа (II) | |
|---|---|
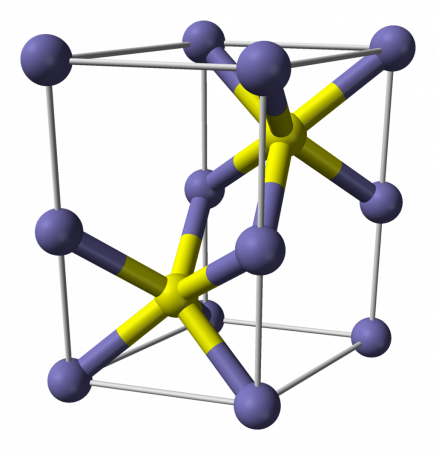 | |
| Систематическое наименование | Сульфид железа (II) |
| Хим. формула | FeS |
| Состояние | твёрдое |
| Молярная масса | 87,910 г/моль |
| Плотность | 4,84 г/см³ |
| Температура | |
| • плавления | 1194 °C |
| Рег. номер CAS | 1317-37-9 |
| PubChem | 14828 |
| Рег. номер EINECS | 215-268-6 |
| SMILES | |
| ChemSpider | 8466211 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Содержание
Описание и структура
Сульфид железа (II) — бескислородная соль. Кристаллы чёрного цвета с металлическим блеском и гексагональной кристаллической решёткой, тугоплавкий, разлагается при нагревании в вакууме. Во влажном состоянии чувствителен к кислороду воздуха. Нерастворим в воде. Не выпадает в осадок при насыщении растворов солей железа (II) сероводородом. Разлагается кислотами. Применяется как сырье в производстве чугуна, твердый источник сероводорода. Не притягивается магнитом.
Получение
1. Взаимодействие железа с серой:
Реакция начинается при нагревании смеси железа с серой в пламени горелки, далее может протекать и без подогрева, с выделением теплоты.
2. Взаимодействие оксида железа (III) с водородом и сероводородом:
Химические свойства
1. Взаимодействие с концентрированной HCl:
2. Взаимодействие с концентрированной HNO3:
Применение
Сульфид железа (II) служит обычным исходным продуктом при получении сероводорода в лабораторных условиях. Гидросульфид железа [Fe(SH)2] и/или отвечающая ему основная соль [Fe(SH)OH] является важнейшей составной частью некоторых лечебных грязей.
Содержание
Химические свойства
При обработке кислотой сульфидные соли превращаются в сероводород:
S 2− + H + → SH − SH − + H + → H2S
Производные металлов
Геология
Коррозия, вызванная сульфидом
Растворенные свободные сульфиды (H2S, HS − и S 2− ) являются очень агрессивными веществами для коррозии многих металлов, таких как сталь, нержавеющая сталь и медь. Сульфиды, присутствующие в водном растворе, ответственны за коррозионное растрескивание под напряжением (SCC) из стали, также известный как сульфидное растрескивание под напряжением. Коррозия является серьезной проблемой на многих промышленных установках, перерабатывающих сульфиды: мельницы сульфидной руды, глубокие руды. нефтяные скважины, трубопроводы транспортирующие закисшие масло, картон фабрики.
Микробиологическая коррозия (MIC) или биогенная сульфидная коррозия также вызваны сульфатредуцирующие бактерии производит сульфид, который выбрасывается в воздух и окисляется в серной кислоте сероокисляющими бактериями. Биогенная серная кислота реагирует с канализация материалов и, как правило, вызывает потерю массы, растрескивание канализационных труб и, в конечном итоге, обрушение конструкции. Такое ухудшение является серьезным процессом, влияющим на канализационные системы во всем мире и приводящим к очень высоким затратам на восстановление.
Окисление сульфида также может образовывать тиосульфат ( S
2 О 2−
3 ) промежуточный вид, ответственный за серьезные проблемы точечная коррозия из стали и нержавеющей стали, в то время как среда также подкисляется путем производства серной кислоты, когда окисление более продвинуто.
Органическая химия
В органическая химия, «сульфид» обычно относится к связи C – S – C, хотя термин тиоэфир менее двусмысленно. Например, тиоэфир диметилсульфид это CH3–S – CH3. Полифениленсульфид (см. ниже) имеет эмпирическую формулу C6ЧАС4S. Иногда термин сульфид относится к молекулам, содержащим –SH функциональная группа. Например, метилсульфид может означать CH3–Ш. Предпочтительным дескриптором для таких SH-содержащих соединений является тиол или меркаптан, то есть метантиол, или метилмеркаптан.
Дисульфиды
Примеры
Сульфидные соединения можно получить несколькими способами: [7]
Безопасность
Многие сульфиды металлов настолько нерастворимы в воде, что, вероятно, не очень токсичны. Некоторые сульфиды металлов при воздействии сильного минерала кислота, включая желудочная кислота, выделит токсичный сероводород.
Органические сульфиды легко воспламеняются. Когда горит сульфид, он производит диоксид серы (ТАК2) газ.
Сероводород, некоторые его соли и почти все органические сульфиды имеют сильный гнилостный запах; гниение биомасса выпускает эти.
Номенклатура
Систематические названия сульфандиид и сульфид (2-), действительный ИЮПАК названия, определяются согласно заместительной и аддитивной номенклатуре соответственно. Однако название сульфид также используется в номенклатуре композиций ИЮПАК, которая не учитывает природу вовлеченного связывания. Примеры такого наименования: дисульфид селена и сульфид титана, который вообще не содержит сульфид-ионов.
Тиолы и сульфиды
Вы будете перенаправлены на Автор24
Общая формула, номенклатура
Тиолы и сульфиды можно представить как производные сероводорода, в котором атомы водорода замещены органическими радикалами.
Рисунок 1. 2-метил-1-бутантиол. Автор24 — интернет-биржа студенческих работ
Рисунок 2. 3-пентантиол. Автор24 — интернет-биржа студенческих работ
Рисунок 3. Циклогексантиол. Автор24 — интернет-биржа студенческих работ
Названия сульфидов строятся аналогично названиям простых эфиров: перед окончанием сульфид даются названия алкильных или арильных групп:
Согласно номенклатуре IUPAC сульфиды называются алкилтиоалканами. Главной цепи алкана дает название большая из алкильных групп:
Готовые работы на аналогичную тему
Рисунок 4. 3-метил-(1-метилтио)пентан. Автор24 — интернет-биржа студенческих работ
Рисунок 5. 1-(изопропилтио)пентан. Автор24 — интернет-биржа студенческих работ
В простых случаях для названий сульфидов пользуются общей номенклатурой, согласно которой их называют диалкил-(арил)сульфидами.
Физические и химические особенности тиолов и сульфидов
Тиолы плохо растворимы в воде, но хорошо растворяются в диэтиловом эфире, этаноле и др. органических растворителях.
Сульфиды не растворяются в воде. По химическим свойствам являются нейтральными веществами.
При действии на тиолы слабых окислителей образуются дисульфиды. Сильные окислители способствуют образованию сульфокислот:
При окислении тиолов, в отличие от спиртов, окисляется сера, а не углерод.
Тиолы с легкостью присоединяются к непредельным соединениям по:
$RSH+R\cdot \to RS\cdot +RH$
Если на сульфиды действовать слабым окислителем, то это приведет к образованию сульфоксидов (А), а если воздействовать сильным окислителем, то образуются сульфоны (Б).
С алкилгалогенидами сульфиды образуют сульфониевые (тиониевые) соли.
Практическое применение тиолов и сульфидов
Метан-, этан- и изоамилтиолы применяют для одорации природного газа.
Для дегазации иприта применяют хлорамины Б и Т или хлорную известь.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 23 04 2021
Меркаптан
Тиолы или меркаптаны — органические вещества, сернистые аналоги спиртов, имеющие общую формулу RSH, где R — углеводородный радикал, например, метантиол (метилмеркаптан) (CH3SH), этантиол (этилмеркаптан) (C2H5SH) и т. д.
Меркаптаны получили своё название за способность связывать ионы ртути (по англ. mercury capture)
Содержание
Физические свойства
Тиолы являются жидкостями с отвратительным запахом. Их температура кипения ниже, чем у соответствующих спиртов из-за значительно более слабой водородной связи между молекулами тиола.
| Тиол | Температура кипения R-SH, o C | Спирт | Температура кипения R-OH, o C |
| H2S | — 61 | H2O | 100 |
| CH3SH | 6 | CH3OH | 65 |
| C2H5SH | 37 | C2H5OH | 78 |
| C6H5SH | 168 | C6H5OH | 181 |
Тиолы малорастворимы в воде, но хорошо растворяются в этаноле, эфире и других органических растворителях.
Получение
Тиолы можно получить действием гидросульфидов металлов на галоидные алкилы.
Химические свойства
Тиолы обладают слабыми кислотными свойствами, с металлами образуют тиоляты (меркаптиды). Являются значительно более сильными кислотами, чем соответствующие спирты.
Тиолы вступают в реакции присоединения к ацетиленовым, этиленовым и алленовым углеводородам. Реакция может протекать по нуклеофильному, электрофильному либо радикальному механизму.
Тиолы окисляются самым широким спектром окислителей (кислород, пероксиды, оксиды азота, галогены и др.). Мягкие окислители реагируют с тиолами с образованием дисульфидов:
При действии более жестких окислителей сначала образуются сульфиновые кислоты и далее — сульфокислоты.
Биологическая роль
Смесь тиолов содержится в веществе, выделяемом скунсами, а также в продуктах гниения белков.
Применение
За счёт сильного неприятного запаха тиолы, в частности, этантиол, используются для добавления во вредные газы, не имеющие запаха, для обнаружения утечки. Согласно правилам Ростехнадзора, запах этантиола в одорированном природном газе появляется при концентрации последнего не более 20 % (об.) от нижнего предела взрываемости.
Литература
См. также
Органические вещества
Полезное
Смотреть что такое «Меркаптан» в других словарях:
МЕРКАПТАН — (от лат. mercurium captans поглощающий ртуть). Органическое сернистое соединение, в котором кислород заменен серой. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. МЕРКАПТАН от лат. mercurium captans, поглощающий… … Словарь иностранных слов русского языка
меркаптан — а, м. mercaptan m. <лат. mercurium captans захватывающий ртуть. мн. Спирты, в которых кислород замещен серою; имеют отвратительный запах; в отличие от настоящих спиртов обладают кислыми свойствами. СИС 1954. Девять часов в сутки в сидячем… … Исторический словарь галлицизмов русского языка
МЕРКАПТАН — МЕРКАПТАН, см. ТИОЛ … Научно-технический энциклопедический словарь
меркаптан — сущ., кол во синонимов: 4 • спирт (101) • тиол (3) • тиоспирт (3) • … Словарь синонимов
меркаптан — Соединения, содержащие химическую группу SH, которая присутствует в большинстве сортов сырой нефти и компонентах первичной перегонки. Примечания 1. Легкие меркаптаны летучи, имеют резкий неприятный запах и часто используются по этой причине для… … Справочник технического переводчика
меркаптан — tiolis statusas T sritis chemija formulė RSH atitikmenys: angl. mercaptan; thioalcohol; thiol rus. меркаптан; тиол; тиоспирт ryšiai: sinonimas – tioalkoholis … Chemijos terminų aiškinamasis žodynas
меркаптан — меркаптан, меркаптаны, меркаптана, меркаптанов, меркаптану, меркаптанам, меркаптан, меркаптаны, меркаптаном, меркаптанами, меркаптане, меркаптанах (Источник: «Полная акцентуированная парадигма по А. А. Зализняку») … Формы слов
меркаптан — іменник чоловічого роду … Орфографічний словник української мови
меркаптан — тиоспирт … Cловарь химических синонимов I
Газ меркаптан — Меркаптаны (от позднелат. mercurium captans связывающий ртуть; син. тиоспирты) жидкости, производные углеводородов, имеющие неприятный специфический запах, ощутимым при ничтожно малых концентрациях в воздухе. В природе находятся главным образом в … Энциклопедия ньюсмейкеров





