Что такое s p d f элементы приведите по два примера
Что такое s p d f элементы приведите по два примера
7. Общая характеристика P-, S-, D-элементов
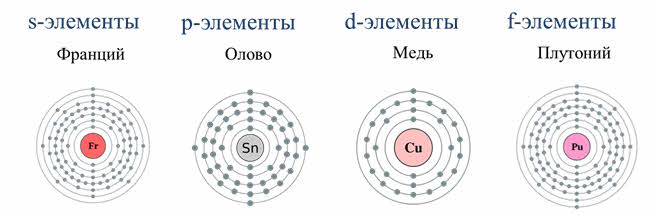
Элементы в периодической системе Менделеева делятся на s-, p-, d-элементы. Это подразделение осуществляется на основе того, сколько уровней имеет электронная оболочка атома элемента и каким уровнем заканчивается заполнение оболочки электронами.
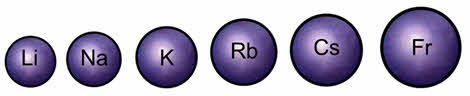
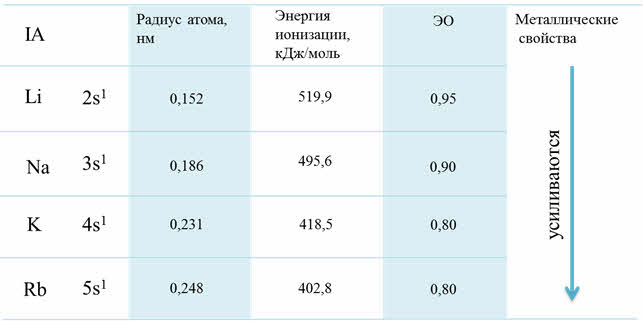
К s-элементам относят элементы IA-группы – щелочные металлы. Электронная формула валентной оболочки атомов щелочных металлов ns1. Устойчивая степень окисления равна +1. Элементы IА-группы обладают сходными свойствами из-за сходного строения электронной оболочки. При увеличении радиуса в группе Li-Fr связь валентного электрона с ядром слабеет и уменьшается энергия ионизации. Атомы щелочных элементов легко отдают свой валентный электрон, что характеризуют их как сильные восстановители.
Восстановительные свойства усиливаются с возрастанием порядкового номера.
К p-элементам относятся 30 элементов IIIA-VIIIA-групп периодической системы; p-элементы расположены во втором и третьем малых периодах, а также в четвертом—шестом больших периодах. Элементы IIIА-группы имеют один электрон на p-орбитали. В IVА-VIIIА—группах наблюдается заполнение p-подуровня до 6 электронов. Общая электронная формула p-элементов ns2np6. В периодах при увеличении заряда ядра атомные радиусы и ионные радиусы p-элементов уменьшаются, энергия ионизации и сродство к электрону возрастают, электроотрицательность увеличивается, окислительная активность соединений и неметаллические свойства элементов усиливаются. В группах радиусы атомов увеличиваются. От 2p-элементов к 6p-элементам энергия ионизации уменьшается. Усиливаются металлические свойства p-элемента в группе с увеличением порядкового номера.
К d-элементам относятся 32 элемента периодической системы IV–VII больших периодов. В IIIБ-группе у атомов появляется первый электрон на d-орбитали, в последующих Б-группах d-подуровень заполняется до 10 электронов. Общая формула внешней электронной оболочки (n-1)dansb, где a=1?10, b=1?2. С увеличением порядкового номера свойства d-элементов изменяются незначительно. У d-эле-ментов медленно происходит возрастание атомного радиуса, также они имеют переменную валентность, связанную с незавершенностью предвнешнего d-электронного подуровня. В низших степенях окисления d-элементы обнаруживают металлические свойства, при увеличении порядкового номера в группах Б они уменьшаются. В растворах d-элементы с высшей степенью окисления обнаруживают кислотные и окислительные свойства, при низших степенях окисления – наоборот. Элементы с промежуточной степенью окисления проявляют амфотерные свойства.
Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p-, d-элементы
Содержание:
Тема строения атома – это место встречи химии и квантовой физики. В атоме всё подчиняется строгим законам, но в то же время атом не совсем понятен для человеческого ума. Например, количество электронов строго равно количеству протонов, но невозможно точно сказать, в каком месте атома находится электрон. Шрёдингер рассматривал электрон как облако с отрицательным зарядом. Большинство своего времени электрон в отдельном участке атома – орбитали.
Все электроны в атоме расположены на своём расстоянии от ядра – в электронной оболочке. Электрон не может приблизиться к ядру, но и отдалиться тоже не может. Дело в том, что у электрона есть свой запас энергии. Чем её меньше, тем ближе от ядра располагается электрон. Электроны с одинаковым уровнем энергии группируются в один слой – энергетический уровень.
Главное квантовое число и энергетический уровень
Квантовые числа — это своеобразный код записи положения электрона в атоме. Если сравнить атом с домом, то квантовые числа – это адрес электрона: этаж, квартира, комната.
Электроны в атоме сосредоточены на энергетических уровнях – «этажах». Их нумеруют числами 1, 2, 3, … или буквами K, L, M, N, O, P, Q. Главное квантовое число n – это и есть номер энергетического уровня.
С удалением от ядра число электронов возрастает. Чем выше энергетический уровень, тем больше электронов на нём находится. Их максимальное число для каждого уровня определяется по формуле:
На внешнем энергетическом уровне не может находиться больше 8 электронов.
В энергетических уровнях также выделяют подуровни. Их количество также соответствует главному квантовому числу. Это напоминает расположение квартир в доме: на первом этаже располагается одна квартира, на втором – две, на третьем – три и т.д.
| Номер уровня (n) и его буквенное обозначение | Количество подуровней | Максимальное количество электронов на уровне |
| 1 К | 1 (s) | 2 |
| 2 L | 2 (s, p) | 8 |
| 3 M | 3 (s, p, d) | 18 |
| 4 N | 4 (s, p, d, f) | 32 |
Орбитальное (побочное), магнитное квантовые числа и форма орбитали
Конкретное место в атоме, «комната», в которой почти постоянно находится электрон, называется орбиталью. Орбитали напоминают облака разной формы из электронов. Подуровни и форму орбиталей обозначают латинскими буквами: s, p, d, f.
Эту схему предложил Бор, она помогает разобраться в строении атома, но не отражает реальной картины. Наши представления об атоме расходятся с реальностью. И выглядит это примерно так:
На первом энергетическом уровне есть только сферическая s-орбиталь. На втором энергетическом уровне появляются три p-орбитали. Их форма напоминает гантель или восьмёрку. На третьем энергетическом уровне уже есть пять d-орбиталей, которые как бы состоят из нескольких лепестков. На четвёртом уровне возникают семь f-орбиталей.
Форму орбиталей обозначают орбитальным (побочным) квантовым числом l (эль). Оно на единицу меньше главного квантового числа, то есть l = n – 1. Тогда получается, что орбитальное число единственной s-орбитали первого энергетического уровня равно нулю. Орбиталь p имеет число 1, орбиталь d – 2, f – 3.
Но как же располагаются орбитали внутри одного подуровня? Дело в том, что движущийся электрон создаёт магнитное поле, в котором по осям x, y, z ориентируются орбитали.
Сферическая s-орбиталь не имеет ориентации в пространстве. Три p-орбитали располагаются в трёх различных проекциях, d – в пяти, f – в семи проекциях. Другими словами, сколько орбиталей одного типа, столько и проекций.
Магнитное квантовое число ml показывает, какие проекции есть у орбитали. Количество таких вариантов определяется по формуле 2l+1.
Для s-орбитали l = 0 и ml = 0, так и получается, что сфера принимает только одно положение в пространстве.
Спин электрона
Еще два квантовых числа – спиновое и проекция спина – характеризуют уникальное квантовое свойство электрона. Спин не имеет аналогов в классической механике. Можно представить, что электрон вращается вокруг своей оси в одну или другую сторону.
Квантовые числа
В атомах первого периода таблицы Менделеева есть один энергетический уровень. В нём один или два электрона движутся по s-единственной орбитали.
В атомах второго периода появляется второй уровень. Он состоит из s-и p-подуровней. Второй s-подуровень – это тоже s-орбиталь, на p-подуровне есть три орбитали, которые по-разному расположены в пространстве. Каждая p-орбиталь вмещает 1 или 2 электрона, поэтому максимально на p-подуровне их может быть 6.
В атомах третьего периода появляется d-подуровень с пятью d-орбиталями, в атомах четвёртого периода – f-подуровень с семью f-орбиталями.
Как заполняются орбитали?
Электроны заполняют орбитали в соответствии с 3 принципами (правилами).
Химия s-, р-элементов
Урок 32. Химия 11 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Химия s-, р-элементов»
Элементы в периодической системе Менделеева делятся на эс, пэ, дэ и эф-элементы. Это разделение осуществляется на основе того, сколько энэргетических уровней имеет электронная оболочка атома и каким уровнем заканчивается заполнение электронной оболочки электронами.
К s-элементам относятся элементы первой А группы – щелочные металлы. Электронная формула щелочных металлов эн-эс-один.
Поэтому для них характерна степень окисления плюс один. Элементы первой А группы обладают сходными свойствами из-за сходного строения электронной оболочки.
Но при увеличении радиуса в группе от лития к францию связь валентного электрона с ядром ослабевает и уменьшается энэргия ионизации. Атомы щелочных металлов легко отдают свой валентный электрон, поэтому они являются сильными восстановителями.
Из-за высокой химической активности щелочные металлы в природе встречаются только в виде соединений. Простые вещества, образованные элементами первой А группы, представляют собой серебристо-белые металлы, которые легко режутся ножом. Все щелочные металлы относятся к лёгким и легкоплавким металлам.
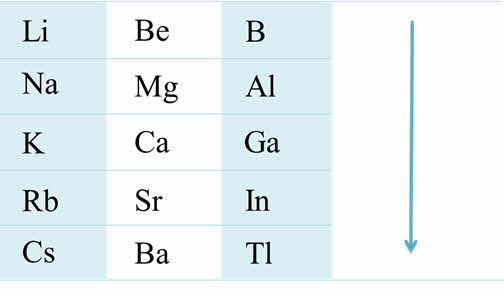
К эс-элементам относятся также элементы второй A группы, из них кальций, стронций, барий называют щелочноземельными металлами. На внешнем энэргетическом уровне у них по два электрона. Из-за своей высокой химической активности они встречаются в природе только в виде соединений. Металлы второй A группы имеют металлический блеск с различными оттенками: от серого до серебристого, температура плавления их выше, чем у щелочных металлов, плотность их меньше пяти грамм на сантиметр кубический, поэтому их относят к легкоплавким металлам.
К p-элементам относятся 30 элементов от третьей А до восьмой А группы периодической системы; пэ-элементы расположены во втором и третьем малых периодах, а также в четвертом, пятом и шестом больших периодах.
Элементы третьей А-группы имеют один электрон на пэ-орбитали. Начиная с четвёртой А и заканчивая восьмой А группой наблюдается заполнение пэ-подуровня до шести электронов. Общая электронная формула пэ-элементов эн-эс-два-эн-пэ-шесть.
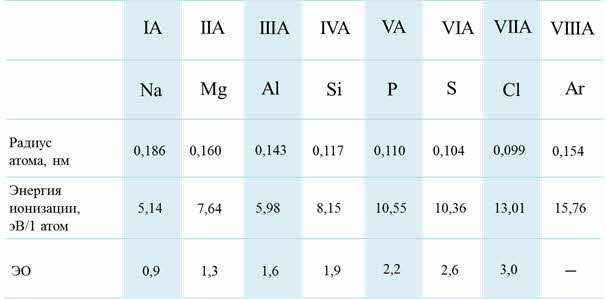
В периодах при увеличении заряда ядра атомные радиусы и ионные радиусы пэ-элементов уменьшаются, энэргия ионизации и сродства к электрону возрастают, электроотрицательность увеличивается, неметаллические свойства элементов усиливаются.
Изменение свойств по периодам
В группах сверху вниз радиусы атомов увеличиваются, энэргия ионизации и сродства к электрону уменьшается, электроотрицательность уменьшается, усиливаются металлические свойства, а неметаллические свойства ослабевают.
Изменение свойств по группам
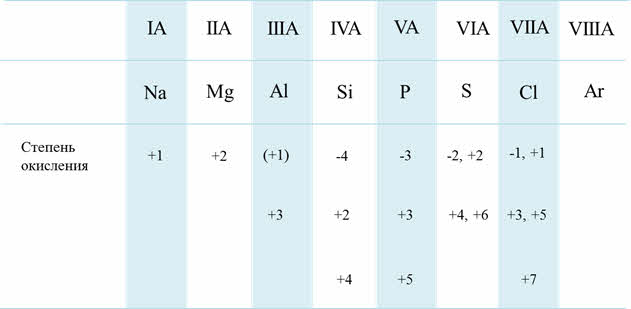
Кроме этого, по периоду с увеличением порядкового номера возрастает высшая степень окисления, а также возможность степеней окисления. Например, у кремния возможны такие степени окисления, как минус четыре, плюс два, плюс четыре; а у хлора – минус один, плюс один, плюс три, плюс пять, плюс семь.
Изменение СО по периоду
Если рассмотреть от первой до третьей А группы, то можно увидеть, что в группе сверху вниз увеличиваются металлические свойства, а также возрастает активность металлов. Например, во второй A группе металлические свойства и активность бария выражены гораздо сильнее, чем у магния.
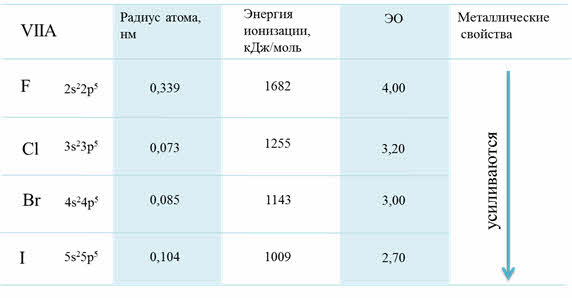
Рассмотрим для примера седьмую A группу – семейство галогенов. В этой группе сверху вниз радиус атома увеличивается, энергия ионизации уменьшается и электроотрицательность также уменьшается.
Возрастание активности металла
Если рассмотреть группы от четвёртой А до седьмой А, то можно проследить, что в этих группах сверху вниз уменьшается активность неметаллов, уменьшается стабильность соединений в высшей степени окисления, возрастает стабильность соединений в более низкой степени окисления. Например, в пятой A группе висмут проявляет металлические свойства и для него, в отличие от фосфора, наиболее характерна степень окисления плюс три.
Изменение свойств в VIIA группе
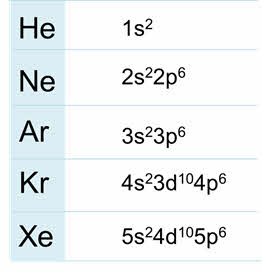
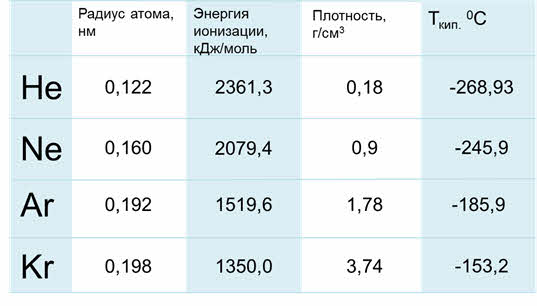
Благородные газы – элементы восьмой A группы. У них завершён внешний энэргетический уровень, причём у гелия два электрона на внешнем уровне, он относится к эс-элементам, а все остальные благородные газы относятся к пэ-элементам.
Радиус атомов у благородных газов увеличиваются сверху вниз, энергия ионизации уменьшается, плотность сверху вниз увеличивается, также как температура кипения.
Таким образом, к эс-элементам относятся элементы первой A и второй A группы, к пэ-элементам относятся элементы от третьей до восьмой А группы. Отличительной особенность этих элементов является то, что их валентные электроны расположены на эс- или пэ-подуровне.
По периоду слева направо у них наблюдается уменьшение радиуса атомов, увеличивается энергия ионизации и энергия сродства к электрону, электроотрицательность увеличивается, металлические свойства ослабевают, а усиливаются неметаллические.
В группах сверху вниз наблюдается иная закономерность: радиусы атомов увеличиваются, уменьшается энергия ионизации и энергия сродства к электрону, электроотрицательность уменьшается, металлические свойства усиливаются, а неметаллические ослабевают.
По каким признакам различают; S- p- d- F- элементы.
Электронные орбитали бывают разных размеров, располагаются на различных расстояниях от ядра и притягиваются к ядру с различными силами. Электроны с орбиталями, близкими по размеру и энергии, образуют электронные слои. Электронные слои называют также энергетическими или электронными уровнями. Начиная от ядра электронные уровни нумеруются следующим образом: 1, 2, 3, 4, 5, 6, 7 или K, L, M, N, O, P, Q.
Целое число n, обозначающее номер уровня, называется главным квантовым числом и характеризует энергию электронов, занимающих данный энергетический уровень. Число заполненных электронами энергетических уровней в атоме численно равно номеру периода периодической системы, в котором данный атом находится. Наибольшее число электронов на данном энергетическом уровне равно N= 2n2, где N- число электронов, n- номер уровня или главное квантовое число. Согласно этой формуле максимальное число электронов на первом энергетическим уровне равно 2, на втором- 8, на третьем- 18, на четвертом- 32. Во внешнем, последнем электронном слое атома не бывает больше 8 электронов.
Строение электронных уровней. Квантовые числа. Принцип Паули.
Блок периоди́ческой табли́цы — это совокупность химических элементов со сходным расположением валентных электронов в атоме. Сходство заключается в том, что валентные электроны с наивысшей энергией у них занимают орбиталь одного типа. Термин впервые появился в работах французского физика Шарля Жане. В один и тот же блок периодической таблицы входят её смежные группы. Названия блоков совпадает с названием характеристической орбитали, на которой располагаются валентные электроны. Эти названия блоков следующие:
Источник: ВИКИПЕДИЯ
Периодический закон и периодическая система Д. И. Менделеева
Материалы портала onx.distant.ru













 2s
2s  1s
1s 
 3s
3s
