Что такое rec в онкологии
Особенности компьютерной томографии с контрастным усилением
КТ с контрастированием – исследование, предполагающее использование рентгеновского излучения в минимальных дозах, а также сопровождающееся введением специального вещества для усиления контрастности здоровых и патологически измененных тканей.
КТ с контрастом выполняется в случаях, когда нужно очень четко разделять нормальные и аномальные структуры в человеческом организме. Такая дифференцировка достигается посредством усиления сигнала от больных тканей. Эффект контрастирования при КТ основывается на том, что большинство опухолей, особенно, злокачественных, кровоснабжается лучше, чем здоровые ткани. Поэтому контрастное вещество будет накапливаться в них, давая картину отличия от прочих тканей. Кроме того, контраст необходим для изучения состояния сосудов – вен, артерий. На снимках КТ контраст будет выделяться белым цветом, что позволит хорошо изучить этот участок.
КТ с контрастом и онкология
В большинстве случаев процедура рекомендуется при подозрении на онкологический процесс, либо для дифференцирования доброкачественной опухоли со злокачественной. Так, рекомендуется КТ с контрастным веществом при:
Томография с контрастированием позволит различить банальную и часто встречающуюся кисту почки от почечно-клеточного рака или доброкачественной липомы, ангиомы. При изучении состояния печени КТ поможет дифференцировать цирроз печени, доброкачественные опухоли и гепатоцеллюлярный рак.
Применяется КТ с контрастным усилением при лимфомах – для отличия их от другого ракового заболевания (лимфогранулематоз) или от простого лимфаденита. Контрастирование позволит установить степень ракового заболевания, его распространенность, поражение регионарных лимфоузлов, наличие метастазов. Часто назначают КТ и при малигнизации доброкачественных опухолей, которая будет заметна по ряду специфических признаков (васкуляризация, увеличение в размерах и т.д.).
Компьютерная томография с контрастным усилением весьма информативна при диагностике внутри просветных тромбов, а также тромбированных аневризм, зон сужения тромбами аорты. Также контраст позволит детально изучить сосудистые мальформации, в том числе – перед оперативным вмешательством по поводу их удаления. Обследование даст полную картину при истончении стенок вен, варикозе глубоких вен и при тромбофлебите, а также при атеросклерозе артерий.
Компьютерная томография с контрастированием применяется при заболеваниях таких зон организма:
До введения препарата врач обязательно уточняет наличие некоторых заболеваний и состояний у пациента, которые могут стать противопоказаниями к процедуре.
До обследования пациент должен сдать ряд лабораторных анализов
(биохимия крови: мочевина (2,4-6,4 ммоль/л) и креатинин (мужчины старше 15 лет — 80-150 мкмоль/л, старше 60 лет — 71-115; женщины старше 18 лет — 53-97, старше 50 лет — 53-106).
При повышении указанных показателей проведение контрастирования не проводится. Количество контрастного вещества рассчитывается исходя из веса человека.
Есть разные способы введения контраста, основные из них таковы:
Противопоказаниями при КТ с конрастными веществами, содержащими йодсодержащие препараты являются:
Строгим противопоказанием к любой КТ является беременность, ведь исследование предполагает использование рентгеновского излучения. Относительное противопоказание – грудное вскармливание: после процедуры в течение 1-2 суток следует исключать кормление грудью. У томографа есть ограничение по весу пациента, и при выполнении КТ у людей с массой тела более 110-120 кг могут возникнуть сложности.
Обычно рекомендуется не выполнять процедуру чаще, чем раз в 6 месяцев. Это ограничение связано не с применением контраста, а с получением лучевой нагрузки во время КТ. Тем не менее, эта нагрузка минимальна, и по жизненным показаниям КТ может быть проведена чаще. Следует помнить, что у ряда пациентов (1-3%) наблюдаются патологические реакции на введение контрастного вещества, что также может ограничить частоту выполнения процедуры. К таким реакциям относятся:
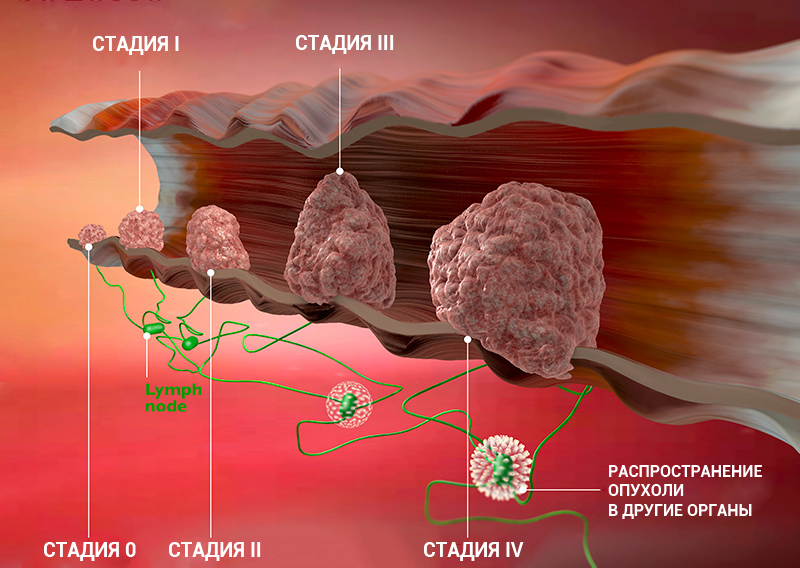
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора:
Что такое rec в онкологии
1. Сокращения:
• Критерии оценки ответа солидных опухолей на лечение (RECIST)
2. Определение:
• Новая версия критериев была опубликована в 2009 г.
• Используются модифицированные критерии RECIST
3. Ключевые принципы:
• Критерии включения пациентов:
о Пациенты с наличием измеряемых проявлений заболевания при первичном исследовании
— Наличие как минимум одного измеряемого очага
о Первичной конечной точкой является оценка объективного ответа опухоли на лечение
• Оценка опухоли при первичном исследовании:
о Обнаружение измеряемых проявлений заболевания
о Выбор целевых и нецелевых очагов
о Измерение целевых очагов
о Опухолевая нагрузка: сумма размеров целевых очагов
• Оценка опухоли при повторном исследовании:
о Измерение целевых очагов
о Оценка нецелевых очагов
о Обнаружение новых очагов
о Расчет ответа опухоли на лечение в данной временной точке
4. Существенные различия между RECIST и RECIST 1.1:
• Внесены изменения в определения следующих понятий:
о Опухолевая нагрузка
о Размер лимфатических узлов
о Прогрессирование заболевания
о Прогрессирование неизмеряемых проявлений заболевания о Подтверждение ответа о Новые очаги



б) Лучевая анатомия:
1. Измеряемые и неизмеряемые проявления заболевания:
• Измеряемые проявления:
о Опухоль с наибольшим диаметром (LD) > 10 мм, измеренным при КТ или МРТ в аксиальной плоскости с интервалом реконструкции 5 мм LD должен превышать толщину среза как минимум в два раза
о Опухоль с наибольшим диаметром (LD) >20 мм, измеренным при рентгенографии органов грудной клетки (если очаг имеет четкий контур и окружен воздушной легочной тканью)
— Предпочтительнее проводить КТ
о Опухоль с наибольшим диаметром (LD) > 10 мм, измеренным клинически (по фотографии) электронным штангенциркулем:
— На фотографиях на кожных покровах следует располагать линейку
— Образования, размер которых не удается с точностью определить с помощью штангенциркуля, следует считать неизмеряемыми
о Размер лимфатических узлов по короткой оси при КТ должен составлять > 15 мм (толщина среза 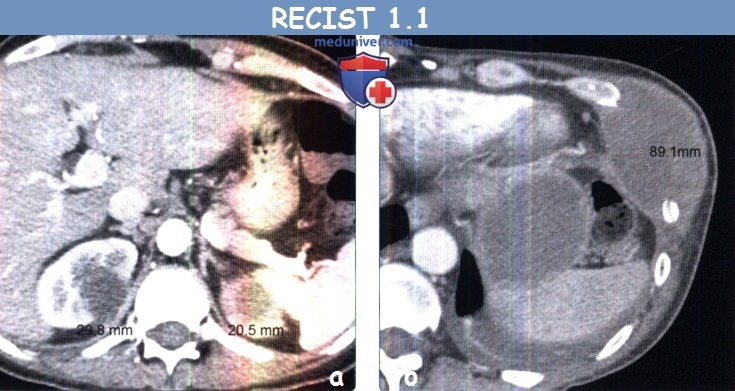
(б) Мужчина 47 лет с метастазами немелкоклеточного рака легкого. При КТ с контрастным усилением в грудной стенке визуализируется метастаз. В соответствии с RECIST 1.1 метастазы в костях считаются целевыми очагами только в том случае, если содержат мягкотканный компонент, отвечающий критериям размера. 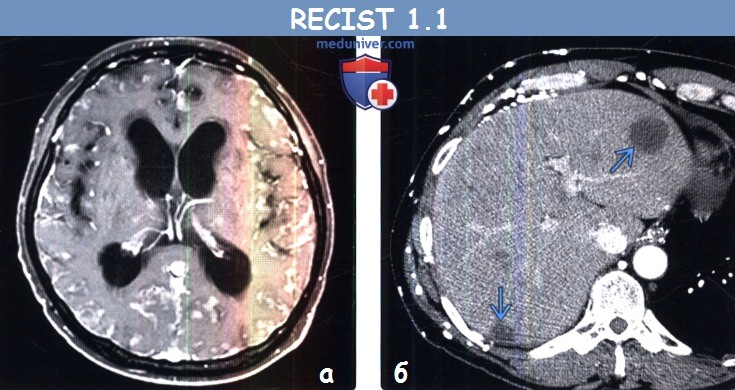
(б) Мужчина 4 7 года с метастазами муцинозной аденокарциномы легкого. При КТ с контрастным усилением в печени визуализируется гиподенсный кистозный метастаз, расцененный как измеряемый очаг. 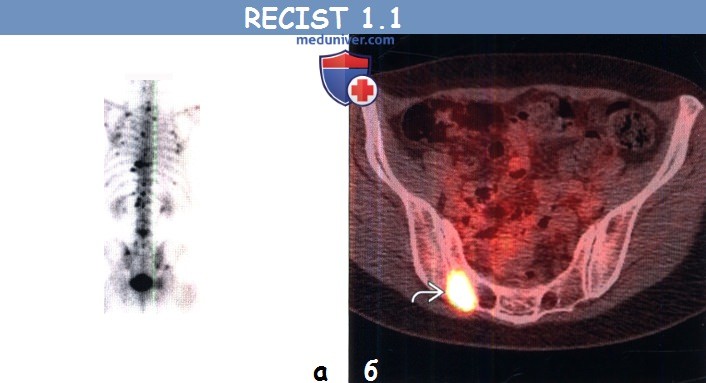
(б) Пациент, страдающий немелкоклеточным раком легкого. При ФДГ-ПЭТ/КТ в правой половине крестца визуализируется очаг с повышенным уровнем поглощения ФДГ. При КТ в данной области патологический участок не выявлен. Остеосцинтиграфия и ПЭТ/КТ могут быть использованы для обнаружения метастазов в костях, но не для их измерения.
1. Ключевые принципы:
• Измерение ранее выбранных целевых очагов (даже если их размер перестал быть наибольшим)
• Оценка всех ранее выбранных нецелевых очагов
• Оценка новых очагов
2. Оценка целевых очагов:
• Расчет SLD:
о Измерение LD каждого целевого очага
о Измерение размера целевых лимфатических узлов по короткой оси
о Если размер образования слишком мал для того, чтобы быть измеренным, считают, что его размер составляет 5 мм (величина по умолчанию)
о Если образование исчезло, считают его размер равным 0
о Распадающиеся или сливающиеся очаги:
— Если целевой очаг распадается на множество меньших по размеру фрагментов, то суммируются LD всех фрагментов
— Если целевые очаги сливаются, то используется LD конгломерата
3. Новые очаги:
• Новые очаги должны быть исключительно опухолевой этиологии:
о Сомнительные очаги, возникновение которых обусловлено разницей в методиках исследования или потенциально неопухолевым процессом, не учитывают
о Не обязательно должны быть измеряемыми
• Сомнительные очаги:
о Оценивают повторно при исследовании в следующей временной точке
о Если наличие очага подтверждается при повторном исследовании, то регистрируется прогрессирование заболевания по дате первого выявления такого очага
• Очаги, обнаруженные за пределами зоны первичного исследования, считают новыми
• Наличие новых очагов, выявленных при УЗИ, следует подтвердить с помощью КТ или МРТ
4. Общий ответ:
• Категории:
о Полный ответ (CR)
о Частичный ответ (PR) о Стабилизация заболевания (SD)
о Оценка невозможна (NE) о Прогрессирование заболевания (PD)
5. ФДГ-ПЭТ и ПЭТ/КТ:
• Критерий «положительного» результата при ПЭТ:
о Уровень поглощения ФДГ образованием в два раза превышает уровень поглощения ФДГ окружающими тканями при выполнении исследования с коррекцией аттенуации сигнала
• Влияние на категории ответа:
о Отрицательный результат при первичной ПЭТ и положительный результат при повторной ПЭТ: прогрессирование заболевания (новый очаг)
о Отсутствие первичной ПЭТ и положительный результат при повторной ПЭТ: прогрессирование заболевания:
— Требует подтверждения наличия очага по данным КТ
При подтверждении наличия очага регистрируется прогрессирование заболевания по дате выполнения первой ПЭТ
о Ключевая особенность:
— При отсутствии первичной ПЭТ и положительном результате повторной ПЭТ наличие выявленного ранее при КТ очага без признаков прогрессии не следует расценивать, как прогрессирование заболевания
6. Ошибочная оценка и случаи, когда оценка невозможна:
• NE: все очаги не могут быть оценены в определенной временной точке:
о Обычно причиной служит потеря данных или низкое качество изображений
о Также данная категория ответа соответствует невозможности оценки некоторой части очагов:
— Исключение: если данные очаги не повлияют на оценку ответа на лечение в определенной временной точке
7. Рецидивирование очагов:
• Влияние рецидивирования очагов зависит от общего ответа:
о Стабилизация заболевания/частичный ответ:
— Образование, подвергшееся обратному развитию, а затем рецидивировавшее, продолжает учитываться
— Категория ответа зависит от состояния других очагов
о Полный ответ
— Рецидивирования образования свидетельствует о прогрессировании заболевания
8. Подтверждение ответа на лечение:
• Частичный ответ/полный ответ:
о Подтверждение необходимо в случае нерандомизированных клинических исследований, в которых эффективность лечения является первичной конечной точкой
о В случае стабилизации заболевания в первой промежуточной точке допускается последующее подтверждение частичного ответа
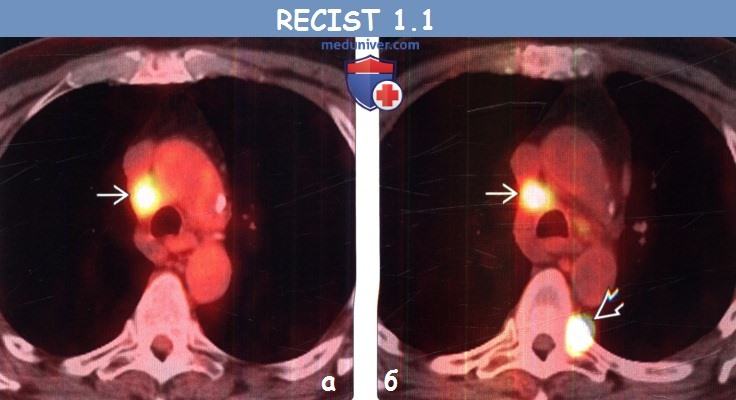
(б) У этого же пациента после курса химиотерапии при ФДГ-ПЭТ/КТ уровень поглощения ФДГ правым паратрахеальным лимфатическим узлом остался без изменений, однако в грудном позвонке возник новый интенсивно накапливающий ФДГ метастаз, что соответствует прогрессированию заболевания. 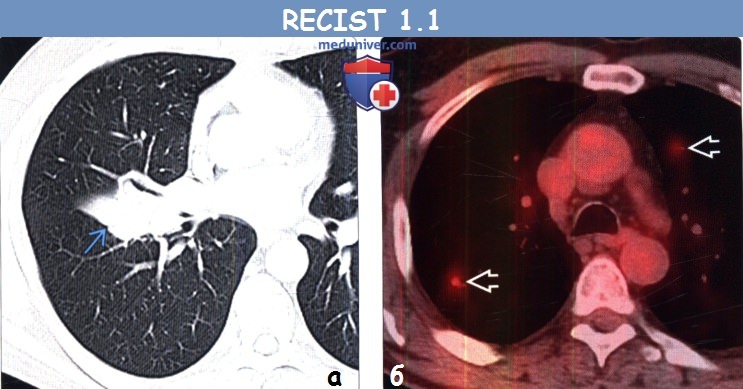
(б) У этого же пациента после курса химиотерапии при ФДГ-ПЭТ/КТ в легких визуализируются новые интенсивно поглощающие ФДГ узелки, соответствующие метастазам. Поскольку данные метастазы при первичной КТ не выявлялись, а при последующей КТ их наличие было подтверждено, то картина соответствует прогрессированию заболевания. 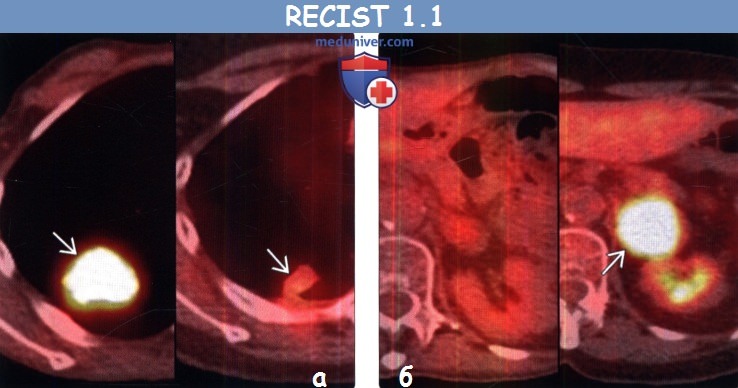
(б) У этого же пациента на совмещенных изображениях при первичной ФДГ-ПЭТ/КТ (слева) и после курса химиотерапии (справа) визуализируется возникновение интенсивно поглощающего ФДГ метастаза в левом надпочечнике, что соответствует прогрессированию заболевания.
в) Список литературы:
1. Litiere S et al: The components of progression as explanatory variables for overall survival in the Response Evaluation Criteria in Solid Tumours 1.1 database. Eur J Cancer. 50(10)4847-53, 2014
2. Nishino M et al: Revised RECIST guideline version 1,1: What oncologists want to know and what radiologists need to know. AJR Am J Roentgenol. 195(2):281-9, 2010
3. van Persijn van Meerten EL et al: RECIST revised: implications for the radiologist. A review article on the modified RECIST guideline. Eur Radiol. 20(6)4 456-67, 2010
4. Eisenhauer EA et al: New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer, 45(2):228-47, 2009
5. Eisenhauer EA et al: Response assessment in solid tumours (RECIST) and supporting papers (version 14). Eur J. Cancer. 45(2):225-310, 2009
Редактор: Искандер Милевски. Дата публикации: 24.2.2019
Стадирование рака
Правильное и эффективное лечение рака напрямую зависит не только от определения его типа, но и от сведений о размере опухоли и степени ее распространения.
Для систематизации такой информации во всем мире принято использовать международную классификацию стадий злокачественных новообразований TNM.
Классификация TNM основана на трех факторах: размер первичной опухоли (T — tumor), вовлеченность регионарных лимфатических узлов (N — nodes) и наличие отдаленных метастазов (M — metastasis). Для каждого вида рака существует своя градация, это определяет подход к лечению, а также прогноз.
Например, для рака молочной железы показатель T определяет диаметр первичной опухоли и ее взаимодействие с окружающими тканями. Опухоль с показателями Т1-Т3, ограниченная молочной железой, определяется размером, а T4, независимо от размера, предполагает распространение опухоли на кожу или грудную стенку. В то же время, для меланомы показатель Т определяется только глубиной прорастания опухоли (инвазия до 1 мм — Т1, а более 4 мм — Т4).
Показатель N для разных опухолей тоже разный, включая количество лимфатических узлов, их размеры, выход за предел капсулы лимфатического узла и т. д. N описывает только регионарные лимфатические узлы, которые отличны для каждой конкретной опухоли. Например, для рака печени лимфатические узлы вдоль ворот печени являются регионарными — ближайшими лимфатическими узлами, собирающими лимфу от области опухоли. Но, в то же время, расположенные рядом мезентериальные или забрюшинные лимфатические узлы, уже не являются регионарными для данной опухоли, а значит, определяются как отдаленные метастазы (М).
Ранее для каждого типа рака стадия определялась взаимоотношением этих трех параметров, но со временем, по мере изучения биологии рака и механизмов развития опухолей, параметров становилось все больше. Сейчас во всем мире используют классификации 8-го пересмотра, которые каждые 5-7 лет выпускают две организации: The Union for International Cancer Control (UICC) и The American Joint Committee on Cancer (AJCC).
Сегодня стадия может быть клинической (с), когда перед операцией мы определяем ее по данным диагностических исследований. Например, при раннем раке молочной железы стадия может выглядеть так — cT2N0M0. А после операции, когда весь материал был подвергнут полноценному гистологическому исследованию, выставляется патоморфологический диагноз (р), и этот же случай может быть рестадирован в pT2pN2а (5/12) M0. Это означает, что клинически неопределяемые метастазы в подмышечных лимфатических узлах были выявлены в 5 из 12 удаленных и исследованных лимфатических узлах.
Существуют и другие нюансы, возьмем, к примеру, стадирование после проведенной неоадьювантной (предоперационной) химиотерапии (префикс yp), когда у женщины с местнораспространенным раком молочной железы сT3N1M0 лечение начали с химиотерапии, а после провели операцию и увидели, что все опухолевые клетки погибли от химиотерапевтического лечения. Это означает, что у данной женщины полный лечебный патоморфоз, а стадироваться эта ситуация будет так — ypT0ypN0, CR.
Помимо TNM, используются также следующие символы:
Стадия может зависеть даже от того, определяется ли в опухолевой ткани вирус папилломы человека (p16), как это происходит в случае с раком ротоглотки.
Не все параметры используются для каждой опухоли, но процесс стадирования становится все сложнее. Этим мы обязаны прогрессу в лечении и большим данным, диктующим необходимость все более разных подходов для разных стадий.
Стадия также определяет прогноз, хотя и здесь подходы сегодня пересматриваются. Благодаря иммунотерапии, многие (ранее «безнадежные») пациенты с самыми последними стадиями онкологического заболевания получают возможность полностью избавиться от него на долгие годы. В то время, как пациенты с третьей стадией других болезней или даже того же вида рака, не отвечающего на иммунотерапию, неуклонно прогрессируют и умирают.
Пример: 2 пациента с идентичным распространением одного и того же вида рака толстой кишки, но у одного из них есть высокий уровень микросателлитной нестабильности — фактора ответа на иммунотерапию, а у другого нет.
Онкология, как и многие другие разделы медицины, сегодня обращена в сторону персонализации. И недалек тот день, когда стадирование будет осуществляться по иному принципу — не по степени анатомического распространения, а исходя из биологических особенностей конкретного заболевания.