Что такое p элементы в химии примеры
P-элементы
P-элементы
 | Cписок значений слова или словосочетания со ссылками на соответствующие статьи. Если вы попали сюда из другой статьи Википедии, пожалуйста, вернитесь и уточните ссылку так, чтобы она указывала на статью. |
Смотреть что такое «P-элементы» в других словарях:
Элементы-индикаторы — элементы, указывающие на наличие м ний и рудных тел. Являются важным поисковым признаком оруденения, когда основные рудообразующие металлы не дают одназначных выводов о ценности геохим. аномалии. Подразделяются на несколько гр.: 1) элементы,… … Геологическая энциклопедия
ЭЛЕМЕНТЫ (КОМПОНЕНТЫ) ПОЛЕЗНЫЕ — составные части полезного ископаемого, представляющие интерес для промышленности. В Э. п. входят элементы главные и второстепенные, включая элементы примеси, элементы спутники и элементы легирующие. Геологический словарь: в 2 х томах. М.: Недра.… … Геологическая энциклопедия
ЭЛЕМЕНТЫ ВТОРОСТЕПЕННЫЕ — присутствующие в руде в низких и чрезвычайно низких содер., но существенно влияющие на промышленную ценность м ния. Обычно не определяют контура рудных залежей. При значительном скоплении Э. в. минимальное бортовое содер. главных полезных… … Геологическая энциклопедия
ЭЛЕМЕНТЫ — ЭЛЕМЕНТЫ (лат. elementa семантическая калька греч. στοιχεία, от στοίχος ряд, собств. член ряда), термин античной философии, первоначально «буквы» (алфавита), затем простейшие начала, элементы (старославянская транскрипция «стихии»). Уже… … Античная философия
ЭЛЕМЕНТЫ-ПРИМЕСИ — химические элементы, присутствующие в минералах других элементов в виде изоморфных примесей или тонких механических включений; иногда извлекаются в качестве попутных или даже основных (напр., золото из пирита) компонентов. В число элементов… … Большой Энциклопедический словарь
Элементы химические — (a. chemical elements; н. chemische Elemente; ф. elements chimiques; и. elementos quimicos) составные части простых и сложных тел, представляющие собой совокупность атомов c одинаковым зарядом атомных ядер и одинаковым числом электронов в … Геологическая энциклопедия
Элементы-примеси — второстепенные элементы в г. п. и рудах, образующие самостоятельные м лы. Многие из них имеют промышленное значение и путем обогащения могут выделяться в концентраты. См. Элементы второстепенные. Геологический словарь: в 2 х томах. М.: Недра. Под … Геологическая энциклопедия
ЭЛЕМЕНТЫ — № 105 110 сверхтяжёлые искусственно полученные радиоакт. хим. элементы. Элементы с ат. номером 104 110 наз. т р а н с а к т и н о и д н ы м и. Элемент № 105 (нуклид с массовым числом А= 261, T1/2=1,6 с) получен в 1970 в Дубне группой Г. H.… … Физическая энциклопедия
ЭЛЕМЕНТЫ КОРАБЛЯ ТАКТИКО-ТЕХНИЧЕСКИЕ — характеризующие его как боевую единицу следующие: элементы нападения артиллерия, торпеда, мина, глубинные бомбы и т. д.; элементы защиты броня, противоминная защита, противохимическая защита; маневренные элементы скорость хода, поворотливость,… … Морской словарь
Что такое p элементы в химии примеры
7. Общая характеристика P-, S-, D-элементов
Элементы в периодической системе Менделеева делятся на s-, p-, d-элементы. Это подразделение осуществляется на основе того, сколько уровней имеет электронная оболочка атома элемента и каким уровнем заканчивается заполнение оболочки электронами.
К s-элементам относят элементы IA-группы – щелочные металлы. Электронная формула валентной оболочки атомов щелочных металлов ns1. Устойчивая степень окисления равна +1. Элементы IА-группы обладают сходными свойствами из-за сходного строения электронной оболочки. При увеличении радиуса в группе Li-Fr связь валентного электрона с ядром слабеет и уменьшается энергия ионизации. Атомы щелочных элементов легко отдают свой валентный электрон, что характеризуют их как сильные восстановители.
Восстановительные свойства усиливаются с возрастанием порядкового номера.
К p-элементам относятся 30 элементов IIIA-VIIIA-групп периодической системы; p-элементы расположены во втором и третьем малых периодах, а также в четвертом—шестом больших периодах. Элементы IIIА-группы имеют один электрон на p-орбитали. В IVА-VIIIА—группах наблюдается заполнение p-подуровня до 6 электронов. Общая электронная формула p-элементов ns2np6. В периодах при увеличении заряда ядра атомные радиусы и ионные радиусы p-элементов уменьшаются, энергия ионизации и сродство к электрону возрастают, электроотрицательность увеличивается, окислительная активность соединений и неметаллические свойства элементов усиливаются. В группах радиусы атомов увеличиваются. От 2p-элементов к 6p-элементам энергия ионизации уменьшается. Усиливаются металлические свойства p-элемента в группе с увеличением порядкового номера.
К d-элементам относятся 32 элемента периодической системы IV–VII больших периодов. В IIIБ-группе у атомов появляется первый электрон на d-орбитали, в последующих Б-группах d-подуровень заполняется до 10 электронов. Общая формула внешней электронной оболочки (n-1)dansb, где a=1?10, b=1?2. С увеличением порядкового номера свойства d-элементов изменяются незначительно. У d-эле-ментов медленно происходит возрастание атомного радиуса, также они имеют переменную валентность, связанную с незавершенностью предвнешнего d-электронного подуровня. В низших степенях окисления d-элементы обнаруживают металлические свойства, при увеличении порядкового номера в группах Б они уменьшаются. В растворах d-элементы с высшей степенью окисления обнаруживают кислотные и окислительные свойства, при низших степенях окисления – наоборот. Элементы с промежуточной степенью окисления проявляют амфотерные свойства.
Химия элементов p блока.



Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Поверхностное натяжение. Абсорбция. Поверхностноактивные, неактивные и инактивные вещества. Ориентация молекул в поверхностном слое и структура биомембран.
26.1. Адсорбция-изменение концентрации вещества на границе раздел фаз. Происходит на любыхмежфазовых поверхностях и адсорбироваться могут любые вещества. Адсорбционное равновесие, т.е.равновесие распределения вещества между пограничным слоем и граничащими фазами, являетсядинамическим равновесиеми быстро устанавливаются. Адсорбция уменьшается с увеличениемтемпературы и покидает поверхность. Поверхностное Натяжениеесть величина, численно равная энергииГиббса, приходящейся на единицу площади поверхностного слоя и численно равная работе, еоторуюнеобходимо совершить для образования единицы поверхности раздела фаз при постоянной температуре.ПН зависит от природы жидкости и температуры(уменьшается с ростом t). Вода имеет самое высокоезначение ПН. ПН сыворотки крови составляет 45,4*10-3Н/м.Пове́рхностные явле́ния— совокупность явлений, обусловленных особыми свойствами тонких слоёввещества на границе соприкосновения фаз. К поверхностным явлениям относятся процессы, происходящиена границе раздела фаз, в межфазном поверхностном слое и возникающие в результате взаимодействиясопряжённых фаз.
26.2. Структура плазматической мембраны:Все биомембраны построены одинаково; они состоят из двух слоев липидных молекул толщиной около 6нм, в которые встроены белки. Некоторые мембраны содержат, кроме того, углеводы, связанные слипидами и белками. Соотношение липиды : белки : углеводы является характерным для клетки илимембраны и существенно варьирует в зависимости от типа клеток или мембран.Компоненты мембран удерживаются нековалентными связями, вследствие чего они обладаютлишь относительной подвижностью, т. е. могут диффундировать в пределах липидного бислоя. Текучестьмембран зависит от липидного состава и температуры окружающей среды. С увеличением содержанияненасыщенных жирных кислот текучесть возрастает, так как наличие двойных связей способствуетнарушению полукристаллической мембранной структуры. Подвижными являются и мембранные белки.Если белки не закреплены в мембране, они ≪плавают≫ в липидном бислое как в жидкости. Поэтому говорят,что биомембраны имеют жидкостно-мозаичную структуру.В то время как ≪дрейф≫ в плоскости мембраны происходит достаточно легко, переход белков с внешнейстороны мембраны на внутреннюю (≪флип-флоп≫) невозможен, а переход липидов происходит крайнередко. Для ≪перескока≫ липидов необходимы специальные белки транслокаторы. Исключение составляетхолестерин, который может легко переходить с одной стороны мембраны на другую.Мембранные липидыВ мембранах содержатся липиды трех классов:фосфолипиды, холестерин и гликолипиды. Наиболее важная группа, фосфолипиды, включаетфосфатидилхолин (лецитин), фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозит исфингомиелин. Холестерин присутствует во внутриклеточных мембранах животных клеток (заисключением внутренней мембраны митохондрий). Гликолипиды входят в состав многих мембран (например, во внешний слой плазматических мембран). В состав гликолипидов входят углеводныефункциональные группы, которые ориентируются в водную фазу.Липиды мембран представляют собой амфифильные молекулы с полярной гидрофильной головкой(голубого цвета) и неполярным липофильным хвостом (желтого цвета). В водной среде они агрегируют засчет гидрофобных взаимодействий и вандерваальсовых сил; Мембранные белки:Протеины могут связываться с мембраной различным путем.Интегральные мембранные белки имеют трансмембранные спирализованные участки (домены), которыеоднократно или многократно пересекают липидный бислой. Такие белки прочно связаны с липиднымокружением.Периферические мембранные белки удерживаются на мембране с помощью липидного ≪якоря»и связаны с другими компонентами мембраны; например, они часто бывают ассоциированы синтегральными мембранными белками.У интегральных мембранных белков фрагмент пептидной цепи, пересекающий липидный бислой, обычносостоит из 21-25 преимущественно гидрофобных аминокислот, которые образуют правую α-спираль с 6 или7 витками (трансмембранная спираль).
Адсорбционные равновесия на неподвижных границах раздела фаз. Физическая адсорбция и хемосорбция. Адсорбция газов на твердых телах. Адсорбция из растворов. Зависимость величины адсорбции от различных факторов. Избирательная адсорбция.
27.1. Физическая афсорбция – это «Обычная» адсорбция в случае, когда требуется подчеркнуть природу сил взаимодействия
27.2. Адсорбция— это, в широком смысле, процесс изменения концентрации у поверхности раздела двух фаз, а в более узком и употребительном — это повышение концентрации одного вещества (газ, жидкость) у поверхности другого вещества (жидкость, твердое тело).Хемосорбция –процесс поглощения сорбтива происходит вследствии его химического взаимодействия с сорбентом.
Классификация дисперсных систем: по степени дисперсности, по агрегатному состоянию фаз, по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсной средой. Природа коллоидного состояния. Молекулярно-кинетические свойства коллоидно-дисперсных систем.
28.1. Дисперсные системы— гетерогенные системы из двух или большего числа фаз с сильно развитойповерхностью раздела между ними. Обычно одна из фаз образует непрерывную дисперсионную среду, вобъеме которой распределена дисперсная фаза (или несколько дисперсных фаз) в виде мелких кристаллов,твердых аморфных частиц, капель или пузырьков.
28.2. Классификация дисперсных систем по силе межмолекулярного взаимодействия:1)лиофобные- слабое взаимодействие между дисперсной фазой и дисперсной средой2)лиофильные- сильное взаимодействие. Коллоидными системами называют двух или многофазные системы, в которых одна фаза находится в видеотдельных мелких частиц, распределенных в другой фазе. Такие ультрамикрогетерогенные системы сопределенной (коллоидной) дисперсностью проявляют способность к интенсивному броуновскомудвижению и обладают высокой кинетической устойчивостью. Имея высокоразвитую поверхность разделафаз и, следовательно, громадный избыток свободной поверхностной энергии, эти системы являются принципиально термодинамически неустойчивыми, что выражается в агрегации частиц, т.е. в отсутствииагрегативной устойчивости. Это системы с очень малой межфазовой энергией, они термодинамическиустойчивы и образуются самопроизвольно.Все молекулярно-кинетические свойства вызваны хаотическим тепловым движением молекулдисперсионной среды, которое складывается из поступательного, вращательного и колебательногодвижения молекул.Молекулы жидкой и газообразной дисперсионной среды находятся в постоянном движении и сталкиваютсямежду собой. Среднее расстояние, проходимое молекулой до столкновения с соседней, называют среднейдлиной свободного пробега. Молекулы обладают различной кинетической энергией.
Познание мира
10 типов химических элементов
Типы химических элементов
В природе можно найти самые разные вещества. Эти вещества обычно не встречаются в чистом виде, а являются результатом комбинации различных элементов или материалов, которые в результате различных реакций, процессов и периодов времени дали начало всем видам материи. Во Вселенной нет ничего, что не являлось бы результатом комбинации атомов, принадлежащих к разным типам химических элементов, которые мы собираемся изучить более подробно.
Однако, прежде чем рассматривать типы химических элементов, давайте сделаем небольшой обзор школьной науки и вспомним, что такое химические элементы.
Мы называем «химическим элементом» материю, которая состоит из одного и того же типа атома, то есть вещества, которое является атомарно чистым. Химические элементы не могут быть разложены на более простые и классифицируются в периодической таблице элементов как чистые материалы Вселенной.
Мы не должны путать элементы с простыми веществами, поскольку в некоторых случаях два или более атомов одного и того же элемента могут составлять молекулы, сгруппированные по-разному, что приводит к изменению некоторых физических свойств рассматриваемого элемента, в этих случаях изотопов. Например, алмаз и углерод — это вещества, состоящие из химического элемента углерода (C), но который организован по-разному и приводит к образованию двух совершенно разных материалов.
Насколько нам известно, химические элементы образуются внутри звезд в результате сложных процессов синтеза и деления атомов, в результате которых образуются все более тяжелые элементы, результат процесса, называемого нуклеосинтезом.
Большинство известных элементов могут быть получены из природы, спонтанно обнаружены или образуют соединения с другими элементами, такими как уран (U), углерод (C), кремний (Si), серебро (Ag) или золото (Au). Другие, однако, производятся в лабораториях, например, америций (Am), берклий (Bk) или кюрий (Cm). Каким бы ни был метод его получения или присутствует ли он в природе, в зависимости от его свойств, рассматриваемый химический элемент будет иметь то или иное применение.
В настоящее время известно около 118 химических элементов, хотя с учетом того, что люди смогли производить новые элементы, расширение таблицы Менделеева — это вопрос времени.
Основные типы химических элементов
Основные типы химических элементов представлены в периодической таблице, системе классификации, созданной русским химиком Дмитрием Менделеевым (1834–1907), заложившим ее основы в 1869 году. Химические элементы визуально упорядочены в зависимости от их свойств и характеристик.
С течением времени и по мере того, как химия сделала важные научные открытия, эта таблица будет последовательно расширяться, достигнув той формы, которую она имеет сегодня, с 118 известными до сих пор элементами.
В настоящее время в этой таблице мы можем найти следующие типы химических элементов:
Металлы
Металлы — это химические элементы, которые, как правило, содержат от одного до трех электронов на последней орбите своего атома, электроны, которые можно легко переносить, превращая их в проводники тепла и электричества.
Металлы обычно податливы и пластичны, с характерным блеском, интенсивность которого зависит от движения электронов, составляющих их атомы. В большинстве случаев металлы остаются твердыми при комнатной температуре, за исключением ртути.
Среди металлов мы находим золото (Au), серебро (Ag), медь (Cu) и алюминий (Al), физические характеристики которых делают их великолепными проводниками электричества, хотя их присутствие в природе очень разнообразно, что отражается в разнице между их массами.
Считается, что 75% химических элементов, существующих в природе — это металлы, а остальные 25% будут состоять из благородных газов, металлоидов и других типов.
В этой категории есть классификации, обнаруживающие актиниды, лантаноиды, переходные металлы, щелочные металлы, щелочноземельные металлы и другие металлы.
Лантаноиды
Элементы лантаноидов находятся в месторождениях, состоящих из многих минералов. Это металлы белого цвета, которые легко окисляются при контакте с воздухом. Среди них мы находим лантан (La), прометий (Pm), европий (Eu) и иттербий (Yb).
Актиниды
Все изотопы актинидов радиоактивны. Среди них мы находим актиний (Ac), уран (U), плутоний (Pu) и эйнштейний (Es).
Переходные металлы
В этой группе есть вещества всех видов, и, согласно ее самой широкой классификации, она будет соответствовать химическим элементам от 21 до 30, от 39 до 48, от 71 до 80 и от 103 до 112, всего сорок и среди них мы найдем ванадий (V), рутений (Ru), серебро (Ag), тантал (Ta) и лоуренсий (Lr).
Щелочные металлы
Щелочные металлы — это группа из шести элементов, состоящая из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Это блестящие мягкие металлы, обладающие высокой реакционной способностью при нормальной температуре и давлении и легко теряющие внешний электрон, расположенный на своей «s» орбитали.
Щелочные почвы
Щелочноземельные металлы — это группа элементов, в которых мы находим бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Щелочные почвы тверже щелочей, они блестят и являются хорошими проводниками электричества. Они менее реактивны, чем щелочные, и действуют как хорошие восстановители. Они обладают способностью образовывать ионные соединения, и все они имеют два электрона на внешней оболочке.
Другие металлы
Это металлические элементы, расположенные в периодической таблице вместе с металлоидами внутри p-блока. Они имеют тенденцию быть мягкими с низкими температурами плавления. Среди них алюминий (Al), индий (In), олово (Sn) и висмут (Bi) среди других.
Не металлы
Неметаллы обычно имеют от пяти до семи электронов на последней орбите, свойство, которое заставляет их приобретать электроны, а не отдавать их, и, таким образом, им удается иметь восемь электронов, которые таким образом стабилизируют их как атомы.
Эти элементы очень плохо проводят тепло и электричество. К тому же они не имеют характерного блеска, не очень пластичны и очень хрупки в твердом состоянии. Их нельзя катать или растягивать, в отличие от металлов.
Большинство из них необходимы для биологических систем, поскольку они присутствуют в органических соединениях, таких как сера (S), углерод (C), кислород (O), водород (H) и йод (I).
Металлоиды
Металлоиды представляют собой промежуточную классификацию между металлами и неметаллами, обладающими свойствами обеих групп. Это связано с тем, что на последней орбите у них четыре атома, что является промежуточным количеством по сравнению с металлами и неметаллами.
Эти химические элементы проводят электричество только в одном направлении, но не в обратном, как в металлах. Примером этого является кремний (Si), металлоид, используемый в производстве полупроводниковых элементов для электронной промышленности благодаря этому свойству.
Другие металлоиды: бор (B), мышьяк (As), сурьма (Sb) и полоний (Po).
Галогены
Галогены — это группа из шести элементов, которые имеют тенденцию образовывать молекулы, состоящие из двух (двухатомных) атомов, которые очень химически активны из-за своей электроотрицательности.
Эти вещества обычно появляются в виде ионов, то есть электрически заряженных молекул, которые в данном случае являются однозначными, сильно окисляющими. Это означает, что галогены являются едкими веществами.
Галогены: фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и тенезе (Ts).
Благородные газы
Благородные газы — это группа из семи газов, естественное состояние которых — газообразное. Обычно они представляют собой двухатомные молекулы с очень низкой реакционной способностью, то есть они не вступают в реакцию с другими элементами, составляющими другие вещества, и по этой же причине они известны как инертные газы. Это потому, что на его последней орбите находится максимальное количество электронов, возможное для этого уровня, всего восемь.
Эта избранная группа элементов состоит из гелия (He), неона (Ne), аргона (Ar), криптона (Kr), ксенона (Xe), радона (Rn) и оганесона (Og), ранее известного как унунокций.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
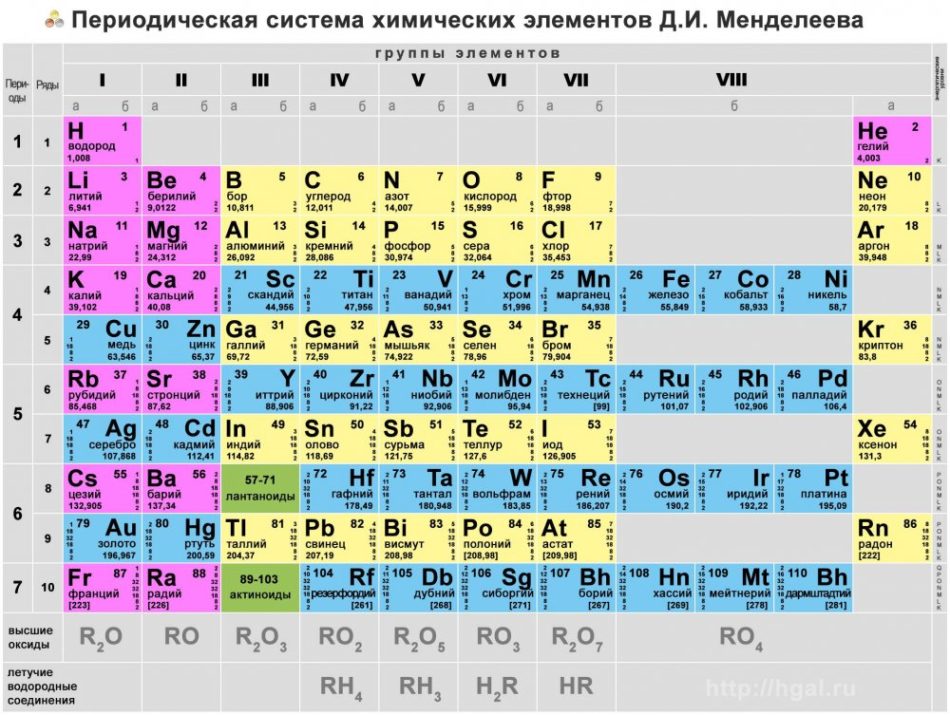
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
Период, группа и электронная конфигурация
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Длина связи
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Основные и кислотные свойства
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Восстановительные и окислительные свойства
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.