Что такое neisseria spp
Н — Нейссерии
Автор раздела: Трубачева Елена Сергеевна, врач – клинический фармаколог, более 15 лет занимающаяся практическими вопросами лечения и профилактики внутрибольничных инфекций и эпидемиологического надзора. Автор множества печатных работ на указанную тематику.
«Идея «Азбуки антибиотиков» вынашивалась в течение трех лет как способ донести сложные вещи максимально понятным языком для тех, кто только начинает постигать этот действительно сложный раздел практической медицины, и дать импульс к дальнейшему изучению, не продираясь через дебри терминологии и смежных дисциплин, теряя интерес по дороге.»
Автор: врач – клинический фармаколог Трубачева Е.С.
Автор: врач – клинический фармаколог Трубачева Е.С.
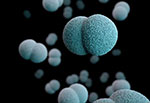
Neisseria (нейссерии)

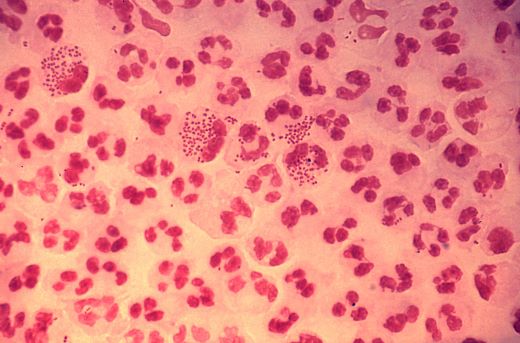
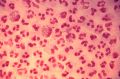
Под микроскопом Neisseria имеют вид кофейных зёрен.
Neisseria обнаруживается в желудке здоровых людей (при условии отсутствия в нём в доминирующем количестве Helicobacter pylori) (Engstrand L., 2012).
Ряд видов нейссерий, в частности N. bacilliformis, N. cinerea, N. elongata, N. flavescens, N. lactamica, N. mucosa, N. perflava, N. polysaccharea, N. sicca, N. subflava, являются непатогенными. Однако эти виды также могут быть ассоциированы с некоторыми заболеваниями.
Neisseria lactamica присутствует в носоглотке многих здоровых детей. Антигены безвредных для человека Neisseria lactamica и Neisseria meningitidis одинаковы, поэтому носительство Neisseria lactamica предположительно предохраняет от развития менингита.
Neisseria в систематике бактерий
Род Neisseria входит в семейство Neisseriaceae, порядок Neisseriales, класс Betaproteobacteria, тип протеобактерии (Proteobacteria), царство Бактерии.
В род Neisseria в настоящее время включены виды: N. animalis, N. animaloris, N. arctica, N. bacilliformis, N. bergeri, N. canis, N. cinerea, N. dentiae, N. dumasiana, N. elongata, N. europea, N. flava, N. flavescens, N. gonorrhoeae, N. iguanae, N. lactamica, N. macacae, N. meningitidis, N. mucosa, N. musculi, N. oralis, N. perflava, N. pharyngis, N. polysaccharea, N. shayeganii, N. sicca, N. skkuensis, N. subflava, N. tadorna, N. wadsworthii, N. weaveri, N. zoodegmatis.
В составе вида Neisseria elongata выделены подвиды: Neisseria elongata subsp. elongata, Neisseria elongata subsp. glycolytica, Neisseria elongata subsp. nitroreducens. В составе вида Neisseria gonorrhoeae — подвид Neisseria kochii, вида Neisseria pharyngis — подвид Neisseria pharyngis subsp. flava.
Нейссерии
Автор: врач – клинический фармаколог Трубачева Е.С.

Автор: врач – клинический фармаколог Трубачева Е.С.
В роду нейссерий присутствуют всего два вида патогенных микроорганизмов – N. meningitidis, он же менингококк, и N. gonorrhoeae, он же гонококк. Все остальные нейссерии являются представителями нормальной микрофлоры человека, обитающей на слизистых оболочках верхних дыхательных путей и урогенитального тракта. Кроме того, носительство этих микроорганизмов распространено и среди теплокровных животных.
Микробиологические аспекты
Основными представителями рода нейссерий являются:
Все нейссерии являются типичными аэробными грамотрицательными кокками, неподвижными, образующими пары или тетрады. Не обладают свойством спорообразования, но менингококк, например, умеет образовывать капсулу. Малоустойчивы во внешней среде, быстро гибнут при высыхании, убиваются практически любым дезинфектантом, и хотя бы с этими микробами у нас почти отсутствует проблема внутрибольничного инфицирования. Правда, ключевое слово «все-таки», «почти», ибо люди остаются людьми, и пациенты не исключение. Но все это, конечно, не касается менингококка, который, в прямом смысле, умеет летать от человека к человеку, передаваясь воздушно-капельным путем, а также через общую вентиляцию, и еще пару лет назад был одним из очень немногих микроорганизмов, которые заставляли надевать СИЗ и сидеть в карантине. О менингококке мы будем говорить отдельно, а сейчас продолжим об общих свойствах всего рода нейссерий.
Практически все представители рода обладают природной чувствительностью к:
И проявляют природную устойчивость к:
Клинические аспекты:
Зачем вообще стоит знать о непатогенных нейссериях?
Во-первых, мы не знаем, что еще принесет доставший всех до печенок ковид и схемы антибактериальной терапии, которые используются в его лечении, в том числе при отсутствии вторичных бактериальных осложнений (автор в очередной раз изобразил двойной фейспалм, но понимает, почему все это происходит – начиная с пресловутых «временных клинических рекомендаций», которые все-таки стали требовать подтверждения присоединения бактериальной инфекции, и заканчивая внутрибольничными инфекциями, которые никуда не делись, потому что к их распространению есть вполне объективные причины, первой и главной из которых автор видит банальную вымотанность до степени проф. выгорания, и тут хоть обвизжись на тему чистоты рук – без нормально выстроенного режима, в том числе отдыха, эпиднадзор в больничных отделениях просто физически недостижим).
Во-вторых, для нейссерий характерна колонизация слизистых, особенно в детском возрасте, когда в зеве ребенка может определяться до двух видов одномоментно, а при детских тонзиллитах нейссерия вырастет практически в 100% случаев, естественно, в ассоциации с другими патогенами, например, со стрептококком. С возрастом носительство снижается, и к совершеннолетию эти микробы будут выделяться не чаще чем в 2% случаев.
В-третьих, у иммунокомпрометированных пациентов (ВИЧ, онкогематология, ковид, точнее, последствия его лечения и т. п.) нейссерии могут вызывать сепсис, пневмонии, менингиты и т. д., и сбрасывать их со счетов сразу, как возможный контаминат, у такой категории пациентов все-таки не стоит.
Теперь приступим к подробному рассмотрению патогенных представителей нейссерий и начнем с гонококка, он же
Neisseria gonorrhoeae
Гонококк является одним из наиболее проблемных микробов в мире и в плане распространенности, и в плане антибиотикорезистентности. Тому есть очень много причин, в том числе и связанных с медицинской помощью, когда однодневные схемы применения антибиотиков, порочные по своей сути, но используемые в странах, имеющих большие проблемы с доступностью медицинской помощи, потащили их туда, где этих проблем нет. Странно, что те же люди, кто прославлял однодневное применение цефтриаксона, практикуемое в странах экваториальной Африки, отказываются пить профильтрованную через салфетку воду из лужи, что практикуется там же.
Микробиологические аспекты
Гонококк относится к грамотрицательным диплококкам, требовательным к своему культивированию, а именно к таким факторам, как температура и pH среды, и лучше всего растущим на кровяных и шоколадных агарах, так как на обычных средах расти не способен. Умеет образовывать капсулоподобные структуры. Является абсолютным паразитом, так как использует для своей жизнедеятельности вещества из организма человека. При этом неустойчив во внешней среде и, например, при кипячении погибает мгновенно. Любой дезинфектант убивает его также очень быстро.
Клинические аспекты
Гонококки могут инфицировать конъюнктиву, ротоглотку, уретру, цервикальный канал, сначала прикрепляясь к эпителиальным клеткам, а затем проникая внутрь. В месте внедрения образуется острый воспалительный процесс в классическом случае (которого вы можете и не увидеть, так как пациент успел наесться «таблеток из Интернета»), сопровождающийся большим количеством гнойного отделяемого. Далее процесс распространяется как в глубину, так и по поверхности пораженных слизистых оболочек, и без адекватного лечения переходит в хроническую форму. Кроме того, часть гонококков умеет поражать и выживать внутри фагоцитирующих клеток и, таким образом мигрируя внутри организма, забирается в самые отдаленные его отделы, то есть диссеминирует и маскируется вообще подо что угодно.
Что поражается чаще всего:
Существуют бессимптомная и манифестирующая формы гонококковой инфекции, расшифровка коих особого смыла не имеет, так как все понятно по названию.
У мужчин обычно появляется симптоматика уретрита, но до четверти случаев течет совершенно бессимптомно, а эпидидимит является наиболее частым осложнением гонорейной инфекции. Более редкими осложнениями являются стриктуры уретры и простатит.
У женщин в половине случаев гонорейная инфекция носит бессимптомный характер, особенно при инфицировании ротоглотки и прямой кишки. При клинически выраженной (манифестированной) форме она проявляется уретритами, цервицитами, проктитами, вульвовагинитами, циститами, фарингитами и конъюнктивитами, протекающими с обильным гноетечением.
Инкубационный период у мужчин может составлять 3-7 дней, у женщин – до 10.
Терапевтические аспекты
Прежде чем начинать лечить, надо выяснить, насколько дикий и симпатичный гонококк достался вашему пациенту, но в современных условиях на это можно сразу не рассчитывать и считать, что очень сильно повезло, если чувствительность утеряна только к пенициллинам. Для качественной диагностики необходимы количественные, то есть с определением MIC, методики микробиологической диагностики, а не качественный диско-диффузионный метод.
В случае неосложненного цервицита, уретрита или поражения прямой кишки необходимо назначать два препарата с активностью как против гонококка, так и против хламидии в виду высокой их ассоциации. При этом фторхинолоны из-за высокой резистентности к ним у N. gonorrhoeae не могут быть препаратами выбора. Поэтому смотрим в сторону комбинации цефалоспоринов с макролидами при условии ОБЯЗАТЕЛЬНОЙ чувствительности к оным. И никаких одноразовых дозировок – только курсовое применение, иначе хронизация процесса будет обеспечена. О том, как работаю дозо- и времязависимые антибактериальные препараты, автор сотрясала воздух тут. И никаких субклинических дозировок! Не смешите гонококк, у него все равно нет чувства юмора.
Во всех остальных случаях мы ориентируемся в лечении только и исключительно на антибиотикограмму. К чему будет зверье чувствительно, то и назначаем в нормальных, то есть бактерицидных дозах. А пациенту убедительно объясняем, почему терапия носит комбинированный характер и почему речи быть не может «об одном единственном уколе». Да не убьется гонококк, учитывая, как он зарывается в эпителий, а далее под него, и уж тем более плавая в фагоцитах по всему организму. Не нужны нам «африканские» схемы, мы же все-таки в более развитом обществе живем и нормальное, надеюсь, медицинское образование получаем, а потому способны объяснить, что раз пневмония или ангина за день не лечатся, то и с гонококком ровно та же история. Автор умышленно не будет писать никаких терапевтических схем, так как в базовых ситуациях они являются справочным материалом, а во всех остальных, коих большинство, персонифицированной медициной, опирающейся на результаты бактериологических исследований.
В заключение хотелось бы сказать, что хотя на улице и ковид, и иной раз даже у врачей создается впечатление, что ничем другим люди уже не болеют, но мы же понимаем, что это не так. И маски не носят, и точно так же барьерными методами защиты при половых актах не пользуются. Бессмертных Маклаудов оказалось намного больше, чем, например, автор еще совсем недавно подозревала, а потому гонококковые инфекции отнюдь не только проблема дерматовенерологов, с ней и к кардиологу, и к травматологу, да даже к клиническому фармакологу могут придти в любой момент, и основным и главным становится посыл пациента в правильном направлении, то есть в бак. лабораторию и к профильному специалисту. А в следующей статье будем вспоминать менингококк.
Микрофлора полости рта
Последнее обновление: 11.11.2021
От состояния микрофлоры полости рта зависит не только здоровье зубов и десен, но и работа органов пищеварения, иммунной и других систем и органов. Давайте разберемся, что представляет собой эта часть организма, что влияет на состояния полости рта и как быстро восстановить нормальную работу микрофлоры.
Что представляет собой микрофлора полости рта?
Удивительно, но во рту здорового человека живет примерно 160 видов микроорганизмов. Вам, наверное, приходилось слышать о том, что «рот — это самое грязное место в организме». Отчасти это утверждение верно: ротовая полость — один из наиболее заселенных отделов тела человека.
Микроорганизмы попадают в ротовую полость с пищей и водой, а также из воздуха. Именно во рту наблюдаются самые благоприятные условия для развития бактерий. В этой части тела всегда стоит равномерная влажность и температура (примерно 37 °С). Обилие питательных веществ, достаточное содержание кислорода, наличие складок в полости рта, межзубных промежутков и десневых карманов, слабощелочная pH провоцируют размножение различных бактерий.
Микроорганизмы неравномерно распределяются в полости рта. Максимальное их количество наблюдается на поверхности зубов и на спинке языка. В одном грамме зубного налета содержится примерно 300 миллиардов микробов, а в слюне — примерно 900 миллионов на 1 миллилитр.
Можно очень долго перечислять все виды бактерий, заселяющих микрофлору полости рта. Важно понимать, что каждый человек уникален, и для оценки «нормальности» микрофлоры нужно знать особенности конкретного организма.
Например, в одном случае большое количество лактобактерий в полости рта будет сохранять зубы, а в другом — образование большого количества молочной кислоты в процессе их жизнедеятельности задержит рост других важнейших микроорганизмов. Снижается число стафилококков, дизентерийных и брюшнотифозных палочек, активизируются кариозные процессы, и микрофлору полости рта придется восстанавливать.
Нарушение микрофлоры полости рта: причины
Дисбактериоз ротовой полости могут спровоцировать самые разные заболевания и проблемы. Нарушение условно-патогенной микрофлоры полости рта чаще всего вызывают такие проблемы, как:
Стадии дисбактериоза
В зависимости от степени развития заболевания стоматологи различают четыре стадии дисбактериоза:
Для запущенных форм дисбактериоза характерны такие симптомы, как:
Методы восстановления микрофлоры полости рта
Лечение дисбактериоза зависит, в первую очередь от характера возбудителя, который определяется на основании экспертизы в стоматологии.
К сожалению, зачастую постановка диагноза при дисбактериозе бывает затрудненной, так как на начальном этапе болезнь никак не проявляет себя. При малейших подозрениях на заболевание стоматолог направляет пациента на мазок с поверхности слизистых, анализы крови и мочи.
В зависимости от диагностированной причины дисбактериоза стоматолог может назначить следующие методы лечения заболевания:
В редких случаях назначаются противогрибковые средства и антибиотики.
Как правило, длительность лечения дисбактериоза составляет 2-4 недели и зависит от состояния здоровья пациента, количества очагов воспаления и имеющихся осложнений заболевания.
Надежным помощником в борьбе с дисбактериозом станет пробиотический комплекс АСЕПТА PARODONTAL*, источник лактобактерий для восстановления микрофлоры полости рта. Этот уникальный комплекс с запатентованными штаммами лактобактерий и витамином D обладает способностью эффективно восстанавливать микрофлору полости рта. Комплекс нормализует бактериальную флору в ротовой полости, устраняет неприятный запах изо рта и препятствует образованию биопленок патогенных микроорганизмов.
Для улучшения эффективности назначенной терапии стоматологи рекомендуют отказаться от вредных привычек (хотя бы на время лечения), пересмотреть рацион, уделив внимание растительной пищи и обязательно ухаживать за полостью рта после каждого приема пищи.
Возможные осложнения дисбактериоза
Каждому пациенту важно внимательно следить за состоянием микрофлоры полости рта. Отсутствие лечения дисбактериоза может привести к таким неприятным заболеваниям, как:
Кроме того, научно доказана тесная взаимосвязь состояния микрофлоры полости рта с состоянием сердечнососудистой системы. В 2008 году в США была доказано, что заболевания периодонта как источник хронического воспаления являются независимым фактором риска возникновения ишемической болезни сердца (ИБС).
Итак, теперь вам известна роль нормальной микрофлоры полости рта в организме человека. Относитесь к себе внимательно, и ваш здоровый организм будет радовать вас каждый день.
Клинические исследования
Проведенные в 10-ом отделении Cтоматологии и челюстно-лицевой хирургии Стоматологического факультета Международного университета Каталонии, доказали, что применение лактобактерий помогает снизить болевые ощущения и трудности с приемом пищи после удаления зубов у взрослых пациентов.
Эффективность применения комплексной терапии в лечении заболеваний пародонта. (кафедра пародонтологии СФ ГБОУ ВПО МГМСУИМ.А.И.Евдокимова. Москва.)
Немерюк Д.А.- доцент, к.м.н., Дикинова Б.С.- аспирант кафедры пародонтологии СФ Царгасова М.О.- аспирант кафедры пародонтологии СФ Яшкова В.В.- аспирант кафедры пародонтологии СФ
кафедра пародонтологии СФ ГБОУ ВПО МГМСУИМ.А.И.Евдокимова. Москва
Топическая терапия при острых тонзиллофарингитах

Рассмотрены роль различных возбудителей в развитии воспалительных заболевания глотки и небных миндалин, а также подходы к лечению воспалительных заболеваний ротоглотки с использованием антисептиков местного действия.
Meaning of different agents in development of inflammatory diseases of pharynx and palatine tonsils was considered, as well as approaches to treatment of fauces inflammatory diseases using antiseptics with local effect.
Микробиота слизистых оболочек, которая представлена сообществами микроорганизмов в виде биопленок, гомеостатична и играет положительную роль в обменных процессах на слизистой оболочке и защите от внешних патогенов. В организме человека специфическое преимущество такой организации микроорганизмов заключается в обеспечении гомеостаза органов, функциональность которых зависит от населяющих их микробов. Здоровый вид кожи, нормальное пищеварение и, конечно, устойчивость к внешней инфекции (состояние иммунитета) человека во многом определяется стабильностью, можно сказать, «здоровьем», его микрофлоры [2].
Макроорганизм и его микрофлора в нормальных условиях находятся в состоянии эубиоза, сложившегося в процессе эволюции. При изменении баланса участия микроорганизмов в физиологических процессах на слизистых оболочках или коже организма-хозяина нарушается гомеостаз метаболических процессов, стабильность иммунной системы. Если возмущение превосходит компенсаторные ресурсы организма, происходит неконтролируемый каскад различных физиологических, биохимических и иммунных процессов с клиническими проявлениями в виде симптомокомплексов. Кишечные, кожные, кардиоваскулярные, мочеполовые и другие заболевания причинно-следственно связаны с изменением микрофлоры местной локализации и кишечной, как депо микроорганизмов в теле человека [22].
_250.gif)
Эти современные знания о биопленках важны и для понимания роли микрофлоры верхних дыхательных путей в здоровье организма, и принципах лечения острых респираторных вирусных заболеваний. Микрофлора глотки многочисленна и вариабельна и в норме сходна с микрофлорой пищеварительного и респираторного трактов. В ее составе у здоровых людей постоянно обнаруживают β-гемолитические и негемолитические стрептококки, микрококки, эпидермальный стафилококк, нейссерии, дифтероиды, псевдодифтерийные бактерии, вейлонеллы, бактероиды, актиномицеты, сапрофитические трепонемы, микоплазмы. Факультативными для глотки являются: золотистый стафилококк, β-гемолитический стрептококк, клебсиелла, пневмонии и др. энтеробактерии, кандиды, нокардии, а также гемофильная палочка [13].
Постоянные микроорганизмы относятся к комменсалам, и их спектр сформировался благодаря эволюционно сложившимся отношениям симбиоза и антагонизма между самими микроорганизмами и их взаимоотношениями с макроорганизмом. В разнообразии видов здесь доминируют бактерии. Простейшие и вирусы представлены значительно меньшим числом видов. В норме от микроорганизмов свободны кровь, ликвор, синовиальная жидкость, костный мозг, брюшная полость, плевральная полость, матка [22].
В полости рта находится больше различных видов бактерий, чем в остальных отделах желудочно-кишечного тракта, и это количество, по данным разных авторов, составляет от 160 до 300 видов. Бактерии попадают в полость рта с воздухом, водой, пищей — так называемые транзитные микроорганизмы, время пребывания которых ограничено. А постоянная (резидентная) микрофлора, образующая сложную и стабильную экосистему полости рта и глотки, — это 30 видов микроорганизмов, которые выполняют ряд функций: с одной стороны, они участвуют в переваривании пищи, оказывают большое позитивное влияние на иммунную систему, являясь мощными антагонистами патогенной флоры; с другой стороны, они служат возбудителями и главными виновниками основных стоматологических и оториноларингологических заболеваний [5].
В развитии воспалительных заболевания глотки и небных миндалин ведущую роль занимают микроорганизмы, вегетирующие на слизистых ротовой полости и глотки. Следует отметить их разнообразие, среди которого аэробные, а также факультативные и облигатные анаэробные микроорганизмы, представленные грамотрицательными и грамположительными микроорганизмами. Значение микроорганизмов в возникновении воспалительных заболеваний тонзилло-фарингеальной зоны очень велико. Ключевыми факторами в развитии гнойного воспаления являются нарушение симбиоза между макро- и микроорганизмами, приобретение патогенных свойств микроорганизмами. Увеличение критического числа микробных тел, возрастание их инвазивности, выработка экзо- и эндоферментов, продуктов метаболизма способствуют формированию патологического очага и его распространению [1, 6].
Важно то, что это разнообразие микроорганизмов представляет собой оптимальные возможности для передачи детерминант резистентности, а в качестве резервуара будет в этом случае выступать нормальная микрофлора человека. Использование как системных, так и топических антибиотиков в случаях, когда они не показаны, вносит значительный вклад в этот процесс и способствует распространению в популяции микроорганизмов, устойчивых к антибиотикам [6, 9].
Инфекционные заболевания глотки — тонзиллиты и тонзиллофарингиты — большая группа заболеваний, различных по этиологиям, клиническим проявлениям, а также морфологическим и патоморфологическим признакам. Объединяющим фактором здесь служат микроорганизмы [2, 10].
Имеется прямая взаимосвязь между состоянием иммунной системы и активацией непатогенной флоры и/или оппортунистической микрофлоры полости рта (орроrtonus — удобный). Оппортунистические микроорганизмы активируются в условиях, удобных для них, — это иммунодефицитные состояния. Когда местные или системные механизмы нарушены, развивается оральный кандидоз, обусловленный дрожжеподобными грибами, присутствующими во рту у здоровых людей.
Самую большую группу постоянно обитающих в полости рта бактерий представляют кокки — 85–90% от всех видов. Они обладают значительной биохимической активностью, разлагают углеводы, расщепляют белки с образованием сероводорода.
Стрептококки являются основными обитателями полости рта: S. mutans, S. mitis, S. sanguis. Большинство из них — факультативные анаэробы, но встречаются и облигатные анаэробы (пептококки). Кислоты, продуцируемые стрептококками, подавляют рост некоторых гнилостных микроорганизмов, попадающих в полость рта из внешней среды. В зубном налете и на деснах здоровых людей присутствуют также стафилококки — St. epidermidis, иногда St. aureus [2].
Верхние отделы дыхательных путей несут особенно высокую микробную нагрузку, так как они анатомически приспособлены для осаждения бактерий из вдыхаемого воздуха. Помимо обычных негемолитических и зеленящих стрептококков, непатогенных нейссерий, стафилококков и энтеробактерий, в носоглотке можно обнаружить менингококки, пиогенные стрептококки, пневмококки и бордетеллы. Следует отметить, что указанные отделы у новорожденных обычно стерильны и колонизируются в течение 2–3 сут. По мере совершенствования защитных механизмов вероятность носительства патогенных бактерий снижается, и их сравнительно редко выделяют уже у подростков.
На состав микробных сообществ различных полостей организма влияют самые разнообразные факторы: чистота вдыхаемого воздуха, наличие пыли, химических и бактериальных загрязнений. Однако наибольшее воздействие оказывают заболевания, патогенез которых включает изменения физико-химических свойств эпителиальных поверхностей и прием антимикробных препаратов.
Стрептококки группы A (Str. pyogenes) — обычно вызывают фарингит, инфекцию кожи и мягких тканей, реже пневмонию и послеродовой сепсис, постинфекционные осложнения ревматизма и острый гломерулонефрит (ОГН). Они имеют много вирулентных факторов, включая антифагоцитарный М-протеин и тонкую капсулу из гиалуроновой кислоты, а также группу внеклеточных токсинов и ферментов, в том числе пирогенный токсин, стрептолизин, стрептокиназу и ДНКазы.
Тонзиллофарингит — рутинная инфекция среди взрослых и детей старше 3 лет, она дает 20–40% всех случаев острых фарингитов, передается от человека к человеку респираторным путем, а в ряде случаев и с пищей. Инкубационный период составляет в среднем 14 сут, после чего появляются боль в горле, лихорадка, озноб, плохое самочувствие, иногда тошнота, рвота и боль в животе. Симптомы весьма разнообразны, варьируя от минимальных до ярко выраженных с увеличением миндалин, гнойный налет отмечается на миндалинах и задней стенке глотки, шейные лимфатические узлы увеличены и болезненны. Обычно неосложненный стафилококковый фарингит длится 3–5 дней. Гнойные осложнения, нечастые из-за широкого применения антибиотиков, включают острый средний отит, синусит, перитонзиллярный или заглоточный абсцесс, менингит, воспаление легких, бактериемию, эндокардит [1, 2, 10].
В этиологии острого тонзиллофарингита участвуют как вирусы (риновирусы, ротавирусы, вирусы парагриппа, вирусы Коксаки), так и бактерии (стрептококки групп А, C, G, стафилококки, нейссерии, коринебактерии, спирохеты, листерии). Среди возбудителей бактериальной природы наибольшее значение принадлежит β-гемолитическому стрептококку группы А (БГСА, Streptococcus pyogenes), встречающемуся в 5–30% случаев острого тонзиллофарингита и обострения хронического тонзиллофарингита [12, 13].
Наиболее значимым бактериальным возбудителем острого тонзиллита является БГСА. Реже острый тонзиллит вызывают вирусы, стрептококки групп C и G, Arcanobacterium haemolyticum, Neisseria gonorrhoeae, Corynebacterium diphtheria (дифтерия), анаэробы и спирохеты (ангина Симановского–Плаута–Венсана), крайне редко — микоплазмы и хламидии [32]. В соответствии с Международной классификацией болезней 10-го пересмотра выделяют стрептококковый фарингит (J02.0), стрептококковый тонзиллит (J03.0). В зарубежной литературе широко используются взаимозаменяемые термины «тонзиллофарингит» и «фарингит». В России используется термин «стрептококковый тонзиллит», под которым понимается тонзиллит (ангина) или фарингит, вызванный БГСА.
БГСА передается воздушно-капельным путем. Источниками инфекции являются больные и, реже, бессимптомные носители. Инкубационный период при остром БГСА-тонзиллите составляет от нескольких часов до 2–4 дней. Хотя острый тонзиллит считается инфекционным заболеванием, стрептококковую ангину можно рассматривать как обострение хронического тонзиллита.
Золотым стандартом определения БГСА в полости рта, а значит, для назначения антибактериальной терапии, является Стрептатест. Чувствительность данного теста составляет по данным многоцентровых клинических исследования [19] 97,3%, а специфичность 95,3%. Современные тестовые системы позволяют получать результат через 15–20 минут с высокой специфичностью (95–100%), но меньшей, чем при культуральном исследовании, чувствительностью (60–95%). Экспресс-методы дополняют, но не заменяют культуральный метод. Кроме того, только при выделении возбудителя можно определить его чувствительность к антибиотикам [2, 19].
В России проблема нерационального использования антибиотиков при инфекциях верхних дыхательных путей осложняется и возможностью их безрецептурного приобретения пациентами и использования для самолечения. Польза от применения антибиотиков при фарингите весьма незначительна. Согласно результатам метаанализа, у 90% больных симптомы исчезают в течение недели независимо от приема антибиотиков. Антибиотики могут сокращать продолжительность симптомов менее чем на сутки. Более того, вероятность повторного обращения в медицинское учреждение по поводу фарингита у лиц, получавших антибиотики, выше, чем у пациентов, не принимавших их. При этом следует помнить, что антибактериальные препараты являются потенциально токсичной фармакологической группой и обусловливают до 25–30% всех побочных эффектов лекарственных средств [4, 7, 9, 11].
Согласно данным исследователей, системная антибактериальная терапия показана только при подтвержденной бактериальной этиологии фарингита. Согласно международным рекомендациям (Mac Isaac, 1994) [20], клинические критерии бактериальной этиологии фарингита следующие: воспаление миндалин, увеличение шейных лимфатических узлов, лихорадка и отсутствие кашля. Если у пациента присутствуют все 4 критерия, то антибактериальная терапия может назначаться эмпирически. Наличие двух или трех из перечисленных критериев + положительный тест на стрептококк группы А являются показанием к назначению антибиотиков. Пациентам, у которых отмечен один из указанных критериев или не было ни одного, не требуются постановка теста на стрептококковый антиген и проведение антибактериальной терапии.
Известно, что примерно 70% фарингитов вызываются вирусами, среди которых отмечают риновирусы, коронавирусы, среди бактериальных возбудителей острого фарингита ведущая роль принадлежит БГСА: 15–30% случаев заболевания у детей и 5–17% случаев у взрослых, относительно редко (
ФГБУ НКЦО ФМБА России, Москва