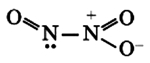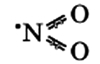Что такое n2o какой оксид
Оксид азота I: строение и химические свойства
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
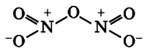
Строение молекулы оксида азота (I) нельзя описать методом валентных связей. Так как оксид азота (I) состоит из двух, так называемых резонансных структур, которые переходят одна в другую:
Общую формулу в таком случае можно задать, обозначая изменяющиеся связи в резонансных структурах пунктиром:
Получить оксид азота (I) в лаборатории можно разложением нитрата аммония:
Химические свойства оксида азота (I)
N2O + Mg → N2 + MgO
Еще пример : оксид азота (I) окисляет углерод и фосфор при нагревании:
2. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя.
3. Как несолеобразующий оксид, при обычных условиях с основаниями, основными оксидами, амфотерными оксидами, кислотными оксидами, кислотами и амфотерными гидроксидами оксид азота (I) не реагирует:
Оксид азота II: получение и химические свойства
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (II)
Оксид азота (II) NO – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
FeCl2 + NaNO3 + 2HCl → FeCl3 + NaCl + NO + H2O
2HNO3 + 2HI → 2NO + I2 + 2H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака :
Химические свойства
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
3. Как несолеобразующий оксид, при обычных условиях с основаниями, основными оксидами, амфотерными оксидами, кислотными оксидами, кислотами и амфотерными гидроксидами оксид азота (II) не реагирует:
Оксид азота (II)
Оксид азота (II)
| Оксид азота(II) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид азота(II) |
| Химическая формула | NO |
| Отн. молек. масса | 30.0061 а. е. м. |
| Молярная масса | 30.0061 г/моль |
| Физические свойства | |
| Плотность вещества | 0.00134 (газ) г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −163.6 °C |
| Температура кипения | −151.7 °C |
| Энтальпия (ст. усл.) | 81 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0,01 г/100 мл |
| Классификация | |
| номер CAS | [10102-43-9] |
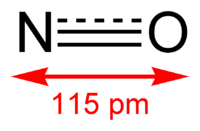
Окси́д азо́та (II) NO (моноксид азота, окись азота, нитрозил-радикал) — несолеобразующий оксид азота. Он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Наличие неспаренного электрона обусловливает склонность NO к образованию слабосвязанных димеров N2O2. Это непрочные соединения с ΔH° димеризации = 17 кДж. Жидкий оксид азота (II) на 25% состоит из молекул N2O2, а твердый оксид целиком состоит из них.
Содержание
Получение
Оксид азота(II) — единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах:
и тотчас же реагирует с кислородом:
При понижении температуры оксид азота(II) разлагается на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты.
В лаборатории его обычно получают взаимодействием 30%-ной HNO3 с некоторыми металлами, например, с медью:
Более чистый, не загрязнённый примесями NO можно получить по реакциям:
Промышленный способ основан на окислении аммиака при высокой температуре и давлении при участии Pt, Cr2O3 (как катализаторов):
Химические свойства
При комнатной температуре и атмосферном давлении окисление NO кислородом воздуха происходит мгновенно:
Для NO характерны также реакции присоединения галогенов с образованием нитрозилгалогенидов, в этой реакции NO проявляет свойства восстановителя:
В присутствии более сильных восстановителей NO проявляет окислительные свойства:
В воде NO мало растворим и с ней не реагирует, являясь несолеобразующим оксидом.
Физиологическое действие
Как и все оксиды азота (кроме N2O), NO — токсичен, при вдыхании поражает дыхательные пути.
За два последних десятилетия было установлено, что эта молекула NO обладает широким спектром биологического действия, которое условно можно разделить на регуляторное, защитное и вредное. NO, являясь одним из мессенджеров, участвует в регуляции систем внутри- и межклеточной сигнализации. Оксид азота, производимый клетками эндотелия сосудов, отвечает за расслабление гладких мышц сосудов и их расширение(вазодилатацию), предотвращает агрегацию тромбоцитов и адгезию нейрофилов к эндотелию, участвует в различных процессах в нервной, репродуктивной и иммунной системах. NO также обладает цитотоксическими и цитостатическими свойствами. Клетки-киллеры иммунной системы используют оксид азота для уничтожения бактерий и клеток злокачественных опухолей. С нарушением биосинтеза и метаболизма NO связаны такие заболевания, как ассенциальная артериальная гипертензия, ишемическая болезнь сердца, инфаркт миокарда, первичная легочная гипертензия, бронхиальная астма, невротическая депрессия, эпилепсия, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона), сахарный диабет, импотенция и др.
Клиренс NO (скорость очищения крови от NO в процессе его химических превращений) происходит путем образования нитритов и нитратов и составляет в среднем не более 5 секунд. В клиренс могут быть вовлечены промежуточные ступени, связанные со взаимодействием с супероксидом или с гемоглобином с образованием пероксинитрита. Оксид азота может быть восстановлен NO-редуктазой – ферментом, тесно связанным с NO-синтазой.
Применение
Оксиды азота
Азот образует несколько оксидов:
Все оксиды азота, за исключением N2O, являются ядовитыми веществами.
Оксид азота N2O (I)
Строение молекулы линейное:
Оксид азота NO(II)
Молекула имеет вид:
Оксид азота NO(II) димеризуется (образуется новое вещество путём соединения двух структурных элементов) только при низких температурах.
В природе NO(II) образуется во время грозы в результате взаимодействия азота с кислородом при высокой температуре:
N2+O2=2NO.
Монооксид азота используют для получения азотной кислоты.
Оксид азота N2O3(III)
Оксид азота N2O3(III) является кислотным оксидом, в значительной степени диссоциирует и реагирует со щелочами:
N2O3 ↔ NO2+NO
N2O3+2NaOH = 2NaNO2+H2O
Оксид азота N2O3(III) взаимодействует с водой с образованием азотистой кислоты:
N2O3+H2O = 2HNO2
Азотистая кислота является слабой кислотой, и существует только в водном растворе.
Оксид азота NO2(IV)
Связи N-O располагаются под углом друг к другу, при этом они носят промежуточный «полуторный» характер, при этом имеется еще и один неспаренный электрон, как и у NO (см. выше).
При н.у. оксид азота NO2(IV) является ядовитым газом (хорошо растворимым в воде) бурого цвета, с характерным запахом.
При нагревании до 50°C неустойчивая азотистая кислота не образуется:
3NO2+H2O = 2HNO3+NO
В промышленных условиях оксид азота NO2(IV) получают путем окисления NO кислородом:
2NO+O2=2NO2
В лабораторных условиях оксид азота NO2(IV) получают окислением меди азотной кислотой (концентрированной), либо разложением нитрата свинца (меди):
Cu+4HNO3(конц) = Cu(NO3)2+2NO2↑+2H2O
2Pb(NO3)2 = 2PbO+4NO2↑+O2↑
Оксид азота NO2(IV) применяют в производстве азотной кислоты.
Оксид азота N2O5(V)
Оксид азота N2O5(V) (азотный ангидрид, пентаоксид диазота) является кристаллическим веществом белого цвета, легко разлагающееся при нормальных условиях:
2N2O5 = 4NO2+O2
Оксид азота N2O5(V) является кислотным оксидом, который при растворении в воде образует азотную кислоту:
N2O5+H2O = 2HNO3
Оксиды азота N2O3 и N2O5 практического применения не имеют.
Другие соединения азота:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Оксиды азота. Общая характеристика, химические свойства.
Важно знать, что все оксиды азота токсичны!
Более детально изучить химические свойства предлагаю при помощи таблицы, в которой собраны все необходимые реакции для сдачи ЕГЭ.
Солеобразующие оксиды азота
N2O5
с характерным острым запахом;
Хорошо растворяется в воде;
Хорошо растворяется в воде;
3) Получение в лаборатории
4) Получение в промышленности
5) Химические свойства
1) Разложение:
2) C кислотами:
3) С металлами:
4) С неметаллами:
В присутствии воды реакция идет (образование HNO3):
5) С солями:
6) С оксидами:
7) C основаниями:
2NO2 + 2KOH = KNO3 + KNO2 + H2O
1) Разложение:
2) С кислотами:
3) С металлами:
4) С неметаллами:
5) С солями:
6) С оксидами:
7) С основаниями:
1) Используется при производстве H2SO4 и HNO3;
2) Окислитель в жидком ракетном топливе;
4) Токсичен, вызывает отек легких.
1) Применение ограничено из-за взрывоопасной природы оксида азота (V);
2) Используется в качестве нитрующего агента (в органической химии).
Следующее занятие будет посвящено задачам по этой теме.