Что такое mno2 в химии
Диоксид марганца
Диоксид марганца
| Диоксид марганца | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Диоксид марганца |
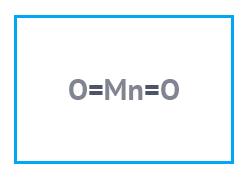
| Химическая формула | MnO2 |
| Отн. молек. масса | 86,9368 а. е. м. |
| Молярная масса | 86,9368 г/моль |
| Физические свойства | |
| Плотность вещества | 5,026 г/см³ |
| Состояние (ст. усл.) | черные тетрагональные кристаллы |
| Термические свойства | |
| Температура разложения | 535 °C |
| Энтальпия (ст. усл.) | -521,5 кДж/моль |
| Химические свойства | |
| Растворимость в воде | в воде 89,9 (при 0°С) г/100 мл |
| Классификация | |
| номер CAS | [1313-13-9] |
Диоксид марганца (MnO2, оксид марганца(IV), «двуокись марганца» (устар.)) — порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко распространённое в земной коре.
Содержание
Химические свойства
При обычных условиях ведет себя довольно инертно. При нагревании с кислотами проявляет окислительные свойства, например, окисляет концентрированную соляную кислоту до хлора:
С серной и азотной кислотами MnO2 разлагается с выделением кислорода:
При взаимодействии с сильными оксилителями диоксид марганца окисляется до соединений Mn 7+ и Mn 6+ :
Диоксид марганца проявляет амфотерные свойства. Так, при окислении сернокислого раствора соли MnSO4 перманганатом калия образуется черный осадок соли Mn(SO4)2. При сплавлении с щелочами и основными оксидами MnO2 выступает в роли основного оксида, образуя соли манганиты:
Получение
В лабораторных условиях получают термическим разложением перманганата калия.
Также можно получить реакцией перманганата калия с пероксидом водорода.
Литература
См. также
Полезное
Смотреть что такое «Диоксид марганца» в других словарях:
марганца диоксид — mangano(IV) oksidas statusas T sritis chemija formulė MnO₂ atitikmenys: angl. manganese black; manganese dioxide; manganese(IV) oxide rus. марганца диоксид; марганца(IV) оксид; марганцевая черная ryšiai: sinonimas – mangano dioksidas sinonimas –… … Chemijos terminų aiškinamasis žodynas
марганца(IV) оксид — mangano(IV) oksidas statusas T sritis chemija formulė MnO₂ atitikmenys: angl. manganese black; manganese dioxide; manganese(IV) oxide rus. марганца диоксид; марганца(IV) оксид; марганцевая черная ryšiai: sinonimas – mangano dioksidas sinonimas –… … Chemijos terminų aiškinamasis žodynas
МАРГАНЦА ОКСИДЫ — MnО, Mn2 О 3, MnО 2, Mn3 О 4, Mn2 О 7, Mn5 О 8. Кроме Mn2 О 7, все оксиды кристаллы, не раств. в воде. При нагр. высших оксидов отщепляется О 2 и образуются низшие оксиды: При выдерживании на воздухе или в атмосфере О 2 выше 300 °С MnО и Mn2… … Химическая энциклопедия
Оксид марганца(IV) — Общие … Википедия
МАРГАНЕЦ (химический элемент) — МАРГАНЕЦ (лат. Manganum), Mn, химический элемент с атомным номером 25, атомная масса 54,9380. Химический символ элемента Mn произносится так же, как и название самого элемента. Природный марганец состоит только из нуклида (см. НУКЛИД) 55Mn.… … Энциклопедический словарь
Пиролюзит — Формула MnO2 Цвет Стальной серый, голубовато серый Цвет черты Чёрная Блеск Полуметаллический … Википедия
ЭЛЕКТРОСИНТЕЗ — (электрохимический синтез), способ получения хим. соед. в процессе электролиза. В качестве анодов обычно используют оксиды Pb(IV), Ni, Mn(IV) и др. металлов, благородные металлы (Pt, Ir, Ru), графит и его модификации (стеклоуглерод, пирографит).… … Химическая энциклопедия
Соляная кислота — Модель молекулы хлороводорода Соляная кислота (хлороводородная, хлористоводородная, хлористый водород) … Википедия
Е507 — Модель молекулы соляной кислоты Соляная (или соляная) кислота (хлористоводородная кислота) (Hydrochloric acid) HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость… … Википедия
Хлоридная кислота — Модель молекулы соляной кислоты Соляная (или соляная) кислота (хлористоводородная кислота) (Hydrochloric acid) HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость… … Википедия
Марганец двуокись — соединение, применяемое с зарождения человечества
Двуокись марганца — неорганическое соединение, оксид 
Свойства
Тонкодисперсионный или мелкокристаллический порошок темно-коричневого или черного цвета. Не растворяется в воде. Разлагается при нагревании свыше +105 °С. Токсичен.
Химически реактив очень устойчив, считается самым стабильным кислородосодержащим соединением марганца. В нормальных условиях вступает в реакции слабо. Проявляет амфотерные свойства, т.е. образует как кислоты, так и щелочи. Может проявлять себя как восстановитель, но чаще как сильный окислитель. Реагирует с сильными неорганическими и органическими кислотами, такими как серная, соляная, азотная, щавелевая с образованием солей: сульфатов, хлоридов, нитратов, оксалатов. В реакции с соляной кислотой выделяется хлор. С азотной и серной кислотами — кислород. Взаимодействует с сильными окислителями. В реакциях со щелочами образует соли марганцовистой (Н2МпО3) кислоты — манганиты.
 |  |  |
| Марганец двуокись 80% (45 мкр) | Респиратор пылезащитный ЛЕПЕСТОК Л-200 до 4ПДК | Марганец двуокись 91% ЭДМ |
Меры предосторожности
Относится ко 2-му классу опасности для здоровья человека. Может попасть внутрь при вдыхании пылевого аэрозоля. Вызывает раздражение при контакте с кожей. При проглатывании или вдыхании накапливается в организме. Высокая доза попавшего в организм реактива оказывает негативное воздействие на органы дыхания, центральную нервную и сердечно-сосудистую системы. По правилам техники безопасности, установленных ГОСТом, при работе с диоксидом марганца следует использовать спецодежду, резиновые перчатки и респираторы типа «Лепесток» с противопылевым фильтром, защитные очки. В воздухе рабочей зоны следует регулярно проверять концентрацию реактива. Само помещение должно быть снабжено принудительной вентиляцией.
Хранят и транспортируют двуокись марганца во влагостойких мешках, бумажных с пропиткой или пластиковых, а также в стальных контейнерах и картонно-навивных барабанах. Хранят на крытых складах.
Оксид марганца(IV)
| Оксид марганца(IV) | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Диоксид марганца |
| Химическая формула | MnO2 |
| Физические свойства | |
| Состояние (ст. усл.) | черные тетрагональные кристаллы |
| Отн. молек. масса | 86,9368 а. е. м. |
| Молярная масса | 86,9368 г/моль |
| Плотность | 5,026 г/см³ |
| Термические свойства | |
| Температура разложения | 535 °C |
| Энтальпия образования (ст. усл.) | -521,5 кДж/моль |
| Химические свойства | |
| Растворимость в воде | в воде 0 (при 0 °C) г/100 мл |
| Классификация | |
| Рег. номер CAS | [1313-13-9] |
Оксид марганца(IV) (диоксид марганца) MnO2 — порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко распространённое в земной коре (минерал пиролюзит).
Содержание
Химические свойства
При обычных условиях ведет себя довольно инертно. При нагревании с кислотами проявляет окислительные свойства, например, окисляет концентрированную соляную кислоту до хлора:
С серной и азотной кислотами MnO2 разлагается с выделением кислорода:
При взаимодействии с сильными окислителями диоксид марганца окисляется до соединений Mn 7+ и Mn 6+ :
Диоксид марганца проявляет амфотерные свойства. Так, при окислении сернокислого раствора соли MnSO4 перманганатом калия в присутствии серной кислоты образуется чёрный осадок соли Mn(SO4)2.
При сплавлении с щелочами и основными оксидами MnO2 выступает в роли кислотного оксида, образуя соли манганиты:
Является катализатором разложения пероксида водорода:
Получение
В лабораторных условиях получают термическим разложением перманганата калия:
Также можно получить реакцией перманганата калия с пероксидом водорода. На практике эта реакция не представляет особого интереса т.к. образовавшийся MnO2 каталитически разлагает пероксид водорода, не оставляя возможности провести реакцию до конца.
При температуре выше 100 °C восстановлением перманганата калия водородом:
Литература
См. также
Полезное
Смотреть что такое «Оксид марганца(IV)» в других словарях:
Оксид марганца(II) — Общие … Википедия
Оксид марганца(II,IV) — Общие Систематическое наименование Оксид марганца(II,IV) Традиционные названия Окисел марганца Химическая формула Mn5O8 Физические свойства … Википедия
Оксид марганца(VI) — Общие Систематическое наименование Оксид марганца(VI) Традиционные названия Окисел марганца Химическая формула MnO3 Физические свойства Состояние … Википедия
Оксид марганца (II) — Оксид марганца(II) Общие Систематическое наименование Оксид марганца(II) Традиционные названия Манганозит (минерал), окись марганца, монооксид марганца Химическая формула MnO … Википедия
оксид марганца — (MnO) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN manganese oxide … Справочник технического переводчика
Оксид марганца(VII) — Mn2O7 зеленовато бурая маслянистая жидкость (tпл=5,9 °C), неустойчив при комнатной температуре; сильный окислитель, при соприкосновении с горючими веществами воспламеняет их, возможно со взрывом. Получить оксид марганца(VII) Mn2O7 можно… … Википедия
Оксид марганца(III) — Общие Систематическое наименование Оксид марганца(III) Традиционные названия Окисел марганца Химическая формула Mn2O3 Физические свойства … Википедия
Оксид марганца(II,III) — Общие Систематическое наименование Оксид марганца(II,III) Традиционные названия Окисел марганца Химическая формула Mn3O4 Физические свойства … Википедия
Марганца оксиды — Существуют следующие оксиды марганца: Название Формула Температура плавления Температура кипения Цвет Оксид марганца(II) MnO 1780 °C зеленый Оксид марганца(II,III) Mn3O4 1590 °C коричневый Оксид марганца(II,IV) Mn5O8 … Википедия
МАРГАНЦА ОКСИДЫ — MnО, Mn2 О 3, MnО 2, Mn3 О 4, Mn2 О 7, Mn5 О 8. Кроме Mn2 О 7, все оксиды кристаллы, не раств. в воде. При нагр. высших оксидов отщепляется О 2 и образуются низшие оксиды: При выдерживании на воздухе или в атмосфере О 2 выше 300 °С MnО и Mn2… … Химическая энциклопедия
Оксид марганца(II)
| Оксид марганца(II) | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид марганца(II) |
| Традиционные названия | Манганозит (минерал), окись марганца, монооксид марганца |
| Химическая формула | MnO |
| Физические свойства | |
| Состояние (ст. усл.) | зелёные кубические или гексагональные кристаллы |
| Отн. молек. масса | 70,94 а. е. м. |
| Молярная масса | 70,94 г/моль |
| Плотность | 5,18 г/см³ |
| Термические свойства | |
| Температура плавления | 1569 °C |
| Температура кипения | 3127 °C |
| Химические свойства | |
| Растворимость в воде | ≈0 г/100 мл |
| Классификация | |
| Рег. номер CAS | 1344-43-0 |
Окси́д ма́рганца(II) — MnO — низший оксид марганца, монооксид.
Содержание
Физические свойства
Температура плавления 1569 °C. Температура кипения 3127 °C* (*-возгоняется с диссоциацией) Известны две сингонии кристаллов оксида марганца(II):
Химические свойства
Не растворим в воде. Легко окисляется с образованием хрупкой оболочки MnO2. Восстанавливается до марганца при нагревании с водородом или активными металлами.
Геологические свойства
В природе встречается редко. Входит в состав манганозита.
Получение
Оксид марганца(II) можно получить прокаливанием при температуре 300 °C кислородсодержащих солей марганца(II) в атмосфере инертного газа. Из распространённого MnO2 его получают через частичное восстановление при температурах 700-900 °C водородом или угарным газом.
Применение
Применяется как катализатор при дегидрогенизации пиперидина.
Используется для десульфуризации металлов.
Соли марганца(II) широко используются как катализаторы окислительных процессов. Например, добавление солей в льняное масло ускоряет окисление последнего кислородом воздуха, таким образом ускоряя высыхание краски. Льняное масло, содержащее соли марганца(II), (сиккатив) называют олифой.
См. также
Ссылки
Полезное
Смотреть что такое «Оксид марганца(II)» в других словарях:
Оксид марганца(IV) — Общие … Википедия
Оксид марганца(II,IV) — Общие Систематическое наименование Оксид марганца(II,IV) Традиционные названия Окисел марганца Химическая формула Mn5O8 Физические свойства … Википедия
Оксид марганца(VI) — Общие Систематическое наименование Оксид марганца(VI) Традиционные названия Окисел марганца Химическая формула MnO3 Физические свойства Состояние … Википедия
Оксид марганца (II) — Оксид марганца(II) Общие Систематическое наименование Оксид марганца(II) Традиционные названия Манганозит (минерал), окись марганца, монооксид марганца Химическая формула MnO … Википедия
оксид марганца — (MnO) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN manganese oxide … Справочник технического переводчика
Оксид марганца(VII) — Mn2O7 зеленовато бурая маслянистая жидкость (tпл=5,9 °C), неустойчив при комнатной температуре; сильный окислитель, при соприкосновении с горючими веществами воспламеняет их, возможно со взрывом. Получить оксид марганца(VII) Mn2O7 можно… … Википедия
Оксид марганца(III) — Общие Систематическое наименование Оксид марганца(III) Традиционные названия Окисел марганца Химическая формула Mn2O3 Физические свойства … Википедия
Оксид марганца(II,III) — Общие Систематическое наименование Оксид марганца(II,III) Традиционные названия Окисел марганца Химическая формула Mn3O4 Физические свойства … Википедия
Марганца оксиды — Существуют следующие оксиды марганца: Название Формула Температура плавления Температура кипения Цвет Оксид марганца(II) MnO 1780 °C зеленый Оксид марганца(II,III) Mn3O4 1590 °C коричневый Оксид марганца(II,IV) Mn5O8 … Википедия
МАРГАНЦА ОКСИДЫ — MnО, Mn2 О 3, MnО 2, Mn3 О 4, Mn2 О 7, Mn5 О 8. Кроме Mn2 О 7, все оксиды кристаллы, не раств. в воде. При нагр. высших оксидов отщепляется О 2 и образуются низшие оксиды: При выдерживании на воздухе или в атмосфере О 2 выше 300 °С MnО и Mn2… … Химическая энциклопедия
Соединения марганца
Устойчивые оксиды и гидроксиды марганца:
Свойства соединений марганца, указанных выше, изменяются с ростом степени окисления марганца (сверху-вниз) следующим образом:
Оксид марганца MnO(II)
Гидроксид марганца Mn(OH)2(II)
Оксид (диоксид) марганца MnO2(IV)
Оксид марганца Mn2O7(VII)
Соли марганца (II)
Соли марганца получают растворением марганца в разбавленных кислотах, при этом получается бесцветный раствор, который при взаимодействии с щелочами мутнеет по причине выпадения в осадок гидроксида марганца (II), быстро темнеющего на воздухе с переходом в гидроксид марганца (IV) бурого цвета.
2Mn(OH)2+O2+2H2O = 2Mn(OH)4
Марганцовая кислота
Как уже было сказано выше, марганцовая кислота является сильной кислотой, существующей только в водном растворе. Соли марганцовой кислоты называются перманганатами, самым известным из которых является, конечно же, перманганат калия KMnO4, который в быту называют «марганцовкой».
Во времена СССР ампулу с марганцовкой можно было купить в любой аптеке. Сейчас, перманганат калия «простому смертному» практически не достать, и дело тут не в дефиците, а в специфических свойствах марганцовки, о которых мы не будем распространяться.
Свойства перманганата калия:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе










