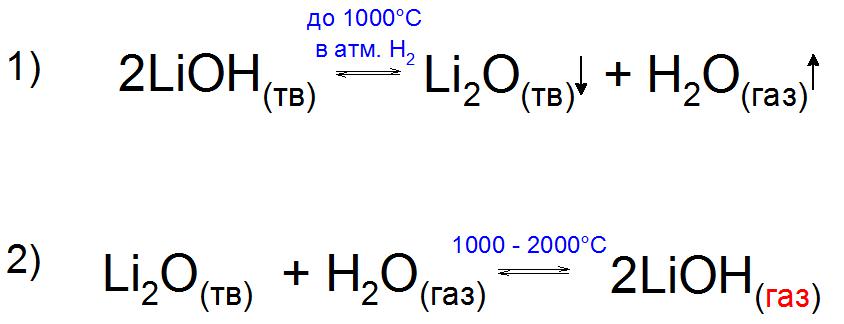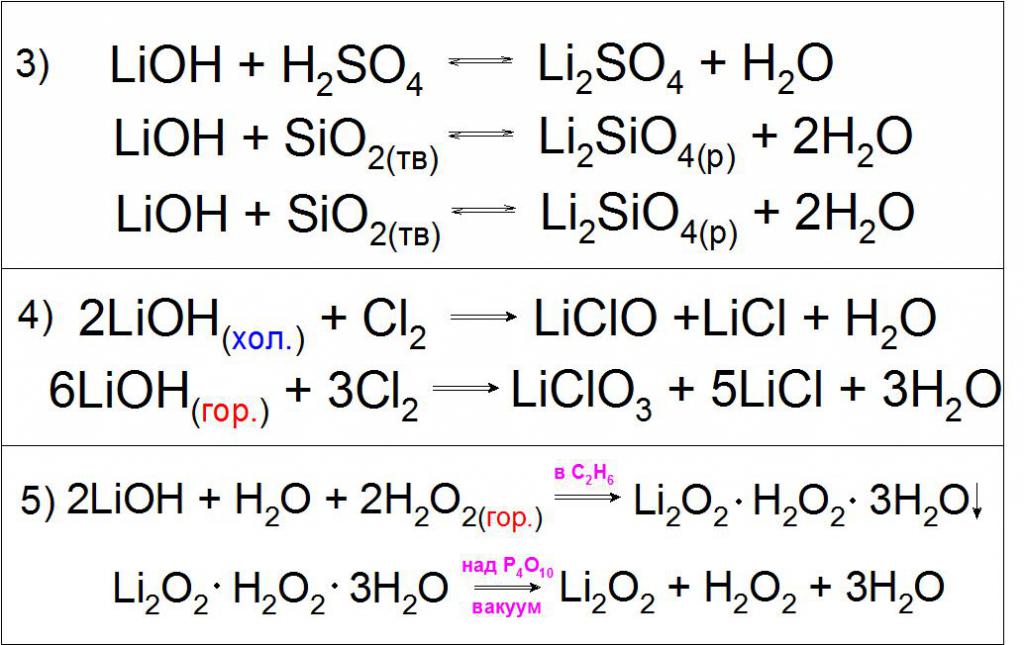Что такое lioh в химии
Гидроксид лития: способы получения и химические свойства
Гидроксид лития при стандартных условиях представляет собой бесцветные кристаллы. Растворяется в воде.
Относительная молекулярная масса Mr = 23, 95; относительная плотность для тв. и ж. состояния d = 1, 46; tпл = 471◦ C;
Способы получения
1. Гидроксид лития получают электролизом раствора хлорида лития :
2LiCl + 2H2O → 2LiOH + H2 + Cl2
2. При взаимодействии лития, оксида лития, гидрида лития и пероксида лития с водой также образуется гидроксид лития:
2Li + 2H2O → 2LiOH + H2
Li2O + H2O → 2LiOH
2LiH + 2H2O → 2LiOH + H2
3. Карбонат лития при взаимодействии с гидроксидом кальция образует гидроксид лития:
Качественная реакция
Химические свойства
1. Гидроксид лития реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. С кислыми солями гидроксид лития также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
5. Гидроксид лития взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода:
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида лития:
Сера взаимодействует с гидроксидом лития только при нагревании:
В растворе образуются комплексная соль и водород:
2LiOH + 2Al + 6Н2О = 2Li[Al(OH)4] + 3Н2
Хлорид меди (II) реагирует с гидроксидом лития с образованием хлорида лития и осадка гидроксида меди (II):
2LiOH + CuCl2 = Cu(OH)2↓+ 2LiCl
NH4Cl + LiOH = NH3 + H2O + LiCl
8. Гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
LiOH ↔ Li + + OH —
4LiOH → 4Li + O2 + 2H2O
Гидроксид лития, характеристика, свойства и получение, химические реакции
Гидроксид лития, характеристика, свойства и получение, химические реакции.
Гидроксид лития – неорганическое вещество, имеет химическую формулу LiOH.
Краткая характеристика гидроксида лития:
Гидроксид лития – неорганическое вещество белого цвета.
Химическая формула гидроксида лития LiOH.
Не растворяется в этаноле.
На воздухе гидрооксид лития поглощает углекислый газ и образует карбонат лития, токсичность которого определяется наличием лития.
Гидроксид лития – едкое, токсическое и коррозионно-активное вещество. Оно относится к веществам первого класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги.
Гидрооксид лития пожаро- и взрывобезопасен.
Является сильным основанием, но наиболее слабым основанием среди щелочных металлов.
Физические свойства гидроксида лития:
| Наименование параметра: | Значение: |
| Химическая формула | LiOН |
| Синонимы и названия иностранном языке | lithium hydroxide (англ.) |
литиевый щелок (рус.)
гидрат окиси лития (рус.)
едкий литий (рус.)
Получение гидроксида лития:
Гидроксид лития получается в результате следующих химических реакций:
– путем взаимодействия металлического лития с водой:
– путем взаимодействия оксида лития с водой:
– путем взаимодействия карбоната лития с гидроксидом кальция:
Li2CO3 + Ca(OH)2 → 2LiOH + CaCO3 (t Химические свойства гидроксида лития. Химические реакции гидроксида лития:
Гидроксид лития – химически активное вещество, сильное химическое основание.
Водные растворы LiOH имеют сильную щелочную реакцию.
Химические свойства гидроксида лития аналогичны свойствам гидроксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида лития с хлором:
2LiOH + Cl2 → LiClO + LiCl + H2O.
В результате реакции образуются хлорид лития, гипохлорит лития и вода. При этом гидроксид лития в качестве исходного вещества используется в виде холодного концентрированного раствора.
2. реакция гидроксида лития с серой:
В результате реакции образуются сульфид лития, сероводород и оксид серы.
3. реакция гидроксида лития с йодом:
В результате реакции образуются йодид лития, иодат лития и вода.
4. реакция гидроксида лития с цинком и водой:
5. реакция гидроксида лития с ортофосфорной кислотой:
6. реакция гидроксида лития с азотной кислотой:
Аналогично проходят реакции гидроксида лития и с другими кислотами.
7. реакция гидроксида лития с сероводородом:
В результате реакции образуются сульфид лития и вода.
8. реакция гидроксида лития с фтороводородом:
HF + LiOH → LiF + H2O.
В результате реакции образуются фторид лития и вода.
9. реакция гидроксида лития с бромоводородом:
HBr + LiOH → LiBr + H2O.
В результате реакции образуются бромид лития и вода.
10. реакция гидроксида лития с йодоводородом:
HI + LiOH → LiI + H2O.
В результате реакции образуются йодид лития и вода.
11. реакция гидроксида лития с оксидом алюминия:
Оксид алюминия является амфотерным оксидом. В результате реакции образуются алюминат лития и вода.
12. реакция гидроксида лития с оксидом углерода ( углекислым газом ):
Оксид углерода является кислотным оксидом. В результате реакции образуются карбонат лития и вода. В ходе реакции используется концентрированный раствор гидроксида лития. Реакция протекает при комнатной температуре.
Также данная реакция протекает на воздухе. Гидрооксид лития поглощает углекислый газ и образуется карбонат лития.
13. реакция гидроксида лития с оксидом серы (IV):
Оксид серы (IV) является кислотным оксидом. В результате реакции образуются сульфит лития и вода. В ходе реакции используется насыщенный раствор гидроксида лития.
14. реакция гидроксида лития с оксидом серы (VI):
Оксид серы (VI) является кислотным оксидом. В результате реакции образуются сульфат лития и вода.
15. реакция гидроксида лития с оксидом кремния:
В результате реакции образуются ортосиликат лития и вода. В ходе реакции используется разбавленный раствор гидроксида лития. Реакция протекает при комнатной температуре.
16. реакция гидроксида лития с гидроксидом цинка:
Гидроксид цинка является амфотерным основанием. В результате реакции образуется тетрагидроксоцинкат лития.
17. реакция гидроксида лития с сульфатом железа:
В результате реакции образуются гидроксид железа и сульфат лития.
18. реакция гидроксида лития с хлоридом железа:
В результате реакции образуются гидроксид железа и хлорид лития.
19. реакция гидроксида лития с нитратом цинка:
В результате реакции образуются гидроксид цинка и нитрат лития.
20. реакция гидроксида лития с хлоридом меди:
В результате реакции образуются гидроксид меди и хлорид лития.
Аналогично проходят реакции гидроксида лития и с другими солями.
21. реакция термического разложения гидроксида лития:
Применение и использование гидроксида лития:
Гидроксид лития используется во множестве отраслей промышленности и для бытовых нужд:
– в химической промышленности для получения солей лития;
– как компонент электролитов в щелочных аккумуляторах,
– как поглотитель углекислого газа в противогазах, подводных лодках и космических кораблях,
– в химической промышленности как катализатор полимеризации,
– в стекольной и керамической промышленности;
– при производстве водоупорных смазочных материалов, обладающих механической стабильностью в широком диапазоне температур.
Примечание: © Фото //www.pexels.com, //pixabay.com
гидроксид лития реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие гидроксида лития
реакции
Гидроксид лития. Примеры химических реакции, а также физические свойства щелочи и ее особенности
Что такое гидроксид лития? Это соединение является одним из важнейших термоустойчивых соединений, используемых в производстве для получения различных солей лития. Ионы этого элемента обладают рядом характерных особенностей, которые нашли свое широкое применение в химическом производстве.
Особенности строения атома лития
Литий (Li) является элементом I группы основной подгруппы 2-го периода, и относится к группе щелочных металлов. Его часто называют переходным к щелочноземельным элементам, поскольку он имеет немного меньшую активность, чем следующие представители этой группы, например, натрий (Na) или калий (K).
Атом лития обладает самым маленьким радиусом среди всех щелочных металлов, что обуславливает его химическую активность. Также особую роль играет предшествующая валентному электрону 2s 1 устойчивая электронная оболочка 1s 2 типа гелия, которая создает высокую поляризуемость частицы.
Все вышеперечисленные факты объясняют некоторые особенности в физических и химических свойствах гидроксида лития (LiOH).
Физические свойства
Чистый LiOH – очень едкое вещество, способное разрушить стекло и фарфор, поэтому его хранят в парафинированных сосудах. В расплавленном состоянии его можно получить только в никелевых или серебряных сосудах, так как он окисляет большинство металлов и сплавов. Золото является одним из немногих веществ, устойчивых к влиянию подобного соединения.
Само основание, по сравнению с окисью Li2O, химически неустойчиво и уже ближе к 1000 °C в атмосфере водорода H2 разлагается на составляющие (пример 1).
Интересно, что экспериментально удалось получить газообразный LiOH в присутствии паров воды. Его получают путем нагревания оксида Li до 2000 °C, когда после рубежа в 1000 °C давление пара этого соединения увеличивается за счет образования устойчивого родственного основания (пример 2).
Химические свойства
Поскольку подобное соединение проявляет сильные основные свойства, оно может вступать в реакции нейтрализации с кислотами, кислотными оксидами и обмена с различными солями (пример 3).
Также характерной реакцией является взаимодействие холодных и горячих концентрированных растворов гидроксида лития с газообразным хлором с образованием гипохлоритов и хлоратов лития (пример 4).
Особенностью данного основания является взаимодействие с горячим раствором перекиси водорода H2O2 с образованием кристаллогидрата перекисного лития Li2O2 в среде этанола, разделяемый в вакууме (пример 5).
Получение
LiOH получают различными способами, одним из которых является непосредственное взаимодействие металла или его оксида с водой по схеме литий → оксид лития → гидроксид лития.
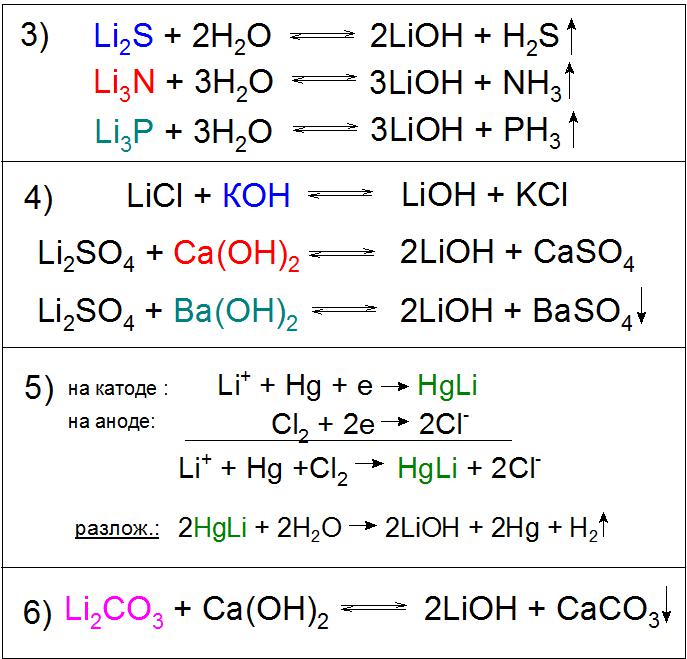
Также применяется гидролиз сульфида, нитрида, фосфидов и других соединений (пример 3).
Еще одним примечательным методом получения данного соединения является электролиз раствора хлорида лития LiCl на ртутном катоде. При этом образуется амальгама HgLi, интересная тем, что температура ее плавления гораздо выше (609 °C), чем любого ее компонента. В процессе разложения водой полученного соединения образуется необходимое основание (пример 5).
Особенное промышленное значение имеет реакция разложения карбоната лития гашеной известью, в ходе которого химическое равновесие искусственно сдвигается в правую сторону для более высокого выхода основного продукта (пример 6).
Применение
Гидроксид лития используется при получении стеаратов этого металла для производства водоупорных морозо- и термостойких смазочных материалов. Также применяется в качестве катализатора при изготовлении полимерных материалов и как компонент электролита в различных аккумуляторах.
В пожарной и военной практике гидроксид лития используется как поглотитель углекислого газа (CO2) в противогазах.
Гидроксид лития, характеристика, свойства и получение, химические реакции
Краткая характеристика гидроксида лития:
Гидроксид лития – неорганическое вещество белого цвета.
Химическая формула гидроксида лития LiOH.
Хорошо растворяется в воде, при этом выделяя тепловую энергию. Его растворимость в воде составляет 12,7 г/100 см 3 при 25 °C. Растворимость с повышением температуры увеличивается и он полностью диссоциирует на оксид лития и воду при температуре 1000 °С.
Не растворяется в этаноле.
На воздухе гидрооксид лития поглощает углекислый газ и образует карбонат лития, токсичность которого определяется наличием лития.
Гидроксид лития – едкое, токсическое и коррозионно-активное вещество. Оно относится к веществам первого класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги.
Гидрооксид лития пожаро- и взрывобезопасен.
Является сильным основанием, но наиболее слабым основанием среди щелочных металлов.
Физические свойства гидроксида лития:
| Наименование параметра: | Значение: |
| Химическая формула | LiOН |
| Синонимы и названия иностранном языке | lithium hydroxide (англ.) |
литиевый щелок (рус.)
гидрат окиси лития (рус.)
едкий литий (рус.)
Получение гидроксида лития:
Гидроксид лития получается в результате следующих химических реакций:
– путем взаимодействия металлического лития с водой:
– путем взаимодействия оксида лития с водой:
– путем взаимодействия карбоната лития с гидроксидом кальция:
Гидроксид лития
белое твердое вещество
Умеренно растворим в воде
(12,8 г / 100 г воды при 20 ° C)
Маркировка опасности GHS
ОглавлениесинтезЧистый оксид лития Li 2 O реагирует с водой с образованием гидроксида лития. Техническое производство происходит за счет реакции карбоната лития с гидроксидом кальция : В качестве альтернативы гидроксид лития можно также получить электролизом водных растворов солей лития. характеристикииспользоватьВ реакторах с водой под давлением гидроксид лития добавляют в первый контур для нейтрализации борной кислоты и достижения pH около 7,2. Гидроксид лития также используется в качестве исходного материала для производства автомобильных аккумуляторов.
| |||
|---|---|---|---|