Что такое kmno4 химия
Перманганат калия: основные химические свойства и реакции
Содержание статьи
Как выглядит перманганат калия
Перманганат калия представляет собой темно-фиолетовые, почти черные кристаллы. При растворении в воде, в зависимости от концентрации, он дает раствор от бледно-розового до насыщенного фиолетового оттенка. В горячей воде KMnO4 растворяется лучше. Кристаллы вещества или сильно концентрированный раствор при попадании на кожу или слизистые могут вызвать ожоги.
Химические свойства перманганата калия
Перманганат калия – кислородсодержащая калиевая соль. Поскольку катиону K(+) соответствует сильное основание KOH, а аниону MnO4(-) – сильная марганцовая кислота HMnO4, соль KMnO4 не гидролизуется.
KMnO4 – сильнейший окислитель. Он легко окисляет многие неорганические и органические вещества. Продукты восстановления перманганата калия зависят от условий, в которых протекает реакция. Так, в кислой среде он восстанавливается до Mn(2+), в нейтральной – до MnO2, в щелочной – до MnO4(2-).
Например, если добавить сульфит калия K2SO3 к подкисленному фиолетовому раствору перманганата калия, он обесцветится, поскольку образуется соль Mn(II):
Это качественная реакция на ион MnO4(-).
Как распознать оксид марганца(IV) MnO2
Оксид марганца(IV) MnO2 – одно из наиболее важных соединений этого металла. Это коричнево-черный оксид, нерастворимый в воде, главный компонент пиролюзита. Так же, как и KMnO4, MnO2 является сильным окислителем, что используется, к примеру, при получении хлора:
Бурый осадок MnO2 выпадает при действии сульфита калия K2SO3 на нейтральный раствор перманганата. Степень окисления марганца при этом изменяется от +7 до +4:
Восстановление перманганата до манганата в щелочной среде
В сильно щелочной среде, при большой концентрации щелочи, перманганат калия восстанавливается сульфитом калия до манганата K2MnO4:
Фиолетовая окраска раствора при этом меняется на зеленую. Манганат калия – соединение марганца, устойчивое в щелочной среде.
Применение перманганата калия
Перманганат калия находит широкое применение как окислитель в химических лабораториях и промышленности. 0,1% раствор используется в медицине и в быту для дезинфекции, полосканий, лечения ожогов, выведения токсинов.
ПЕРМАНГАНАТ КАЛИЯ
Сильный окислитель в растворе и при спекании. Реагирует с типичными восстановителями (этанолом, водородом и др.). Концентрированные растворы перманганата калия окрашены в интенсивно-фиолетовый цвет, а разбавленные – в розовый.
Перманганаты – соли не выделенной в свободном состоянии марганцовой кислоты HMnO4, существующей только в водных растворах. Перманганаты известны для щелочных и щелочноземельных металлов, аммония, серебра и алюминия. Все они образуют фиолетово-черные кристаллы, растворимые в воде. Наиболее растворим среди них перманганат бария Ba(MnO4)2, а наименее растворим перманганат цезия CsMnO4.
При нагревании все перманганаты разлагаются, выделяя кислород и превращаясь в манганаты и диоксид марганца, например:
В кислотной среде перманганат-ион превращается в аквакатион [Mn(H2O)6] 2+ :
Разбавленные водные растворы перманганата калия неустойчивы, они разлагаются (особенно быстро под действием солнечных лучей) с образованием бурого осадка диоксида марганца и выделением кислорода:
Особенно быстро раствор KMnO4 портится в присутствии восстановителей, органических веществ, которые всегда есть в воздухе. Этиловый спирт C2H5OH: так реагирует с пермантганатом калия
Химики прошлого прозвали перманганат калия «хамелеоном». Его способность полностью реагировать с многими восстановителями находит применение в широко распространенном методе объемного химического анализа – перманганатометрии. Этим методом можно напрямую определить содержание железа(II), сурьмы(III), марганца(II), ванадия(IV), вольфрама(V), урана(IV), таллия(I), хрома(III), пероксида водорода, щавелевой кислоты и ее солей, арсенитов, гидразина и ряда органических веществ. Обратным перманганатометрическим титрованием определяют восстановители, реагирующие с KMnO4 медленно – иодиды, цианиды, фосфиты и др. Первооткрывателем этого удивительного вещества был шведский химик и аптекарь Карл-Вильгельм Шееле. Шееле сплавлял «черную магнезию» – минерал пиролюзит (природный диоксид марганца), с поташом – карбонатом калия и селитрой – нитратом калия. При этом получались перманганат калия, нитрит калия и диоксид углерода:
Окислительные свойства перманганата калия, которые связаны с высокой степенью окисления марганца в этом соединении (+VII), дают возможность использовать его в лечебных целях – для уничтожения всякой инфекции, для «прижигания» и «подсушивания» кожи и слизистых оболочек.
Перманганат калия, попадая на кожу, разлагается с выделением бурого осадка диоксида марганца MnO2. В зависимости от концентрации раствора, а значит, – от количества осадка, диоксид марганца оказывает вяжущее либо прижигающее действие.
Перманганат калия, разлагаясь, выделяет активный кислород, а это ярый враг микробов и неприятных запахов. Зачастую кислород выделяется (и мгновенно расходуется в реакциях окисления), не успевая образовывать газовые пузырьки. Это позволяет врачам вводить растворы KMnO4 в глубокие раны при очень опасной анаэробной (возникающей без доступа воздуха) инфекции.
Полоскания розовым раствором марганцовки рекомендуются при ангинах и стоматитах – воспалении миндалин, слизистой оболочки рта и десен. Таким же раствором промывают глаза при конъюнктивитах. Перманганат калия помогает при пищевых отравлениях: его бледно-розовым раствором промывают желудок или просто выпивают стакан такого раствора натощак.
Растворами перманганата калия обрабатывают ожоги. Помогает марганцовка и при змеином укусе. Если нет специальной сыворотки, точно по месту укуса врачи шприцем вводят раствор KMnO4.
Все мамы и бабушки знают, что ванна с бледно-розовым раствором марганцовки поможет подсушить нежную кожу грудного младенца. Надо только помнить о мерах предосторожности, а они просты: в приготовленную для купания воду надо вносить обязательно раствор KMnO4, но ни в коем случае не кристаллы марганцовки – иначе возможен химический ожог.
Твердый перманганат калия и его крепкие растворы могут быть опасны, поэтому хранить его следует в местах, недоступных малышам, а обращаться с осторожностью.
При отравлении концентрированным раствором этого вещества возникает ожог рта, пищевода и желудка. Врачи-травматологи рассказывают, что такие отравления нет-нет, да и случаются – когда рассеянный человек принимает раствор марганцовки за крепко заваренный чай. В этом случае надо немедленно промыть желудок теплой водой с добавлением активированного угля. Можно использовать и раствор, содержащий в двух литрах воды полстакана слабого раствора перекиси водорода и один стакан столового уксуса. В этом случае перманганат-ионы переходят в менее опасные катионы марганца(II):
Перманганат калия, служит для отбеливания тканей (при низких концентрациях он не теряет окислительных свойств!), его добавляют в растворы для жидкостной газоочистки от таких опасных примесей как сероводород или фосфин. Химикам хорошо известен метод химического анализа – перманганатометрия (главное действующее лицо здесь тот же перманганат калия), а те, кто углубленно занимается фотографией, знакомы с применением перманганата калия как компонент ослабляющих (снижающих плотность фотоизображения на пленке) растворов. Кроме того, это хороший окислитель органических веществ (с помощью KMnO4 получают из парафинов карбоновые кислоты.
Формула перманганата калия
Определение и формула перманганата калия
Раствор KMnO4 имеет темно-малиновый цвет, а при большой концентрации – фиолетовый цвет, свойственный перманганат ионам (MnO4 — ).
Рис. 1. Кристаллы перманганата калия. Внешний вид.
Химическая формула перманганата калия
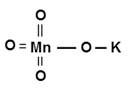
Химическая формула перманганата калия – KMnO4. Она показывает, что в составе молекулы этого сложного вещества находится один атома калия (Ar = 39 а.е.м.), один атом марганца (Ar = 55 а.е.м.)и четыре атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу перманганата калия:
Mr(KMnO4) = 39 + 55 + 4×16 = 39 + 55 +64 =158
Структурная (графическая) формула перманганата калия
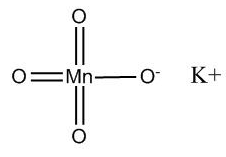
Более наглядной является структурная (графическая) формула перманганата калия. Она показывает то, как связаны атомы между собой внутри молекулы. Структурная формула перманганата калия имеет вид:
Перманганат калия представляет собой среднюю соль марганцовой кислоты, которая способна диссоциировать на ионы в водном растворе согласно следующему уравнению:
В этой связи для перманганата калия также можно указать и ионную формулу:
Примеры решения задач
| Задание | Вычислите, какой объём кислорода (н.у.) выделится при разложении 237 г перманганата калия? |
| Решение | Запишем уравнение разложения перманганата калия: |
Вычислим количество вещества перманганата калия по формуле:
Для этого необходимо указать молярную массу перманганата калия(значение относительной атомной массы, взятое из Периодической таблицы Д.И. Менделеева, округлим до целого числа). Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(KMnO4) = Ar(K) + Ar(Mn) + 4×Ar(O) = 39 + 55 + 4×16 = 94 + 64 = 158 г/моль
Тогда, количество вещества перманганата калия будет равно:
n(KMnO4)= 237/ 158 = 1,5 моль
Согласно уравнению реакции n(O2) : n(KMnO4) = 1 : 2, значит:
n(O2) = 1/2 × n(KMnO4) = ½ × 1,5 = 0,75 моль
Найдем молярную массу молекулярного кислорода (допущение, указанное при расчете молярной массы кислорода действительно и в данном случае):
M(O2) = 2×Ar(O) = 2×16 = 32 г/моль
Определим объем выделившегося кислорода:
| Задание | Установите массовую формулу вещества, содержащего 33,3% натрия, 20,3% азота и 46,4% кислорода. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%
Обозначим количество моль элементов, входящих в состав соединения за «х» (натрий), «у» (азот) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(Na)/Ar(Na) :ω(N)/Ar(N) : ω(O)/Ar(O);
x:y:z= 33,3/23 : 20,3/14 : 46,4/16;
x:y:z= 1,45 : 1,45:2,9 = 1 : 1: 2
Значит формула соединения натрия, азота и кислорода будет иметь вид NaNO2. Это нитрит натрия.
HimMax
Поиск
Каталог
Калия перманганат
Калия перманганат
ФС 42-3007-93
Перманганат калия (распространённое название в быту — марганцовка) — марганцовокислый калий, калиевая соль марганцовой кислоты. Химическая формула — KMnO4. Представляет собой тёмно-фиолетовые, почти чёрные кристаллы, при растворении в воде образующие ярко окрашенный раствор цвета фуксии.
Физические свойства
Внешний вид: тёмно-фиолетовые кристаллы с металлическим блеском. Показатель преломления составляет 1,59 (при 20 °C).
Растворяется в воде (см. таблицу), жидком аммиаке, ацетоне (2:100), метаноле, пиридине.
| Температура, °C | 10 | 20 | 25 | 30 | 40 | 50 | 65 |
|---|---|---|---|---|---|---|---|
| Растворимость, г/100 г воды | 4,22 | 6,36 | 7,63 | 9 | 12,5 | 16,8 | 25 |
Термодинамические свойства
| Стандартная энтальпия образования ΔH | −813,4 кДж/моль (т) (при 298 К) |
|---|---|
| Стандартная энергия Гиббса образования G | −713,8 кДж/моль (т) (при 298 К) |
| Стандартная энтропия S | 171,71 Дж/(моль·K) (т) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 119,2 Дж/(моль·K) (т) (при 298 К) |
Химические свойства
Является сильным окислителем. В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия):
Однако надо отметить, что последняя реакция (в щелочной среде) идёт по указанной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
при этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4. По реакции с фторидом иода(V) можно получить аналогичный оксофторид:
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
Реагирует с солями двухвалентного марганца, например:
Эта реакция в принципе обратна дисмутации (диспропорционирование) K2MnO4 на MnO2 и KMnO4.
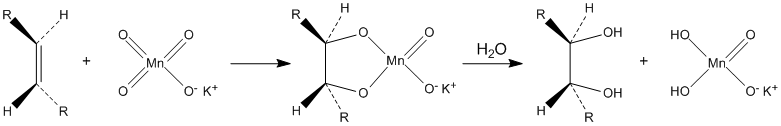
Окисляет органические вещества. В частности, разбавленные растворы перманганата калия в щелочной и нейтральной среде окисляют алкены до диолов (реакция Вагнера):
Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
При смеси с пероксидом водорода протекает следующая реакция:
Применение
Применение этой соли чаще всего основано на высокой окисляющей способности перманганат-иона, обеспечивающей антисептическое действие.
Медицинское применение
| Перманганат калия | |
| Kalii permanganas | |
| Химическое соединение | |
|---|---|
| ИЮПАК | Перманганат калия |
| Брутто-формула | KMnO4 |
| CAS | 7722-64-7 |
| PubChem | 516875 |
| DrugBank | 13831 |
| Классификация | |
| Фармакол. группа | Антисептики и дезинфицирующие средства |
| АТХ | D08AX06 |
| Лекарственные формы | |
| порошок для приготовления раствора | |
| Другие названия | |
| KMnO4, Калия перманганат, Марганцовка, Хамелеон минеральный, Марганцевокислый калий, Марганцовокислый калий, Калий марганцевокислый | |
Разбавленные растворы (около 0,1 %) перманганата калия нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов. В качестве рвотного средства для приёма внутрь при отравлениях морфином, аконитином и некоторыми другими алкалоидами используют разбавленный (0,02—0,1 %) раствор перманганата калия.
Фармакологическое действие
Антисептическое средство. При соприкосновении с органическими веществами выделяет атомарный кислород. Образующийся при восстановлении препарата оксид образует с белками комплексные соединения — альбуминаты (за счёт этого калия перманганат в малых концентрациях оказывает вяжущее, а в концентрированных растворах — раздражающее, прижигающее и дубящее действие). Обладает также дезодорирующим эффектом. Эффективен при лечении ожогов и язв. Способность калия перманганата обезвреживать некоторые яды лежит в основе использования его растворов для промывания желудка при отравлениях неизвестным ядом и пищевых токсикоинфекциях. При попадании внутрь всасывается, оказывая действие (приводит к развитию метгемоглобинемии).
Показания
Смазывание язвенных и ожоговых поверхностей — инфицированные раны, язвы и ожоги кожи. Полоскание полости рта и ротоглотки — при инфекционно-воспалительных заболеваниях слизистой оболочки полости рта и ротоглотки (в том числе при ангинах). Для промывания и спринцеваний при гинекологических и урологических заболеваниях — кольпиты и уретриты. Для промываний — желудка при отравлениях, вызванных приёмом внутрь алкалоидов (морфин, аконитин, никотин), синильной кислотой, фосфором, хинином; кожи — при попадании на неё анилина; глаз — при поражении их ядовитыми насекомыми.
Противопоказания
Способ применения и дозы
Наружно, в водных растворах для промывания ран ( 0,1—0,5 % ), для полоскания рта и горла ( 0,01—0,1 % ), для смазывания язвенных и ожоговых поверхностей ( 2—5 % ), для спринцевания ( 0,02—0,1 % ) в гинекологической и урологической практике, а также промывания желудка при отравлениях.
Предосторожности
Активно взаимодействует при нагреве и даже при комнатной температуре с большинством восстановителей, например, органическими веществами (сахарозой, танинами, глицерином и многими другими), легкоокисляющимися веществами, поэтому при смешивании происходит саморазогревание, что иногда вызывает самовоспламенение смеси (с концентрированным раствором глицерина, или безводным — всегда) и может привести к взрыву.
Другие сферы применения
Получение
Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия. Например:



Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Пурпурно-розовые в растворе.
СОДЕРЖАНИЕ
Использует
Медицинское использование
Очистка воды
Перманганат калия широко используется в промышленности по очистке воды. Он используется в качестве регенерирующего химического вещества для удаления железа и сероводорода (запах тухлых яиц) из колодезной воды через фильтр «Марганцевый зеленый песок». «Пот-Пермь» также продается в магазинах бассейнового снабжения и используется дополнительно для очистки сточных вод. Исторически он использовался для дезинфекции питьевой воды и может сделать воду розовой. В настоящее время он находит применение для борьбы с вредными организмами, такими как мидии зебры, в системах сбора и очистки пресной воды.
Синтез органических соединений
Аналитическое использование
Водные кислые растворы KMnO 4 используются для сбора газообразной ртути в дымовых газах во время испытаний выбросов из стационарных источников.
В гистологии перманганат калия использовался как отбеливающий агент.
Консервация фруктов
Поглотители этилена продлевают срок хранения бананов даже при высоких температурах. Этот эффект можно использовать, упаковывая бананы в полиэтилен вместе с перманганатом калия. Удаляя этилен путем окисления, перманганат задерживает созревание, увеличивая срок хранения фруктов до 4 недель без необходимости охлаждения.
Наборы для выживания
Пожарная служба
Другое использование
Перманганат калия можно использовать для окисления кокаиновой пасты, чтобы очистить ее и повысить ее стабильность. Это привело к тому, что в 2000 году Управление по борьбе с наркотиками начало операцию «Пурпур» с целью мониторинга мировых поставок перманганата калия; однако вскоре после этого стали использовать производные перманганата калия и их заменители, чтобы избежать операции.
В агрохимии он используется для оценки доступного азота в почве.
История
В 1659 году Иоганн Рудольф Глаубер сплавлял смесь минерального пиролюзита (диоксид марганца, MnO 2 ) и карбоната калия, чтобы получить материал, который при растворении в воде дал зеленый раствор ( манганат калия ), который медленно переходил в фиолетовый, а затем, наконец, на фиолетовый. красный. Этот отчет представляет собой первое описание производства перманганата калия. Чуть менее 200 лет спустя лондонский химик Генри Боллманн Конди заинтересовался дезинфицирующими средствами; он обнаружил, что сплавление пиролюзита с гидроксидом натрия (NaOH) и растворение его в воде дает раствор с дезинфицирующими свойствами. Он запатентовал это решение и продал его как «жидкость Конди». Несмотря на эффективность, решение было не очень стабильным. Это было преодолено за счет использования гидроксида калия (КОН), а не NaOH. Он был более стабильным и имел то преимущество, что легко превращался в столь же эффективные кристаллы перманганата калия. Этот кристаллический материал был известен как «кристаллы Конди» или «порошок Конди». Перманганат калия было сравнительно легко производить, поэтому Конди впоследствии был вынужден потратить значительное время на судебные разбирательства, чтобы помешать конкурентам продавать аналогичные продукты.
Подготовка
Затем манганат калия превращается в перманганат путем электролитического окисления в щелочной среде:
Другие методы
Хотя манганат калия не имеет коммерческого значения, он может быть окислен хлором или диспропорционированием в кислых условиях. Реакция окисления хлора
А реакция диспропорционирования, вызванная кислотой, может быть записана как
3 K 2 MnO 4 + 4 HCl → 2 KMnO 4 + MnO 2 + 2 H 2 O + 4 KCl
Для этой реакции достаточно слабой кислоты, например угольной :
Перманганатные соли также могут быть получены обработкой раствора ионов Mn 2+ сильными окислителями, такими как диоксид свинца (PbO 2 ), висмутат натрия (NaBiO 3 ) или пероксидисульфат. В тестах на присутствие марганца используется яркий фиолетовый цвет перманганата, производимого этими реагентами.
Состав
Реакции
Органическая химия
В кислых условиях двойная связь алкена расщепляется с образованием соответствующей карбоновой кислоты :
Реакция с кислотами
Термическое разложение
Твердый перманганат калия при нагревании разлагается:
Здесь степень окисления марганца изменяется по мере разложения перманганата калия (степень окисления +7) до манганата калия (степень окисления +6) и диоксида марганца (степень окисления +4). Также выделяется газообразный кислород.