Что такое iga нефропатия
IgA-нефропатия при системных заболеваниях, персистирующих инфекциях, хронических болезнях печени (обзор литературы)
В обзоре анализируются особенности вторичной IgA-нефропатии, осложняющей пурпуру Шенлейна–Геноха, серонегативные спондилоартриты, глютеновую энтеропатию, HCV-инфекцию, ВИЧ-инфекцию, цирроз печени, наследственные нефриты.
The review discusses peculiarities of secondary IgA-nephropathy, complicating Henoch–Schonlein purpura, spondyloarthropathies, gluten enteropathy HCV infections, AIDS, liver cirrhosis, hereditary nephritis.
IgA-нефропатия (болезнь Берже) — одна из самых частых форм хронического брайтова нефрита, отличающаяся гематурией с медленным прогрессированием в хроническую болезнь почек (ХБП). Среди больных терминальной уремией, сегодня находящихся на заместительной почечной терапии, у каждого четвертого диагностируется IgA-нефропатия [1]. Более редкие формы IgA-нефропатии характеризуются такими признаками активности, как высокая протеинурия, диффузная пролиферация мезангия, пролиферация эндотелия капилляров клубочков, экстракапиллярная пролиферация, гломерулярные депозиты фибрина, выраженный фокальный гломерулосклероз [2, 3].
Трактовка впервые обнаруженной IgA-нефропатии часто затруднительна. IgA-нефропатия выступает не только как форма распространенного брайтова нефрита, но часто должна расцениваться как «почечная» маска системных заболеваний (геморрагический васкулит, анкилозирующий спондилоартрит), персистирующих инфекций (ВИЧ-инфекция, HCV-инфекция, туберкулез), цирроза печени (ЦП), заболеваний кишечника (целиакия, болезнь Крона, неспецифический язвенный колит — НЯК), тяжелых форм кожных заболеваний — псориаз, герпетиформный дерматит (см. табл.) [4–6].
Дальнейшее изучение этиологии и патогенетических механизмов вторичных IgA-нефропатий перспективно для разработки новых методов лечения и профилактики болезни Берже.
IgA-нефропатия при хронических заболеваниях печени
IgA-нефропатия при HCV-инфекции
Для IgA-нефропатии при HCV-инфекции более характерна поздняя манифестация — после многолетнего медленного формирования вирусного ЦП, когда нарушается деградация IgA в печени и формируется инсулинорезистентность. Значительно раньше (на стадии хронического гепатита) формируется вирусный мембранопролиферативный нефрит (МБПГН). Поэтому от характерных проявлений IgA-нефропатии в виде гематурии с умеренной протеинурией на фоне нормотензии необходимо отличать криоглобулинемический МБПГН с рецидивами острого нефритического синдрома (ОНС), а также иммунотактоидный нефрит [7, 8]. При этом важное диагностическое значение имеет обнаружение криоглобулинемии смешанного II типа (СКГ II) с выраженной репликацией вируса гепатита С [9]. Криоглобулиемический МБПГН и иммунотактоидный нефрит отличаются ускоренным прогрессированием или развитием быстропрогрессирующего нефрита. Крайне неблагоприятен прогноз при HCV позитивной тромботической тромбоцитопенической пурпуре с злокачественной гипертензией (ЗГ) и прогрессирующей энцефалопатией.
IgA-нефрит при алкогольном циррозе печени
При алкогольном декомпенсированном ЦП признаки IgA-нефропатии обнаруживаются у каждого десятого больного. При этом механизмы нарастания в крови уровня IgA и IgA-содержащих иммунных комплексов, обусловленные снижением печеночной деградации IgA при прогрессировании цирроза [10], проявляются типичной картиной латентного нефрита с гематурией [11, 12]. Стойкая гипертензия наблюдалась в 15–20%, чаще носит контролируемый характер, ассоциируется с хроническими нарушениями пуринового обмена [13]. У половины больных алкогольным гематурическим нефритом обнаруживается кальцинирующий панкреатит, алкогольная кардиомиопатия, периферическая полинейропатия. Течение почечного процесса медленно прогрессирующее или рецидивирующее [13]. Рецидив нефрита развивается у 30% больных в первые сутки после алкогольного эксцесса, нередко ассоциирован с атакой острого алкогольного гепатита и напоминает ОНС. В 5% развивается экстракапиллярный быстропрогрессирующий нефрит (БПГН), наиболее неблагоприятный прогностически. У больного с далеко зашедшим портальным ЦП необходимо дифференцировать прогрессирующую IgA-нефропатию с гепаторенальным синдромом, алкоголь-парацетамоловым синдромом, а также с отравлениями суррогатами алкоголя (гликолин, метиловый спирт, дихлорэтан).
IgA-нефропатия при ВИЧ-инфекции
У ВИЧ-инфицированных больных [14] белой расы чаше других форм нефрита обнаруживается IgA-нефропатия. Мезангиальные IgA-депозиты обнаруживаются у 8% умерших от СПИДа. Дифференциальную диагностику указанной вторичной IgA-нефропатии следует проводить с такими ВИЧ-ассоциированными формами, как коллабирующий вариант фокально-сегментарного гломерулосклероза, мембранозная нефропатия, люпус-подобный пролиферативный нефрит, тромботическая тромбоцитопеническая пурпура, для которых, в отличие от IgA-нефропатии, характерны тяжелый нефротический синдром (НС), рецидивирующий ОНС или неконтролируемая гипертензия [15, 16].
В 30% ВИЧ-ассоциированной IgA-нефропатии характерна ЗГ. ЗГ сопровождается высокой протеинурией и быстрым прогрессированием в терминальную стадию хронической почечной недостаточности [17]. При этом биопсия почки демонстрировала сочетание мезангиопролиферативного IgA-нефрита с экстракапиллярной пролиферацией в 10–20% клубочков, тяжелым нефроангиосклерозом и фибриноидным некрозом артериол, напоминающим тромботическую микроангиопатию. Выявлена корреляция между тяжестью артериальной гипертензии и нефроангиосклероза, с одной стороны, и степенью вирусной нагрузки (ВИЧ) — с другой. Предполагается, что ЗГ с признаками ТМА обусловлена прямым повреждающим действием ВИЧ на эндотелий почечных артериол.
IgA-нефропатия при серонегативных спондилоартритах
К серонегативным спондилоартритам относятся болезнь Бехтерева, артритры при распространенном псориазе, синдроме Рейтера, НЯК, болезни Крона. Данные формы объединяет патология иммунного ответа с антигеном гистосовместимости HLA В27 [18]. Общим для всех указанных спондилоартритов является нарушение клеточного иммунитета (СD4-Т-лимфоцитов). Реактивные артриты, ассоциированные с хронической воспалительной диареей (НЯК), хроническим уретритом (синдром Рейтера) характеризуются гиперпродукцией IgA с высоким риском прогрессирования ВИЧ-инфекции, нефропатиями и васкулитами [19]. Среди клинических маркеров — сакроилеит, гемоколит, мальабсорбция, прогрессирующий передний увеит, иридоциклит, конъюнктивит с уретритом [20]. IgA-нефропатия, как правило, проявляется микрогематурией с минимальной протеинурией без стойкой гипертензии и медленным прогрессированием.
Дифференциальная диагностика вторичной IgA-нефропатии должна проводиться с лекарственным хроническим тубулоинтерстициальным нефритом при свойственном сакроилеиту длительном приеме ненаркотических анальгетиков, нестероидных противовоспалительных средств, с хроническим уретритом и пиелонефритом (чаще при синдроме Рейтера). При далеко зашедшем спондилоартрите с нарастанием протеинурии и формированием стойкого НС на фоне тенденции к гипотензии вероятен диагноз генерализованного АА-амилоидоза. Решающее значение в диагностике амилоидной нефропатии имеет биопсия почки или слизистой прямой кишки.
IgA-нефропатия при целиакии
Целиакия (лат. Morbus coeliacus; целиакия) — заболевание, характеризующееся непереносимостью глютена (с сенсибилизацией к нему). При этом всасывающиеся продукты неполного расщепления глютена оказывают токсическое действие на желудочно-кишечный тракт, индуцируют аллергические реакции (вплоть до глиадинового шока), что приводит к гиперрегенераторной атрофии слизистой оболочки тонкой кишки с развитием синдрома мальабсорбции.
При врожденной форме целиакии прогрессирующее поражение тонкого кишечника с тяжелым синдромом мальабсорбции препятствует росту и развитию ребенка [21]. Непереносимость глютена у взрослых мало изучена. Популяционные исследования последних десятилетий показали, что серологические и гистологические признаки целиакии регистрируются в десятки и сотни раз чаще, чем манифестные формы заболевания [22]. Также целиакия может иметь приобретенный характер, осложняя хронические энтериты.
Поражение почек при целиакии обусловлено циркулирующими иммунными комплексами, содержащими IgA-антитела к белку глиадину, которые способны фиксироваться на мезангиальных клетках с помощью глиадин-опосредованных лектиновых связей [23]. По данным многочисленных исследований антиглиадиновые IgA-антитела выявляются у большинства больных с IgA-нефропатией (70–100%), в то же время типичная целиакия обнаруживается лишь у 3% из них [24–28]. IgA-нефропатия при целиакии проявляется микрогематурией и протеинурией менее 1 г/сутки без гипертензии или может протекать субклинически [29, 30]. Имеются данные о положительном влиянии аглютеновой диеты на течение IgA-нефропатии [23, 31, 32].
IgA-нефропатия при геморрагическом васкулите
Типичным проявлением геморрагического васкулита (пурпуры Шенлейна–Геноха) является сочетание рецидивов кожной геморрагической пурпуры с преходящим поражением крупных суставов, абдоминальным синдромом и поражением почек [33]. Атака абдоминального синдрома может осложниться желудочно-кишечным кровотечением, кишечной непроходимостью. Наблюдаются случаи нетипичного течения: почечная манифестация с отсроченным (на несколько месяцев, иногда — 1–2 года) присоединением артритов вместе с кожно-абдоминальной пурпурой. Учитывая указанные клинические наблюдения и общность патогенетических механизмов IgA-нефрита при геморрагическом васкулите с болезнью Берже, предполагается, что имеют место системная и локальная (почечная) формы одного и того же заболевания [34].
IgA-нефрит Шенлейна–Геноха чаще проявляется микрогематурией в сочетании с протеинурией, не превышающей 1 г/сутки. Гипертензия наблюдается не чаще чем у 15–20% больных [35]. Нефротический синдром формируется в 20–30% случаев чаще на поздней стадии болезни. В 5–10% случаев развивается БПГН с экстракапиллярной пролиферацией [36].
IgA-нефропатия и синдром Альпорта
Синдром Альпорта — наследственный гематурический нефрит с прогрессирующей потерей слуха, наследуемый по доминантному типу и сцепленный с Х-хромосомой. Поражение почек, приводящее мужчин с синдромом Альпорта к исходу в терминальную стадию ХБП, не связано с иммунокомплексными механизмами, а обусловлено мутацией генов коллагена БМК клубочков [37, 38]. IgA-нефропатия в семьях носителей патологических генов и больных синдромом Альпорта встречается чаще и протекает с более быстрым прогрессированием. Дифференциальная диагностика IgA-нефропатии с синдромом Альпорта осложняется развитием обоих заболеваний в молодом возрасте и преимущественно у мужчин, а также сходством почечной симптоматики. Для разграничения c IgA-нефропатией имеют ценность инструментальное исследование слуха, выявление аномалий хрусталика и роговицы, иммунологических нарушений, а также генетический анализ и изучение родословной. В сложных случаях применяется биопсия почки [39].
Заключение
В основе формирования аномального IgA-опосредованного иммунного ответа могут быть постэнтероколитическая или урогенитальная инфекция, нарушение печеночной деградации IgA при прогрессирующем ЦП, наследственная предрасположенность, включая носительство генов синдрома Альпорта, гена гистосовместимости HLA B27. Повышение в крови полимерного IgA и IgA-содержащих иммунных комплексов наблюдается у большинства ВИЧ-инфицированных, у пациентов с целиакией, НЯК и у 90% больных псориатическим артритом. Общим для большинства форм вторичной IgA-нефропатии является нарушение функции Т-хелперов (СD4-Т-лимфоцитов) с высоким риском иммунокомплексных осложнений, прогрессирования ВИЧ-инфекции. Полимерный IgA1 демонстрирует антительную активность к HIV-IgG и HIV-IgM [40, 41]. При IgA-нефритах необычно высока инфицированность другими вирусами. Так, от 60% до 80% больных алкогольным ЦП являются хроническими носителями HCV или HBV, что дополнительно усугубляет иммунодефицит. Иммунокомплексная патология реализуется рецидивами кожного васкулита, аортита, увеита, иммунокомплексным нефритом, инфекционными осложнениями. У 30–40% указанных больных выявляются инфицирование микобактериями туберкулеза, стафилококками.
Лечение вторичной IgA-нефропатии в первую очередь зависит от основного заболевания. При этом если при алкогольном циррозе и целиакии могут быть эффективны нелекарственные методы (алкогольная абстиненция, аглютеновая диета), то при ВИЧ+ и при HCV+ IgA-нефропатии показана противовирусная терапия, а при IgA-нефропатии в рамках Шенлейн–Геноховского васкулита или активного спондилоартрита показаны иммуносупрессанты.
Литература
ФГБОУ ДПО РМАНПО МЗ РФ, Москва
IgA- нефропатия при системных заболеваниях, персистирующих инфекциях, хронических болезнях печени/ А. Ю. Николаев, А. В. Малкоч
Для цитирования: Лечащий врач № 1/2018; Номера страниц в выпуске: 48-51
Теги: инфекция, болезни печени, поражение почек
Публикации в СМИ
Болезнь Берже
Болезнь Берже (IgA-нефропатия) — заболевание клубочкового аппарата почки с мезангиальными отложениями IgA, основным проявлением которого является рецидивирующая гематурия. Статистические данные. Наблюдают часто. Составляет от 5 до 50% случаев хронического гломерулонефрита; чаще болеют мужчины молодого возраста.
Генетические особенности • Выявлена ассоциация между IgA-нефритом и наличием Аг HLA-DR4, а также HLA-BW35 • Возможны семейные случаи • Выявлена связь прогрессирования IgA-нефропатии с полиморфизмом гена АПФ.
Патогенез • Выяснен далеко не полностью • Генетический или приобретённый дефект иммунной регуляции гиперпродукция IgA с его отложением в мезангии.
Патоморфология • Пролиферация мезангия • В мезангии отложения IgA.
Клиническая картина • Чаще развивается в молодом возрасте • Микрогематурия в сочетании с минимальной протеинурией (до 1 г/сут) без экстраренальных проявлений и нарушений функций почек. Характерна «синфарингитная» (возникающая после острого респираторного заболевания [ОРЗ]) макрогематурия, иногда с эпизодами болей в почках, ОПН. Гематурия появляется через 1–2 дня после лихорадочного состояния (в отличие от постстрептококкового гломерулонефрита) • Редко возникают нефротический или остронефритический синдром • У 30% больных наблюдают артериальную гипертензию; при длительном течении заболевания её частота увеличивается до 50%.
Лабораторные данные • Уровень комплемента в сыворотке не снижен • У 50–70% больных выявляют повышенную концентрацию в крови ЦИК, повышение IgA.
Диагностическая тактика • Диагноз основан на биопсии почек — отложения IgA обнаруживают методом иммунофлюоресценции • IgA-нефропатию следует предполагать, если у больного молодого возраста имеется рецидивирующая макрогематурия или изолированные микрогематурия и протеинурия, часто в сочетании с повышенным АД и эпизодами инфекций дыхательных путей.
Лечение • Иногда эффективны антибиотикотерапия или изменение диеты • Больным с изолированной гематурией назначают ингибиторы АПФ или блокаторы кальциевых каналов недигидропиридинового ряда, дипиридамол • При протеинурии более 1 г/сут, нарушении функций почек, артериальной гипертензии, отёках или морфологических признаках активности дополнительно назначают ГК: преднизолон в дозе 60 мг/сут через день в течение 3 мес с постепенным снижением дозы • При протеинурии более 3 г/сут или нефротическом синдроме — ГК, цитостатики, в т.ч. пульс-терапия циклоспорином. Лечение ХПН.
Наблюдение • Пациентов наблюдает нефролог или терапевт (педиатр): контроль АД, анализов крови, мочи, функции почек • Диета, санация очагов инфекции, коррекция артериальной гипертензии, антиагреганты.
Профилактика • Первичная профилактика не разработана • Вторичная —соблюдение диеты, предупреждение переохлаждений, простудных заболеваний.
Течение и прогноз вариабельны • 20-летняя выживаемость — около 50% • У 15–30% больных через 10–15 лет развивается почечная недостаточность. Прогностически неблагоприятные факторы: пожилой возраст, выраженная протеинурия, артериальная гипертензия и обнаружение полулуний или сегментарного склероза при биопсии почки.
МКБ-10. N02 Рецидивирующая и устойчивая гематурия.
Код вставки на сайт
Болезнь Берже
Болезнь Берже (IgA-нефропатия) — заболевание клубочкового аппарата почки с мезангиальными отложениями IgA, основным проявлением которого является рецидивирующая гематурия. Статистические данные. Наблюдают часто. Составляет от 5 до 50% случаев хронического гломерулонефрита; чаще болеют мужчины молодого возраста.
Генетические особенности • Выявлена ассоциация между IgA-нефритом и наличием Аг HLA-DR4, а также HLA-BW35 • Возможны семейные случаи • Выявлена связь прогрессирования IgA-нефропатии с полиморфизмом гена АПФ.
Патогенез • Выяснен далеко не полностью • Генетический или приобретённый дефект иммунной регуляции гиперпродукция IgA с его отложением в мезангии.
Патоморфология • Пролиферация мезангия • В мезангии отложения IgA.
Клиническая картина • Чаще развивается в молодом возрасте • Микрогематурия в сочетании с минимальной протеинурией (до 1 г/сут) без экстраренальных проявлений и нарушений функций почек. Характерна «синфарингитная» (возникающая после острого респираторного заболевания [ОРЗ]) макрогематурия, иногда с эпизодами болей в почках, ОПН. Гематурия появляется через 1–2 дня после лихорадочного состояния (в отличие от постстрептококкового гломерулонефрита) • Редко возникают нефротический или остронефритический синдром • У 30% больных наблюдают артериальную гипертензию; при длительном течении заболевания её частота увеличивается до 50%.
Лабораторные данные • Уровень комплемента в сыворотке не снижен • У 50–70% больных выявляют повышенную концентрацию в крови ЦИК, повышение IgA.
Диагностическая тактика • Диагноз основан на биопсии почек — отложения IgA обнаруживают методом иммунофлюоресценции • IgA-нефропатию следует предполагать, если у больного молодого возраста имеется рецидивирующая макрогематурия или изолированные микрогематурия и протеинурия, часто в сочетании с повышенным АД и эпизодами инфекций дыхательных путей.
Лечение • Иногда эффективны антибиотикотерапия или изменение диеты • Больным с изолированной гематурией назначают ингибиторы АПФ или блокаторы кальциевых каналов недигидропиридинового ряда, дипиридамол • При протеинурии более 1 г/сут, нарушении функций почек, артериальной гипертензии, отёках или морфологических признаках активности дополнительно назначают ГК: преднизолон в дозе 60 мг/сут через день в течение 3 мес с постепенным снижением дозы • При протеинурии более 3 г/сут или нефротическом синдроме — ГК, цитостатики, в т.ч. пульс-терапия циклоспорином. Лечение ХПН.
Наблюдение • Пациентов наблюдает нефролог или терапевт (педиатр): контроль АД, анализов крови, мочи, функции почек • Диета, санация очагов инфекции, коррекция артериальной гипертензии, антиагреганты.
Профилактика • Первичная профилактика не разработана • Вторичная —соблюдение диеты, предупреждение переохлаждений, простудных заболеваний.
Течение и прогноз вариабельны • 20-летняя выживаемость — около 50% • У 15–30% больных через 10–15 лет развивается почечная недостаточность. Прогностически неблагоприятные факторы: пожилой возраст, выраженная протеинурия, артериальная гипертензия и обнаружение полулуний или сегментарного склероза при биопсии почки.
МКБ-10. N02 Рецидивирующая и устойчивая гематурия.
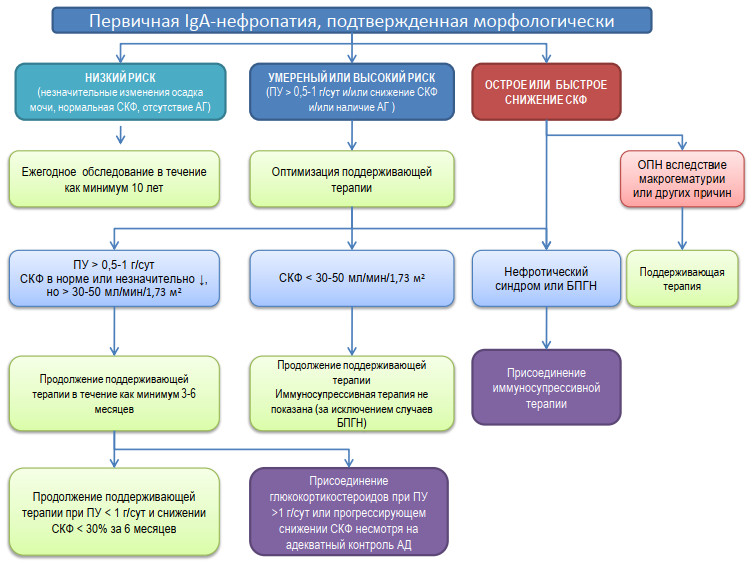
Клинические рекомендации по диагностике и лечению IgA-нефропатии
«Утверждено»
18 декабря 2014 г.
Рабочая группа
Шилов Е.М. Вице-президент НОНР, главный нефролог РФ, зав. кафедрой нефрологии и гемодиализа ИПО ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Министерства здравоохранения РФ, д.м.н., профессор
Бобкова И.Н. Зав. НИО нефрологии НИЦ, профессор кафедры нефрологии и гемодиализа ИПО ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Министерства здравоохранения РФ, д.м.н., ответственный секретарь НОНР
Колина И.Б. Старший научный сотрудник НИО нефрологии НИЦ ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Министерства здравоохранения РФ, к.м.н.
Камышова Е.С. Старший научный сотрудник НИО нефрологии НИЦ ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Министерства здравоохранения РФ, к.м.н.
АННОТАЦИЯ
Представленные рекомендации обобщают принятые в мире подходы к диагностике и лечению одного из наиболее распространенных видов гломерулонефрита – IgA-нефропатии. Они cоставлены в соответствии с современными международными [1] и отечественными [2] рекомендациями по лечению гломерулонефритов, основанными на результатах систематических обзоров и мета-анализов релевантных клинических исследований, а также накопленном на сегодняшний отечественном опыте адаптации международных рекомендаций к условиям Российского здравоохранения.
Данные Рекомендации не следует рассматривать в качестве стандарта оказания медицинской помощи, поскольку в существующей клинической практике объем диагностики и лечения определяется индивидуальными особенностями пациентов, доступностью ра зличных лекарственных средств и спецификой конкретного лечебного учреждения. За уместность применения данных Рекомендаций в конкретной ситуации несет ответственность использующий их врач.
ОЦЕНКА СИЛЫ РЕКОМЕНДАЦИЙ И УРОВНЯ ИХ ДОКАЗАТЕЛЬНОСТИ
Для рекомендаций сила указана как уровень 1, 2 или «нет степени» (табл.1), качество доказательной базы обозначено как А, В, С (табл.2).
.gif)