Что такое h2cro4 в химии
Хромовая кислота
| Хромовая кислота | |
 | |
 | |
| Общие | |
|---|---|
| Традиционные названия | хромовый ангидрид |
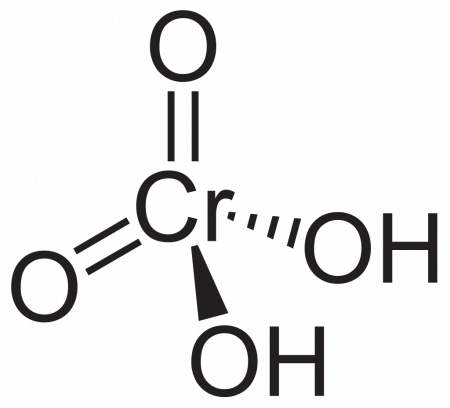
| Химическая формула | H2CrO4 |
| Физические свойства | |
| Состояние (ст. усл.) | твердые красные пласты |
| Молярная масса | 118.00958 г/моль |
| Плотность | 1,201 г/см³ |
| Термические свойства | |
| Температура плавления | 197 °C |
| Химические свойства | |
| Растворимость в воде | 166.66 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7738-94-5 |
| SMILES | O=[Cr](=O)(O)O |
| Регистрационный номер EC | 700 |
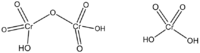
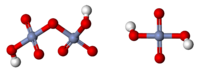
Хромовая кислота — кристаллическое вещество красного цвета; выделена в свободном состоянии при охлаждении насыщенных водных растворов хромата. Химическая формула H2CrO4.
Содержание
Свойства
Химические
Хромовая кислота — электролит средней силы. Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет. Соли хромовой кислоты являются сильными окислителями, ядовиты. В хромовой кислоте степень окисления хрома равна +6 (или VI). Хром, как и большинство переходных металлов, может существовать в нескольких степенях окисления. Шестая степень окисления самая высокая для хрома; третья степень является наиболее стабильной, вторая степень также. Реагирует с основными оксидами и гидроксидами натрия и калия, например амфотерные оксиды и гидроксид цинка с гидроксидом алюминия в ее присутствии или в реакции с хромовой кислотой поведут себя как слабые основания. Продукты реакции — вода и хроматы металлов.
Хромовой кислоте соответствуют соли — хроматы, изополихромовым кислотам — изополихроматы (также дихроматы, изополисоединения).
Получение
Применение
Растворы хромовой кислоты используют при электролитическом хромировании и получении хрома электролизом. Хромовая кислота является промежуточным веществом при хромировании, а также используется в керамической мураве и в цветных композициях стекла. Поскольку соединение хромовой кислоты в серной (также известная как «сульфохромовая кислота») является мощным окислителем, эта смесь может быть использована для очистки лабораторной посуды, или при смытии нерастворимых органических остатков.
Хромовую кислоту используют для производства:
Полезное
Смотреть что такое «Хромовая кислота» в других словарях:
Хромовая кислота — см. Хром … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Кислота — У этого термина существуют и другие значения, см. Кислота (значения) … Википедия
Хромовая смесь — Фильтр Шотта, залитый хромовой смесью Хромовая смесь смесь концентрированной серной кислоты и дихромата калия; при действии серной кислоты на бихромат образуется хромовый ангидрид CrO3. Хромовая смесь является одним и … Википедия
Уксусная кислота — (acidum aceticum, acide acétique, Essigsäure, acetic acid) в виде винного уксуса была известна уже древним (грекам, римлянам, евреям и др.); алхимики знали ее в более чистом состоянии, пользуясь для ее очищения перегонкой; позднее, в период… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
МОЛОЧНАЯ КИСЛОТА — (а оксипропионо вая к та) [СН3 £н(ОН) • СООН], содержит асимметрический атом углерода и потому существует в трех стереоизомерных формах. М. кислота, получаемая синтетически, является рацемической. Синтетическая М. к. представляет собой… … Большая медицинская энциклопедия
Коричная кислота — Коричная кислота … Википедия
Коричная кислота — (acide cinnamique, cinnamic acid, Zimmtsäure; хим.) C9H8O2=C6H5.CH:CH.CO2H (иначе β фенилакриловая или бензилиденуксусная кислота) находится в коричном масле (см.; Дюма и Пелиго), в толуанском (Фреми, Девилль, Копп) и перуанском бальзамах (Крафт; … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Chromic acid — Хромовая кислота, водный раствор хромового ангидрида, H2CrO4 … Краткий толковый словарь по полиграфии
Хром — (Chrom, Chrome, Chromium; при О = 16 атомн. вес Cr = 52,1) принадлежит к числу элементарных веществ металлического характера. Однако, занимая по своему атомному весу шестое место в том большом периоде естественной системы элементов, который… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
СОДЕРЖАНИЕ
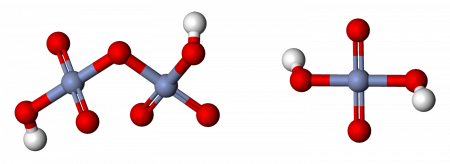
Молекулярная хромовая кислота
Кроме того, дихромат может быть протонирован:
Значение p K для этой реакции показывает, что ею можно пренебречь при pH> 4.
Молекулярная хромовая кислота в принципе может быть получена путем добавления триоксида хрома к воде ( см. Производство серной кислоты ).
Дихромовая кислота
Дихромовая кислота, H 2 Cr 2 O 7, является полностью протонированной формой дихромат-иона, а также может рассматриваться как продукт добавления триоксида хрома к молекулярной хромовой кислоте. Дихромовая кислота будет вести себя точно так же при взаимодействии с альдегидом или кетоном. Однако оговорка к этому утверждению заключается в том, что вторичный кетон не будет окисляться дальше, чем кетон, а дихромовая кислота будет окислять только альдегид. Альдегид будет окисляться до кетона на первой стадии механизма и снова окисляться до карбоновой кислоты при отсутствии значительных стерических препятствий, препятствующих этой реакции. То же самое произошло бы с PCC в отношении окисления вторичного кетона, более мягкого окислителя. Дихромовая кислота подвергается следующей реакции:
Использует
Он используется в качестве отбеливателя при обращении черно-белых фотографий.
Реакции
Хромовая кислота способна окислять многие виды органических соединений, и было разработано множество вариантов этого реагента:
Иллюстративные преобразования
Использование в качественном органическом анализе
Альтернативные реагенты
Безопасность
Триоксид хрома и хромовая кислота являются сильными окислителями и могут бурно реагировать при смешивании с легко окисляемыми органическими веществами. Это может привести к пожару или взрыву.
Ожоги хромовой кислотой обрабатывают разбавленным раствором тиосульфата натрия.
Хромовая кислота
| Хромовая кислота | |||
|---|---|---|---|
| |||
| Хим. формула | H2CrO4 | ||
| Состояние | твердые красные пласты | ||
| Молярная масса | 118.00958 г/моль | ||
| Плотность | 1,201 г/см³ | ||
| Температура | |||
| • плавления | 197 °C | ||
| • разложения | 387 ± 1 °F и 482 ± 1 °F | ||
| Растворимость | |||
| • в воде | 166.66 г/100 мл | ||
| Рег. номер CAS | 7738-94-5 | ||
| PubChem | 24425 | ||
| Рег. номер EINECS | 231-801-5 | ||
| SMILES | |||
| ChEBI | 33143 | ||
| ChemSpider | 22834 | ||
| ЛД50 | 51 мг/кг | ||
| Токсичность | Высокотоксичное и канцерогенное вещество | ||
| Пиктограммы ECB |     | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Хромовая кислота — кристаллическое вещество красного цвета. Химическая формула H2CrO4. В водных растворах имеет жёлтый цвет. Выделена в свободном состоянии при охлаждении насыщенных водных растворов хромата.
Соли хромовой кислоты называются хроматами. Сильный окислитель. Токсична, канцерогенна.
Содержание
Свойства
Химические
Хромовая кислота — электролит средней силы. Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет. Соли хромовой кислоты являются сильными окислителями, ядовиты. В хромовой кислоте степень окисления хрома равна +6. Хром, как и большинство переходных металлов, может существовать в нескольких степенях окисления. Степень окисления +6 самая высокая для хрома; степень окисления +3 является наиболее стабильной, степень окисления +2 также. Реагирует с основными оксидами и гидроксидами натрия и калия, например амфотерные оксиды и гидроксид цинка с гидроксидом алюминия в её присутствии или в реакции с хромовой кислотой поведут себя как слабые основания. Продукты реакции — вода и хроматы металлов. Хромовой кислоте соответствуют соли — хроматы, изополихромовым кислотам — изополихроматы (также дихроматы, изополисоединения).
Получение
Применение
Растворы хромовой кислоты используют при электролитическом хромировании и получении хрома электролизом. Хромовая кислота является промежуточным веществом при хромировании, а также используется в керамической мураве и в цветных композициях стекла. Поскольку раствор хромовой кислоты в серной (также известная как «сульфохромовая кислота») является мощным окислителем, эта смесь может быть использована для очистки лабораторной посуды, или для растворения нерастворимых органических остатков.
Также растворы хромовой кислоты являются качественным реактивом на серебро, наносится тонким слоем на металл. В случае, если изделие сделано из серебра, на нём в месте контакта с реактивом возникает кроваво-красное пятно. Чем чище серебро, тем интенсивнее окраска.
Хромовую кислоту используют для производства:
Безопасность
Хромовая кислота очень ядовита и канцерогенна, как и все соединения шестивалентного хрома. Как и все кислоты, обладает ещё и коррозионным действием.
Смертельная доза (ЛД50) составляет 51 мг/кг.
В России все соединения шестивалентного хрома относятся к 1 классу опасности.
ХРОМАТЫ И ДИХРОМАТЫ
ХРОМАТЫ И ДИХРОМАТЫ. Хроматы – соли не существующей в свободном состоянии хромовой кислоты H2CrO4, получаемой лишь в виде водных растворов с концентрацией не выше 75%. Их получают при взаимодействии оксида хрома(VI) или раствора хромовой кислоты H2CrO4 с оксидами, гидроксидами, карбонатами металлов или при обменной реакции с участием растворимых солей-хроматов. Хорошо растворяются в воде хроматы щелочных металлов и магния, а для щелочноземельных металлов растворимость настолько резко снижается в ряду CaCrO4 – SrCrO4 – BaCrO4 – RaCrO4, что на этом удалось построить лабораторный способ разделения кальция, стронция и бария: хромат кальция не выпадает в осадок из миллимолярных (0,001 моль/л) растворов, а осадок хромата стронция, в отличие от хромата бария, растворяется под действием уксусной кислоты.
В отличие от хроматов, почти все соли-дихроматы хорошо растворимы в воде. Дихроматы – сильные окислители. В кислой среде для них характерна полуреакция:
Особые свойства у дихромата аммония: он легко разлагается. При слабом нагревании дихромат аммония (NH4)2Cr2O7 самовоспламеняется с выбрасыванием искр (этот опыт называют химическим вулканом) – раскаленных частичек оксида хрома(III) Cr2O3, газообразного азота N2 и паров воды. Хромат калия K2CrO4 плавится без разложения при 968° С, а дихромат калия K2Cr2O7 разлагается в соответствии с уравнением реакции:
4K2Cr2O7 = 4K2CrO4 + 2 Cr2O3 + 3O2
Наиболее широко применяются хромат и дихромат калия и дихромат аммония.
Хроматометрия (точнее – дихроматометрия) – объемный (титриметрический) метод химического анализа (см. ТИТРОВАНИЕ), основанный на применении раствора K2Cr2O7 определенной концентрации и позволяющий определить содержание восстановителей и некоторых катионов металлов.
Смесь равных объемов насыщенного на холоде раствора K2Cr2O7 и концентрированной серной кислоты (хромовая смесь) обладает очень сильным окислительным действием и применяется в лабораториях для мытья химической посуды.
Дихромат аммония также не образует кристаллогидратов, но разлагается при нагревании. Это оранжевые кристаллы с плотностью 2,15 г/см 3 и растворимостью 35,6 г/100 г воды (при 20° С). Удобный исходный реагент для получения высокочистого оксида хрома(III) (стойкий зеленый пигмент и составная часть некоторых катализаторов и известной смеси для полировки оптики – пасты ГОИ). Кроме того, дихромат аммония применяется как компонент светочувствительного слоя фотоматериалов и ряда пиротехнических составов, консервант древесины, окислитель в органическом синтезе и отбеливатель для жиров, воска и парафина.
Хроматы применяются также в качестве протравы при крашении, дубящих реагентов в кожевенном производстве, для протравы семян (K2CrO4), ингибиторов коррозии (CaCrO4, BaCrO4, ZnCrO4), пигментов (баритовый желтый BaCrO4, желтый крон PbCrO4, красный крон Pb2CrO5) а также выступают в роли компонентов материалов для термохромных датчиков.
Хроматы встречаются в природе, в первую очередь это, например, минерал крокоит PbCrO4. Именно этот минерал, привезенный во Францию с Урала («сибирский красный свинец»), послужил в 1797 сырьем для получения оксида хрома, из которого Никола Воклен впервые выделил новый элемент – хром. Другие хроматные минералы – лопецит (дихромат калия, калиевый хромпик), и тарапакаит (хромат калия) распространены значительно меньше.