Что такое gmp в фармации
Что такое gmp в фармации
Международный стандарт GMP считается одним из основных в мире, определяющих требования к производству лекарственных средств, БАДов и даже продуктов питания.
Для чего предназначен стандарт?
Полное название этого набора требований – Good Manufacturing Practice for Medicinal Products, что в переводе означает «Правила производства медицинской продукции». Международный стандарт GMP имеет следующие цели:
1. Обеспечить высокий уровень качества продукции.
2. Гарантировать, что:
История возникновения
Начало стандарту было положено в США в 1963 году, когда появились на свет первые правила безопасного и качественного изготовления лекарственных средств. Стандартную форму официального документа, впрочем, они приняли лишь в 1968 году. А через год Всемирная организация здравоохранения (ВОЗ) рекомендовала всем странам применять международный стандарт GMP. Впоследствии эти правила неоднократно дополнялись и корректировались, пока не приняли нынешний вид.
Откровенно игнорировал стандарт на начальном этапе его внедрения лишь Советский Союз, Минздрав которого разработал свои нормы, по строгости иногда превышающие GMP. Интерес к международному стандарту начал проявляться лишь с 1991 года, когда начались процессы по импорту и экспорту лекарств. Однако на первых порах достичь гармонии столь различных правил не удавалось. Лишь с 90-х годов появились какие-то реальные подвижки.
Российский стандарт
Нормативная база на территории стран СНГ начала разрабатываться после распада СССР. Главная цель была – на основе прежних нормативов максимально сблизить два стандарта, постепенно приближаясь к правилам, которые определял GMP (международный стандарт качества).
Процесс оказался долгим. Только в 2001 году в РФ появился близкий международному стандарт. Он предусматривает, что с 01.07.2000 все создаваемые и реконструируемые предприятия по выпуску лекарств будут получать лицензии на производство, хранение и реализацию продукции только при условии соответствия российскому аналогу GMP.
Разработкой его занималась организация под названием Ассоциация инженеров по контролю микрозагрязнений (АСИНКОМ). Отечественные правила были утверждены 10.04.2004 Госстандартом РФ, в результате чего появился ГОСТ Р 52249-2004 «Правила производства и контроля качества лекарственных средств». Он был введен в действие 01.01.2005, и считалось, что этот стандарт максимально сближен с международным. Однако с 01.01.2010 начал работать национальный российский стандарт GMP. Он взял за основу европейские правила, и прежний ГОСТ утратил актуальность.
Где в РФ расположены применяющие стандарт предприятия
Подавляющее большинство предприятий, которые получили сертификаты качества, соответствующие международным правилам, пока расположены в Москве, Санкт-Петербурге и других крупных промышленных и научных центрах страны.
Планируется полный перевод на GMP (международный стандарт) всех предприятий. Более того, он должен был закончиться еще в 2014 году, но возникло множество трудностей. Выяснилось, что далеко не каждое отечественное предприятие фармацевтической отрасли способно получить соответствующий сертификат качества. Главная проблема – нет кадров, имеющих достаточную теоретическую и, что особенно важно, практическую подготовку по внедрению стандарта на российской территории.
Основные элементы стандарта GMP
Стандарт GMP (Good Manufacturing Practice) предусматривает множество показателей, которым должны соответствовать производители продукции. Причем для фармацевтов детально регламентированы требования к каждому этапу изготовления – от концентрации бактерий, содержащихся в одном кубометре воздуха, до маркировки продукции.
В качестве примера можно привести требование к предприятию, изготавливающему лекарства в таблетках. В таких случаях GMP (международный стандарт) требует от организации «особо чистых цехов», в которых повышенная стерильность процесса достигается входными шлюзами для персонала, специальным режимом воздушной фильтрации и т. п. В России в таких цехах изготавливали лишь кремниевые кристаллы и особые микросхемы.
Какие условия нужны для перехода на стандарт?
Чтобы перевести российские предприятия на международный стандарт GMP, нужны и внешние, и внутренние условия. На государственном уровне требуется:
Чтобы выполнялся GMP-стандарт, правила GMP на уровне предприятий должны предусматривать следующие позиции:
Нужен ли стандарт для потребления лекарств внутри РФ?
При ответе на вопрос о том, нужен ли GMP (международный стандарт) в России, обычно рассматривается два аспекта.
1. С одной стороны, соблюдение его строжайших правил позволяет поднять планку качества лекарственных средств на очень высокий уровень. Население России тогда получит высокоэффективные и чистые лекарства, что позволит меньше болеть и скорее выздоравливать.
2. С другой стороны, отечественные предприятия финансово просто не «тянут» преобразования. Если же предприятие удается перевести на современные рельсы, то себестоимость лекарств существенно возрастает, и их реализация усложняется.
Оба эти фактора в России постоянно вступают в противоречие и тормозят внедрение стандарта. Впрочем, в связи с новыми геополитическими реалиями и необходимостью в импортозамещении лекарственных средств процесс должен в ближайшее время ускориться.
Смотри на упаковке: Что такое GMP и зачем обращать на это внимание при покупке лекарств?
Informburo.kz совместно с компанией SANTO рассказывает, зачем фармацевтическим компаниям нужен стандарт GMP, и что всё это значит для покупателя.
Покупая лекарства, хочется быть уверенным, что они помогут решить проблемы со здоровьем, ну или хотя бы, не навредят. Стандарт GMP – самая проверенная и надёжная система обеспечения качества фармацевтических препаратов в мире. Она гарантирует наилучшее качество продукта, его постоянную проверку и соответствие мировым стандартам производства.
№1. Что такое GMP?
GMP (Good Manufacturing Practice; Надлежащая производственная практика) – это международный стандарт, определяющий требования к производству лекарственных препаратов, БАДов, пищевых добавок и некоторых продуктов питания. В международный стандарт GMP включены все требования, которым должно отвечать предприятие-производитель: от температуры в производственном цехе до одежды работников. Стандарты GMP – это не просто пожелания к производству препаратов, а строгие требования. Употребляя лекарства или продукты компаний, имеющих сертификат GMP, потребитель может быть спокоен за своё здоровье.
№2. Зачем нужен этот стандарт, и чем он отличается от других?
GMP – принципиально новый подход к соблюдению технологий производства. Обычный контроль качества предполагает исследование только некоторых, причём уже готовых, образцов продукции и гарантирует лишь их качество или качество партии, выпущенной в то же время. По стандартам GMP производится комплексная лабораторная проверка и регулирование всех параметров производства, а значит – обеспечение качества всей продукции. Правила GMP вводятся, чтобы снизить риск ошибок на производстве до минимума.
№3. Какие правила есть в своде GMP?
Кроме GMP в мировой практике распространены и другие стандарты надлежащих практик исследования, производства, дистрибьюции, хранения и лекарственного обеспечения:
Читайте также:
№4. GMP – это какой-то новый тренд?
Нет, это не очередной скоропортящийся тренд. Мировая история GMP стандартов берёт своё начало с 1963 года в США, где группой ученых были разработаны специальные правила для регламентирования условий качественного и безопасного производства лекарственных препаратов – стандарт Good Manufacturing Practice (GMP). Начиная с 70 годов, GMP получил широкое распространение во всем мире, за исключением Советского Союза. Уже после распада СССР страны СНГ начали подстраивать существующие нормативные базы к правилам GMP.
№5. А Казахстан принял стандарт GMP?
Стандарты надлежащих фармацевтических практик, в том числе GMP, были утверждены в системе Госстандарта Республики Казахстан ещё в 2006 году. Тогда они носили рекомендательный, добровольный характер. Но уже с марта 2014 года все иностранные компании, экспортирующие продукцию в Казахстан, должны были подтвердить, что работают по стандарту GMP, иначе ввоз их продукции в страну запрещался. В 2015-м стандарты GMP актуализировали с учётом требований ЕС и ЕАЭС. С января 2016 года начал функционировать общий рынок лекарств для стран Евразийского экономического союза. На территории ЕАЭС должны производиться и распространяться только медицинские препараты стандарта GMP, который подтверждает эффективность, безопасность и качество продукции.
С 1 января 2018 года стандарты GMP сделали обязательными для казахстанских производителей. Те из них, кто ещё не внедрил GMP, могут подавать заявку на проведение оценки безопасности и качества продукции и реализовывать препараты до истечения сроков действия их регистрационных удостоверений.
№6. Какие производители имеют сертификат соответствия GMP?
Производители продукции, изготовление которой регламентировано стандартом GMP, должны пройти процедуру сертификации. Наличие сертификата GMP у производителя подтверждает, что:
Сертификаты GMP в Казахстане уже получили 58 предприятий. Одним из первых отечественных производителей, активно внедряющих этот стандарт, стала компания SANTO. Компания получила первый сертификат GMP по производству мягких лекарственных форм в 2011 году. В 2012-м SANTO получила сертификат GMP на производственный участок асептической рассыпки порошковых антибиотиков. В 2013-м – сертификат на действующий ампульный цех, в 2014-м – на производство инъекционных растворов в цехе по производству инъекционных растворов и инфузий. В 2015-м SANTO был выдан сертификат GMP на производственный участок инфузионных растворов, а в 2018-м – на производственные площадки по производству инъекционных растворов и инфузий, производству твёрдых пероральных лекарственных средств. Также SANTO – обладатель сертификата на соответствие аптечного склада стандарту надлежащей дистрибьютерской практики (GDP). Обладание такими сертификатами – веское подтверждение того, что система обеспечения качества и условия производства в компании отвечают правилам надлежащей производственной практики Республики Казахстан.
№7. Я пришёл в аптеку. Как узнать, что нужное мне лекарство произведено по правилам GMP?
Некоторые производители указывают это прямо на упаковке, ведь знак GMP – гарантия качества. Но даже если вы не нашли этой аббревиатуры на коробочке, важно помнить, что с 2014 года все иностранные лекарства, продающиеся в Казахстане, соответствуют GMP. Другие зарубежные лекарственные препараты в нашей стране не регистрируются.
Отечественные производители также постепенно внедряют стандарт в производство. Полный список компаний, уже имеющих сертификат соответствия GMP, можно посмотреть на сайте Министерства здравоохранения РК.
Читайте также:
№8. В Казахстане производят много лекарств?
Да, в Казахстане производят многие лекарства. Всего на казахстанском фармацевтическом рынке представлено больше 700 компаний. Один из лидеров казахстанской фарминдустрии – компания SANTO – производит более 200 генерических препаратов и оригинальных лекарственных препаратов 12 фармакологических групп. Производственные мощности компании позволяют ежегодно выпускать 1 млрд. 283 млн. таблеток, капсул и гранул, 294 млн. ампул, 6 млн. инфузий, 40 млн флаконов порошков антибиотиков (цефалоспорины ) и 13 млн. флаконов порошков антибиотиков (пенемы/мицины) и 4,5 млн. флаконов жидких пероральных лекарственных средств. 90% продукции реализуется на внутреннем рынке страны, 10% экспортируется в Россию, Кыргызстан, Таджикистан, Монголию и Туркменистан.
№9. Как GMP влияет на казахстанскую фармацевтическую индустрию?
Внедрение GMP гарантирует обычным покупателям, что отечественные препараты ничем не уступают иностранным, потому что произведены по единому стандарту. Подтверждение стандартов способствует более свободному продвижению казахстанских препаратов на внешних рынках. По данным Казахстанского института развития индустрии за 2017 год в Казахстане было произведено фармацевтической продукции на 73,4 млрд тенге. На три региона – Южно-Казахстанскую и Алматинскую области и город Алматы – пришлось 92,3% прибыли от произведённой продукции. Старейшее предприятие ЮКО – АО «Химфарм» с торговой маркой SANTO – лидер среди казахстанских производителей лекарственных средств и часть международной фармацевтической группы Polpharma. Это одно из первых казахстанских предприятий, которое подтвердило соответствие государственному стандарту Надлежащей производственной практики (GMP) и получило сертификаты соответствия.
Сертификат GMP: подтверждение качества лекарственных средств
Сертификат GMP — это соблюдение изготовителем лекарственных препаратов требований надлежащей производственной практики. В России они сформулированы в национальном стандарте ГОСТ Р 52249-2009, который идентичен правилам, действующим в Европейском Союзе.
К каким производствам применима эта процедура?
В настоящее время в странах, которые контролируют соответствие стандарту GMP на своих территориях, его правила применяются для проверки качества следующих категорий продукции:
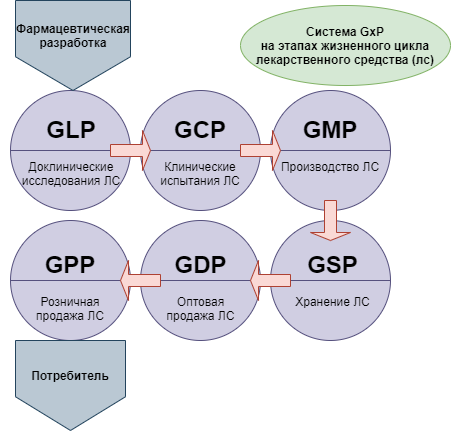
При этом для понимания ситуации следует принимать во внимание, что новая версия сертификации GMP — это не единственная система требований, которые в международной практике применяются в целях стандартизации медицинского обслуживания населения. Кроме них, производителям, работающим в такой сфере как фармация, необходимо соответствовать требованиям комплекса правил, объединенных под общим наименованием GxP:
Нормативная база
В Российской Федерации получение сертификата GMP осуществляется на основании действующей нормативной базы, включающей следующие основные правовые акты:
При этом необходимо принимать во внимание, что в настоящий момент наша страна вместе с другими государствами, входящими в состав Евразийского экономического союза, находится на этапе становления общего рынка, объединяющего фармацевтическое и косметическое производство в границах Союза. Это предполагает в том числе введение в действие единых требований к качеству и безопасности таких продуктов. В соответствии с принятым в мире порядком они реализуются в форме внедрения стандартов надлежащей производственной практики. Применение таких стандартов регулируется следующими нормативными документами:
Обратите внимание!
Для полноценного применения разработанного административного регламента необходимо решение Правительства о порядке реализации некоторых процедур, связанных с проведением фармацевтических инспекций. Приказ № 2945 вступит в силу только после принятия соответствующего постановления: пока этого не произошло.
Преимущества обладания сертификатом
Несмотря на необходимость проведения достаточно сложной и дорогостоящей процедуры, производители знают, что сертификация по стандартам GMP является весьма важной для представителей фармацевтической отрасли. В частности, оно обеспечивает продукции и производству следующие серьезные преимущества:
КОММЕНТАРИЙ ЭКСПЕРТА АТТЭК
Каков срок действия сертификата?
Срок действия российских сертификатов составляет 3 года. При этом срок действия иностранного сертификата GMP составляет от 1 до 3 лет. По истечении этого периода сертификацию потребуется проходить заново. Кроме того, это означает, что на протяжении всего этого срока компании необходимо обеспечить соответствие своего производства и продукции требованиям комплекса правил GMP.
Кто в России занимается сертификацией по стандартам GMP?
Сейчас сертификация контролируется департаментом развития медицинской и фармацевтической промышленности Министерства промышленности и торговли РФ. Он является организацией, ответственной за обеспечение надлежащего контроля за качеством, безопасностью и эффективностью лекарственных средств. Осуществлением требуемых сертификационных процедур занимается Государственный институт лекарственных средств и надлежащих практик (ФГБУ «ГИЛС и НП»).
Стандарт GMP в международной практике
Процесс сертификации на соответствие лекарственного препарата стандартам GMP в международной практике имеет комплексный характер, а ее основной целью является подтверждение безопасности и действенности продукции. В этой связи для достижения поставленной цели специалисты аккредитованных сертификационных организаций не ограничиваются оценкой ряда выборочных образцов лекарственных препаратов, как это часто предусматривается другими стандартами. В процедуру установления требуемого уровня качества лекарств любой международный центр сертификации лекарственных средств включает оценку предприятия, занимающегося его выпуском. В результате эксперты, занимающиеся проведением сертификации, анализируют конкретный препарат и процесс его выпуска в следующих областях:
Правила GMP в России
Порядок и сроки проведения всех операций в рамках этой процедуры, список лиц и организаций, ответственных за их осуществление, размер платы за проведение экспертной оценки и другие аспекты выполнения сертификации определены постановлением Правительства № 1314.
Процедура получения сертификата в России
Первым шагом для производителя, который желает пройти сертификацию, является подача соответствующего заявления в Минпромторг. В течение 10 рабочих дней специалисты ведомства проводят проверку корректности представленных в заявлении сведений и определяют возможность проведения сертификации.
В случае необходимости они вправе запросить у заявителя дополнительные документы, которые он обязан предоставить в течение 20 рабочих дней. В случае, если в отношении данного препарата принято положительное решение о проведении процедуры сертификации, необходимые данные направляются в ФГБУ «ГИЛС и НП», который в течение 20 рабочих дней с момента их получения обязан определить дату проведения сертификационных мероприятий и внести ее в график. Такая дата должна наступить не позднее 160 рабочих дней со дня, когда специалисты Минпромторга приняли положительное решение о сертификации, а сама экспертиза и расшифровка ее результатов должны занимать не более 10 рабочих дней.
На подготовку итогового отчета по результатам ее проведения исполнителю отводится 30 рабочих дней, а на его направление заявителю — 3 рабочих дня. Копия такого отчета также направляется в Минпромторг. На основании отчета формируется окончательное заключение, которое в случае положительного характера сопровождается выдачей сертификата производителю лекарственного препарата.
Документы для сертификации
Чтобы получить сертификат GMP в России, производитель обращается в уполномоченный орган с заявлением, к которому прилагает пакет документов, включающий:
Важнейшие документы предоставляются заявителем в копиях, поскольку при утере их восстановить невозможно или очень сложно. Правила регламентируют, что если заявление подает иностранный производитель, и некоторые документы в составе пакета представлены на другом языке, они должны быть переведены на русский язык и заверены в установленном порядке.
Сроки сертификации
Общая продолжительность процедуры сертификации складывается из следующих сроков.
Этап сертификационной процедуры
Максимальная допустимая продолжительность
Проверка полноты пакета документации, представленной с заявлением о сертификации, и правильности ее оформления, назначение инспекции
Направление информации о назначении инспектирования в уполномоченное учреждение, которое проводит проверку
Инспектирование и анализ лекарственного средства
Принятие решения о выдаче заключения по результатам инспекционного отчета
160-дневный период инспектирования включает внесение производителя в график инспекций, ожидание процедуры и проведение самой инспекции. Она должна занимать не более 10 рабочих дней.
Такой порядок действует, если в документации, поданной производителем, не обнаружат ошибок и недочетов, из-за которых ее могут направить на доработку. В этом случае вся процедура займет немногим более 180 рабочих дней, то есть свыше 8 месяцев.
Стоимость получения сертификата
Обязательной для всех производителей лекарственных средств, претендующих на получение сертификата, подтверждающего соответствие их продукции стандартам GMP, является оплата государственной пошлины за рассмотрение соответствующего заявления в Министерстве промышленности и торговли. Ее размер составляет 7500 рублей. Оплатить данную сумму необходимо еще до подачи заявления в ведомство, а ее размер никак не зависит от результатов рассмотрения документа.
Однако данная пошлина — это далеко не единственный и не самый крупный платеж, который потребуется осуществить производителю лекарств. Другой значительной статьей расходов станет плата за проведение экспертной оценки производства и продукции заявителя. Такая процедура выполняется специалистами ФГБУ «ГИЛС и НП»: для каждого из них предварительно проводится аттестация эксперта по GMP в России.
При этом размер платы за проведение оценки не является строго установленным, а определяется в зависимости от объема, характера и сложности необходимых процедур в соответствии с положениями приказа Министерства промышленности и торговли Российской Федерации от 11.01.2016 № 9 «Об утверждении методики определения размера платы за оказание услуги по инспектированию GMP». В случае, если проверка потребует проведения значительного объема работы и привлечения большого количества высококвалифицированных экспертов, размер платы за ее проведение может превышать 2,5 миллиона рублей.
GMP (стандарт)
GMP (стандарт)
Стандарт GMP («Good Manufacturing Practice», Надлежащая производственная практика) — система норм, правил и указаний в отношении производства лекарственных средств, медицинских устройств, изделий диагностического назначения, продуктов питания, пищевых добавок и активных ингредиентов. В отличие от процедуры контроля качества путём исследования выборочных образцов таких продуктов, которая обеспечивает пригодность к использованию лишь самих этих образцов (и, возможно, партий, изготовленных в ближайшее к данной партии время), стандарт GMP отражает целостный подход и регулирует и оценивает собственно параметры производства и лабораторной проверки.
В комплексе со стандартами GLP (Надлежащая лабораторная практика) и GCP (Надлежащая клиническая практика) призван стандартизовать некоторые аспекты качества медицинского обслуживания населения. См. внизу категорию GxP.
В России в феврале 1998 года вступил в силу совместный приказ Минздрава России и Минэкономики России о введении в действие стандарта отрасли ОСТ 42-510-98 «Правила организации производства и контроля качества лекарственных средств», который устанавливал, что с 1 июля 2000 года приемка в эксплуатацию вновь созданных и реконструированных предприятий-производителей лекарственных средств и фармацевтических субстанций, выдача этим предприятиям лицензий на производство, хранение и распространение продукции осуществляются лишь в случае соответствия стандарту GMP в его российском варианте.
Российский стандарт GMP был подготовлен Ассоциацией инженеров по контролю микрозагрязнений (АСИНКОМ) и в 2004 году постановлением Госстандарта России от 10 марта 2004 года № 160-ст был утвержден ГОСТ Р 52249-2004 «Правила производства и контроля качества лекарственных средств», который гармонизирован с правилами GMP (Good Manufacturing Practice for medicinal products) Европейского союза.
Содержание
Концепция GMP
Международный стандарт GMP (Good Manufactured Practice) включает в себя достаточно обширный ряд показателей, которым должны соответствовать предприятия, выпускающие ту или иную продукцию. GMP для фармацевтических предприятий определяет параметры каждого производственного этапа — от материала, из которого сделан пол в цеху, и количества микроорганизмов на кубометр воздуха до одежды сотрудников и маркировки, наносимой на упаковку продукции.
В настоящее время важнейшими элементами концепции GMP являются:
Приметой времени можно также считать внедрение строгих методических правил в работу государственных органов нормативного контроля лекарств: систем качества, мер по предотвращению конфликта интересов у сотрудников, мер по сохранению конфиденциальности документации.
Основные положения концепции перехода к работе по правилам GMP
Для перехода к работе по правилам GMP в России прежде всего требуется создание соответствующих условий на общегосударственном уровне. Необходимы, в частности:
На отраслевом уровне приоритетными направлениями программы перехода к работе по правилам GMP следует считать организованный пересмотр всей технологической и контрольной документации в сторону использования предприятиями только тех документов, которые соответствуют регистрационным материалам.
На уровне отдельных предприятий поэтапное внедрение правил GMP желательно планировать и осуществлять исходя из следующих соображений: