Что такое fda в медицине
Национальная библиотека им. Н. Э. Баумана
Bauman National Library
Персональные инструменты
Food and Drug Administration
Содержание
История возникновения организации
С тех пор FDA изменилось вместе с социальными, экономическими, политическими и правовыми изменениями в Соединенных Штатах Америки. И представляет собой в настоящее время правительственное агенство, которое активно развивается и расширяет сферы своего влияния. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США также занимается вопросами, касающимися цвета кожи, национальной принадлежности, возраста, инвалидности или пола. Оно не исключает людей и не относится к ним по-разному из-за расы, цвета кожи, национальной принадлежности, возраста, инвалидности или пола.
Функции и задачи Food and Drug Administration
FDA находится в ведении человека, назначенного президентом, по рекомендации сената и подотчетного министру здравоохранения и социального обеспечения. Агентство находится в ведении Министерства здравоохранения и социальных служб США, федерального исполнительного департамента США.
В задачи агентства входит:
Структура Food and Drug Administration
Структура федерального агентства и ее подразделений представляет собой такую систему (см. рисунок 1).
Подчиненные FDA агентства:
Однако начиная с 31 марта 2019 года, FDA начнет оперативную реализацию реорганизации агентства. Реорганизация FDA отражает стремление агентства модернизировать свою структуру, чтобы продвигать свою миссию по защите и укреплению общественного здравоохранения, а также решать задачи быстрых инноваций в отраслях, регулируемых FDA. Реорганизация FDA перенастроит несколько организаций в рамках агентства для продвижения стратегических приоритетов и повысит роль центров, офисов и полевых сил (см. рисунок 2). [Источник 3]
Торговое представительство Food and Drug Administration
В ходе регистрации предприятия в системе FDA отдельным этапом является подтверждение производителем продукта питания соблюдения при его производстве, транспортировке и хранении Надлежащей производственной практики (Current Good Manufacturing Practice for foods). Указанные правила являются сводом основных норм, регламентирующих общие обязательства производителей и дистрибьюторов продуктов питания по обеспечению чистоты и безопасности продуктов в ходе их производства, перевозки, упаковки и хранения. Подтверждая при регистрации соответствия правилам надлежащей производственной практики, производитель несет ответственность (вплоть до уголовной) в случае выявления FDA фактов отступления от Практики, выявленных в ходе последующих возможных проверочных мероприятий. На стадии регистрации проверочные мероприятия не проводятся, подтверждение соответствия осуществляется в форме самодекларирования. Помимо регистрации надлежащей производственной практики, производители и импортеры соков и морепродуктов должны разработать дополнительную систему рисков при их производстве.
В соответствии с требованиями Публичных законов: «О продуктах питания, лекарствах и косметических средствах» (Federal Food, Drug, and Cosmetic Act), «О надлежащей упаковке и маркировке товаров» (Fair Packaging and Labeling Act), «О маркировке продуктов питания» (Nutrition Labeling and Education Act) маркировка пищевых продуктов должна осуществляться на английском языке и должна содержать, как минимум, следующую информацию:
Детальное правовое регулирование данного вопроса может быть найдено в пункте 101 подглавы В главы I раздела 21 Кодекса федерального регулирования США. Кроме того, практический интерес в процессе маркировки продуктов питания для целей экспорта в США может представлять практическое руководство для экспортеров по данным вопросам, подготовленное FDA.
Помимо указанных выше общих требований, дополнительные требования могут устанавливаться в зависимости от вида ввозимого в США продукта питания (см. соответствующие разделы применительно к отдельным видам продуктов). При поставке в США продукции незарегистрированного производителя она будет задержана на таможне без права дальнейшего выпуска на таможенную территорию США. Если в результате проведенных исследований FDA придет к выводу о том, что ввозимый товар не соответствует требованиям безопасности, предусмотренным в США, экспортеру предоставляется возможность в течение 10 дней предоставить доказательства соответствия товара требованиям законодательства США (например, путем предоставления независимых лабораторных исследований). Если в ходе рассмотрения возражений FDA придет к выводу о не устранении подозрений в несоответствии ввезенного товара, FDA вправе отказать в выпуске товара на таможенную территорию США с ликвидацией товара либо с возложением на собственника партии обязанности вывезти продукцию с территории США.
Кроме того, FDA вправе приостановить на срок до 30 дней выпуск продукции, если имеются обоснованные подозрения в том, что товар содержит признаки фальсификации, маркировка продукции не соответствует предъявляемым в США требованиям либо в составе продукции имеются посторонние примеси, содержание которых в данном продукте (полностью или в имеющемся объеме) не допускается установленным для продукта техническом регламенте. [Источник 4]
Высокая вероятность одобрения FDA! Или как искать акции с высоким потенциалом в секторе здравоохранения?
Содержание статьи
Можно ли на фондовом рынке за пару дней заработать 100% прибыли от вложенных средств? Конечно можно. 100%, 200% и даже 300%. Предела на фондовом рынке нет.
Все, что надо трейдеру для получения прибыли – это терпение.
Но мы все знаем, что чем выше прибыль, тем выше риск, а риск в основном связан с использованием кредитного плеча. Однако на фондовом рынке и так есть возможности получить огромную прибыль, не используя плечо. Тогда представляете, что будет если для высокоприбыльных сделок задействовать возможности кредитного плеча?
Например, в платформе R StocksTrader есть возможность использовать кредитное плечо для овернайт позиций 1:4. Таким образом, доходность можно смело умножать в 4 раза. Сразу закрадывается мысль, а в чем же здесь подвох и почему все трейдеры, работающие на фондовом рынке, до сих пор не стали миллионерами.
Да, есть определенного рода барьеры, которые мешают получить такую прибыль. Вся проблема кроется в том, как узнать, какая из примерно 8 000 акций, торгуемых на биржах США, завтра будет стоить на 300% дороже, чем сегодня. То есть вероятность купить такую акцию, ничего не анализируя, составит 1 к 8000. Для начала я покажу вам, что это за акции, и вы сразу поймете, что данную вероятность можно значительно увеличить.
Цена акции и доходность
Итак, если вы обратите внимание на рисунок, то поймете, что высокую доходность за очень короткий промежуток времени, можно получить только от дешевых акций.
Если акция стоит 1 USD, то для того, чтобы получить доходность в 100%, ей достаточно подняться в цене на 1 USD. Данный рост может спровоцировать любая позитивная новость.
Акция стоимостью в 200 USD не сможет показать такую же доходность за этот же период времени. Поэтому круг поиска можно значительно сузить, ограничив отбор максимальной ценой акции. Таким образом выбираем компании с ценой акции дешевле 5 USD. В итоге их количество уменьшается до 1208 штук.
Далее необходимо определить, в каком из секторов находятся акции, которые чаще всего очень сильно вырастают в цене. Забегая вперед скажу, что это сектор здравоохранения. В итоге круг поиска сужается до 389 акций.
В этом секторе можно выделить отрасль, в которой существует наибольшая вероятность найти интересуемую акцию. В данной ситуации — это биотехнологическая отрасль. В итоге мы получаем 260 акций, из которых необходимо найти тот “Бриллиант”, который принесет очень большую прибыль за короткий промежуток времени.
А теперь давайте разберемся, почему я указал вам на сектор здравоохранения и биотехнологические компании.
Наберитесь терпения, начнем издалека.
Сектор здравоохранения
Сектор здравоохранения включает в себя в том числе компании, которые занимаются разработкой, производством и продажей препаратов, предназначенных для лечения заболеваний. Эти компании делятся на два класса.
Фармацевтические препараты
К фармацевтическим препаратам относятся лекарства, которые состоят из растительных и синтетических химикатов и зачастую выпускаются в виде таблеток. Учитывая простоту производства и достаточно маленькие размеры, компания может производить их сотнями тысяч. Если лекарство приобретает статус «блокбастера», то это означает, что годовая прибыль от его продаж может исчисляться миллиардами.
Но простота производства говорит и о том, что это лекарство может стать легкой мишенью для конкуренции.
И как только истекает защита патента, доходы от продаж данного препарата резко падают, так как на рынке появляются более дешёвые препараты от других производителей. В итоге, если у компании есть только один препарат, то по мере приближения к дате истечения патента, акции начнут снижаться и чаще всего они опускаются до тех уровней, с которых начался их рост. Таким образом в эти компании желательно инвестировать в период действия патентов.
Биологические препараты
Биологические препараты представляют собой молекулы на основе белка, полученного из растительных жиров.
Такие лекарства сопровождаются более длительным и сложным процессом производства. В связи с этим вырастают затраты на производство и сохраняется достаточно высокий барьер входа на этот рынок, что могут позволить себе только крупные компании.
В этом сегменте конкуренция очень слабая, а стоимость данного лекарства иногда превышает 10 000 USD. Для того, чтобы выпустить биоаналог подобного препарата, компании необходимо доказать, что между оригиналом и аналогом нет клинически значимой разницы.
В США за последние 9 лет было одобрено только 9 биоаналогов препаратов, при этом они похожи между собой, но все же не являются точными копиями и соответственно не могут рассматриваться, как взаимозаменяемые. Таким образом в этой сфере крайне низкая конкуренция и очень высокие издержки.
Дополнительный риск на такие компании накладывает и внимание политиков, особенно в период предвыборной компании. Высокая стоимость лекарств, которые жизненно необходимы пациентам, используется политиками в своих целях. Они пытаются понизить стоимость этих лекарств, таким образом добиваясь расположения у своих избирателей.
Одним из примеров является препарат EpiPen от компании Mylan (NYSE: MYL), который используется во время анафилактического шока, вызванного аллергией. В 2016 году стоимость препарата достигла 600 USD и руководителя данной компании вызвали в конгресс для дачи показаний. Причиной оказалась высокая цена EpiPen. Сейчас этот препарат можно купить за 110 USD, а акции компании MYL с 2016 года упали с 70 USD до 19 USD за акцию.
Food and Drug Administration
Изобретение любого из препаратов вовсе не означает, что теперь можно отдыхать и смотреть как растет прибыль. Самым сложным этапом, через который нужно пройти биотехнологической компании, чтобы продать лекарство пациенту, это пройти процедуру одобрения от регулирующего органа Food and Drug Administration (FDA), за которую нужно еще и заплатить приличную сумму.
Food and Drug Administration (FDA) – это управление по санитарному надзору за качеством пищевых продуктов и медикаментов. FDA занимается контролем качества пищевых продуктов, косметических средств, лекарственных препаратов, табачных изделий и других товаров, а также осуществляет контроль за соблюдением законодательства и стандартов в этой области.
Компании, которые желают вывести на рынок какой-нибудь из своих лекарственных препаратов, обязаны пройти все стадии испытаний, установленные FDA.
Момент от начала разработки до выхода препарата на рынок может занять от 5 до 15 лет и стоить более 2 млрд USD (препарат Viagra начали испытывать в 1992 году, а в продажу он поступил только в 1998 году).
Фазы испытаний препаратов
Первая стадия испытаний в FDA подразумевает под собой доклиническое тестирование. То есть перед тем, как испытывать препарат на людях, компания должна протестировать его на животных и доказать, что он безопасен для них. Это первый и самый простой барьер. Как только препарат его преодолевает у компании появляется возможность подать заявку на рассмотрение нового лекарственного средства в FDA. Этот шаг называется Investigational New Drug application (IND) и также означает, что компания готова провести тестирование на людях.
Первая фаза испытаний
Далее наступает первая фаза одобрения. Если в течении 30 дней после подачи IND компания не получает отказ, она может начать испытание препарата на здоровых добровольцах (количество добровольцев может быть от 20 до 80), с целью выявить побочные эффекты.
Данный этап длится от 2 месяцев до нескольких лет и около 70% препаратов проходят эту фазу.
Вторая фаза испытаний
Затем наступает вторая фаза испытаний, в которой уже отбираются реальные пациенты, нуждающиеся в этом препарате. В данной фазе участвует несколько сотен человек и здесь определяется насколько эффективно действует препарат. Эту стадию проходит не более 30% препаратов.
Зачастую новости о прохождении второй фазы испытаний уже воспринимаются инвесторами как сигнал к действию и на этом этапе очень дешевые акции могут подниматься в цене на несколько сотен процентов.
Но так как это еще не окончательное испытание, то эти акции обычно в течение недели возвращаются на прежние уровни.
Третья фаза испытаний
Наступает третья фаза тестирования, в которой уже участвуют тысячи пациентов разного демографического происхождения, и длится она несколько лет.
На этом этапе отсеивается еще 50% препаратов.
Если все же препарат прошел данное испытание, компания может подать заявку на лицензию, разрешающую использование лекарства, а также получить одобрение на маркетинговую кампанию.
Четвертая фаза испытаний
Далее условно одобренный препарат проходит 4 фазу, в которой изучается его долгосрочное влияние на пациентов и выявляются возможные риски. В этой ситуации препарат уже продается пациентам, и в случае возникновения побочных эффектов, которые имеют накопительный эффект, FDA может отозвать лицензию и запретить к продаже данный препарат.
По статистике только 1 из 10 препаратов доходит до финала, поэтому этот вид бизнеса очень трудоемкий и затратный, при этом успеха добиваются немногие.
Если вы обратите внимание на биотехнологический сектор, то из 538 компаний акции 354 торгуются дешевле 10 USD. Из этих 538 компаний лишь у 63 рентабельность выше нуля.
Роль Food and Drug Administration в выборе компании
FDA имеет важную роль в анализе компаний и определении возможного потенциала роста стоимости акций.
На стадии одобрения препарата 95% компаний будут работать в убыток, поэтому анализ финансового состояния ничего не покажет.
А вот информация о поданной заявке IND в FDA, которую можно посмотреть на сайте организации www.fda.gov, должна привлечь ваше внимание, потому что акции таких компаний после одобрения могут очень быстро подняться в цене.
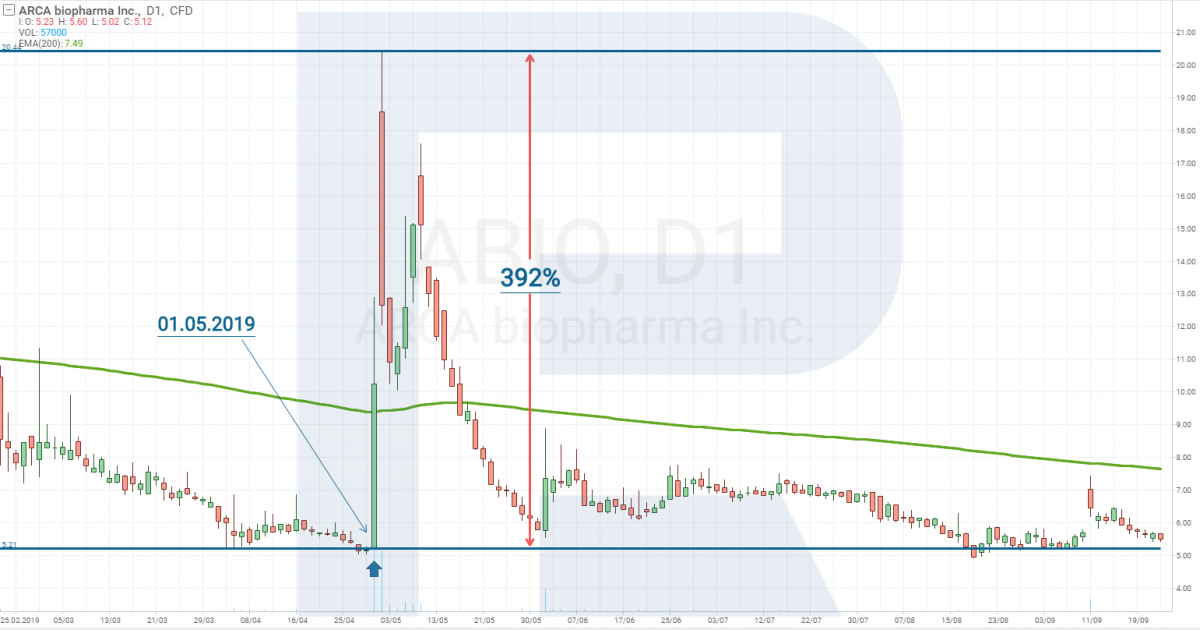
Простой пример: биотехнологическая компания ARCA biopharma, Inc. (NASDAQ: ABIO). 1 Мая 2019 года были опубликованы результаты испытаний 2 фазы препарата Genetic-AF.
На данной новости акции ARCA biopharma за два дня в моменте подорожали на 392%.
Ускоренная процедура одобрения FDA
Для того, чтобы определить насколько высока вероятность получить одобрение препарата от FDA, необходимо обратить внимание на сам препарат. В 1992 году появилась ускоренная процедура одобрения FDA, она относится к препаратам, которые лечат смертельные заболевания и не имеют аналогов в мире. Биотехнологические компании понимают, что, двигаясь в этом направлении, они с большей долей вероятности могут получить одобрение и возможность окупить расходы на разработку, поэтому они все больше берутся за трудноизлечимые болезни.
Именно ускоренная процедура одобрения привела к тому, что на рынке появились препараты для лечения СПИДа и других трудноизлечимых болезней.
Поэтому если в заявке указывается лекарство, аналогов которого в мире нет, и он предназначен для лечения, например, раковых опухолей, то есть очень высокая вероятность, что данный препарат попадет на рынок, а акции компании «взлетят в небеса».
Инвестиции в ETF
Помимо краткосрочной прибыли, акции сектора здравоохранения можно рассматривать и как хороший инструмент для долгосрочных инвестиций, особенно в условиях кризиса.
Люди болеют всегда независимо от того, есть кризис или нет, и они всегда нуждаются в лечении, а значит прибыли фармацевтических компаний, имеющих в продаже хотя бы несколько топовых препаратов, будут расти.
Конечно, все не так просто, как может показаться, ведь в этой ситуации необходимо анализировать и финансовое состояние компании, и сколько препаратов у них находится в продаже, когда истекает срок действия патентов, и многое другое. В данном случае заработать 300% за пару дней кажется гораздо проще, чем выбрать компанию, акции которой будут расти несколько лет.
Но не стоит отчаиваться, можно довериться профессионалам и купить биржевой фонд (ETF). В этой ситуации вы покупаете целый сектор или определенный набор акций и застрахованы от провала некоторых компаний на рынке.
К примеру ETF, торгуемый на бирже NYSE на сектор здравоохранения под тикером XLV, с 2008 года вырос в цене почти на 500%. Аналогично ETF, торгуемый на бирже NASDAQ на биотехнологический сектор под тикером IBB, с 2008 года показал доходность в 650%.
Вывод
Профессия трейдера привлекательна тем, что у вас всегда есть свобода выбора. Только вы решаете акции какой компании приобретать и только от вас зависит какую прибыль вы можете зафиксировать.
Работая с акциями из сектора здравоохранения, вы сами решаете по какому пути вам идти.
В данной статье раскрыта информация о том, какие испытания проходит компания, перед там как их препарат попадет на рынок. Каждая фаза испытаний препарата влияет на стоимость акции, и чем дальше продвинулась компания, тем выше вероятность того, что рост акций продолжится.
Cамой волатильной новостью является вторая фаза испытаний. Обычно после неё акции дорожают в цене на сотни процентов. Однако в последующем их цена резко падает, потому что вторая фаза испытаний не является решающей. В итоге рынок использует данную новость как возможность спекуляций и получения быстрой прибыли.
Однако этот путь очень рискованный, так как в любой момент может произойти непредвиденное событие. Например, выявят побочные эффекты, которые ранее были неизвестны, препарат попадёт под запрет продажи, после чего акции просто рухнут. Поэтому есть и третий вид торговли, консервативный – это инвестирование в ETF.
Инвестируйте в американские акции на выгодных условиях! Реальные акции на платформе R StocksTrader от 0,0045 USD за акцию с минимальной комиссией в размере 0,25 USD. Вы можете попробовать свои навыки торговли в платформе R StocksTrader на демо-счёте или открыть реальный торговый счёт, для этого нужно только зарегистрироваться на сайте RoboForex.com и открыть счёт.
Евгений Савицкий
Работает на валютном рынке с 2004 года. С 2012 года участвует в торговле акциями на американской бирже и публикует аналитические статьи по фондовому рынку. Принимает активное участие в подготовке и проведении обучающих вебинаров RoboForex.
Аппарат одобрен FDA, что это значит?
Что нужно знать про одобрения FDA при покупке медицинского оборудования для косметологии, дерматологии и пластической хирургии?
Одобрения FDA – это то, о чем часто говорят поставщики и производители медицинского оборудования для эстетической медицины, когда хотят выгодно отличиться от конкурентов. Наличие такого одобрения считается очень важным для того, чтобы доказывать эффективность и преимущества косметологического аппарата. Количество таких одобрений – это повод компании лишний раз похвастаться и сравнить себя с конкурентами. В рекламных заявлениях часто можно видеть фразы вроде «одобрено FDA – самым строгим надзорным органом по выдаче разрешений для медицинских аппаратов». Часто продавцы указывают на том, что их аппарат лучше конкурентного аппарата, потому что у него больше одобрений FDA.
Однако, практически никто из покупателей аппаратов, врачей-пользователей этих аппаратов в России, и, тем более, пациентов, не знает, что же значат словосочетание «одобрение FDA» на самом деле. Сразу заметим, что наличие у любого аппарата для эстетической медицины одобрений FDA – это хорошо, однако, наличие и количество таких одобрений не всегда является мерилом преимуществ такого аппарата. Итак, попробуем с этим разобраться.
Чем занимается FDA?
Аббревиатура FDA расшифровывается как «Food and Drug Administration» — это управление по санитарному надзору за качеством пищевых продуктов и медикаментов, оно несет ответственность за охрану здоровья населения США, обеспечивая эффективность и безопасность лекарств, биологических продуктов и медицинских устройств для людей и животных. FDA является подразделением министерства здравоохранения и социальных служб США. Фактически FDA в США – это как Росздравнадзор в министерстве здравоохранения России, то есть FDA выполняет сходные функции – следит, чтобы население страны не страдало от деятельности производителей и продавцов изделий медицинского назначения.
Внутри FDA существует FDA Center for Devices and Radiological Health (CDRH) – подразделение, которое занимается медицинскими девайсами, в том числе лазерами, IPL и RF системами и т.д. К слову сказать, под термином medical device – медицинское изделие в США понимают не только медицинские аппараты, но также любые изделия, которые применяются для лечения человека. Например, к medical device относятся филлеры или грудные импланты.
FDA в лице CDRH занимается выдачей производителям медицинского оборудования тех самых одобрений – разрешений на их коммерческое использование на территории США, а также проверяет производителей, качество и безопасность медицинских изделий. Это относится только к изделиям, которые используются для лечения. Если производитель продает в США какое-то устройство или часть его для того, чтобы из него собирали медицинское изделие, такого одобрения не нужно.
По законам США медицинские изделия (medical devices) делятся на 3 класса : 1 класс – те, которые несут минимальный риск здоровью, 2 класс – те, которые несут средний риск здоровью и должны контролироваться более жестко, 3 класс – те, который несут максимальный риск здоровью, их использование может привести к серьёзному вреду или смерти.
Для того чтобы продавать медицинское изделие в США, производитель должен доказать, что его изделие относится к определенному классу, и, в зависимости от этого, пройти определенную процедуру одобрения. При определении класса изделия, пожалуй, самую главную роль играет показания к его применению. Вернее, для чего применяется изделие в общем (intendend use) и для чего оно применяется конкретно (indications for use). Например, медицинский скальпель в общем применяется для разрезания тканей, а конкретный специфический скальпель может применятся для рассечения роговицы. То есть, для того, чтобы в США продавать такой скальпель и позиционировать его как скальпель для рассечения роговицы – нужно получать разрешение FDA.
Как выглядит «получение одобрения» FDA?
Теперь самое важное. Для медицинских изделий разного класса в США существует различные процедуры одобрения. Для 1 и 2 класса они носят уведомительный характер, когда производитель предоставляет в FDA досье на медицинское изделие и сообщает, что выходит на рынок. Для 3 класса производитель должен обязательно получить Premarket Approval (PMA) – одобрение, которое по смыслу похоже на New Drug Application – одобрение, которое выдает FDA на использование новых лекарственных препаратов. Такое одобрение получить сложнее и дороже всего. Но если для своего медицинского изделия производитель придумал показания к применению, которые относят его к 3 классу, то придется такую процедуру обязательно проходить.
На протяжении многих лет в FDA выстроилась хорошо отработанная схема контроля за рынком медицинских изделий. Для того, чтобы выйти на американский рынок с новым медицинским аппаратом, компании производителю нужно выбрать к какому классу оно относится и найти на рынке аппараты, которые являются эквивалентами – имеют те же показания к применению и сходный принцип действия. Затем производитель должен доказать, что его новый аппарат мало чем отличается от эквивалента. Все это выполняется по регламенту 510(k), который входит в раздел 21 CFR 807 Subpart E Свода Федеральных Кодексов США и определяет объем и структуру документации, которая должна быть представлена производителем FDA. Рассмотрим как выглядит в общих чертах этот регламент.
1 класс – изделия, которые несут минимальный риск для здоровья, например, медицинские перчатки (код KGO). Чтобы получить одобрение FDA для таких изделий необходимо внедрить на его производстве систему качества, соответствующую требованиям FDA (она похожа на ISO 9000, но является отдельной американской системой качества — 21 CFR Part 820), предоставить в FDA техническую документацию и зарегистрироваться в базе данных FDA. После этого можно выходить на рынок, но быть готовым к тому, что FDA может проверить документацию и соответствие системе качестве. Для 95% изделий медицинского назначения, которые относятся к 1 классу, нет необходимости проходить процедуру 510(k).
2 класс – изделия, использование которых может нанести вред здоровью и которые требуют обязательного одобрения FDA через процедуру Premarket Notification 510(k) (предпродажное уведомление). Смысл получения предпродажного уведомления 510(k) состоит в том, что производитель доказывает FDA, что его изделие эквивалентно по своей эффективности и безопасности некому другому изделию, которое уже прошло процедуру одобрения и продается на рынке США. Например, производителю диодного лазера для удаления волос нужно будет доказать, что его лазер эквивалентен какому-то другому лазеру, который уже получил такое одобрение раньше. Помимо этого, нужно будет представить данные всевозможных экспертиз и клинические данные, собрать досье из документов. Смысл документа, выдаваемого FDA через процедуру Premarket Notification 510(k) состоит в том, что FDA рассмотрело заявление производителя о том, что медицинское изделие A эквивалентно уже существующему медицинскому изделию B и FDA согласно с этим. Через процедуру 510(k) одобрения FDA получают практически все производители аппаратов для эстетической медицины и это разумно. Нет смысла проводить каждый раз обширные клинические исследования для определения безопасности какого-то лазера, если они уже проведены для лазера, работающего на такой же длине волны, с сопоставимой мощности и использующегося для тех же показаний.
Формат одобрения через процедуру 510(k) всегда содержит информацию о показаниях к применению аппарата, вернее о том, для чего предназначен аппарат (intendent for use) и код классификации, который говорит о том, в какой области изделие используется. Как уже было сказано, получая одобрение FDA производитель заранее понимает для чего будет использоваться его аппарат, ищет соответствующий эквивалент и доказывает соответствие. Сразу скажем, что получить одобрение 510(k) совсем не просто, необходимы большие средства не только для проведения клинических исследований и экспертиз, но также для сбора и правильного оформления досье, когда одна оплошность может вылиться в отказ от регистрации. Несмотря на то, что процедура 510(k) в большинстве случаев занимает 90 дней, для любого производителя получение такого одобрения США – серьёзное испытание.
Основной документ FDA для медицинских аппаратов – 510(k)
Итак, большинство одобрений FDA, о которых говорят производители медицинского оборудования для косметологии или пластической хирургии – это документы, выданные FDA производителям аппаратов через процедуру 510(k). В этом документе всегда говорится об аппаратах-эквивалентах, всегда говорится о назначении аппарата и показаниях к применению. Чем больше компания-производитель хочет указать показаний к применению, тем большее досье она должна собрать и больше денег потратить на юристов. На рынке США это важно, поскольку показаниями к применению руководствуются страховые компании. Доктор, который лечит какое-то заболевание при помощи определенного аппарата должен использовать в первую очередь аппарат, у которого прописаны эти показания в ответе FDA на premarket notification или доказать, что он использовал этот аппарат, потому что не мог использовать аналоги и у этого аппарата назначение, подходящее для лечения этого заболевания. Для компаний производителей выгодно добавлять показания для своего аппарата, если он будет применятся для лечения этих показаний в системе страховой медицины, но, как уже было сказано выше, прохождение через процедуру 510(k) – это дорогостоящий процесс и он тем дороже, чем больше показаний. В качестве иллюстрации того, как компании получают одобрения в зависимости от бизнес-задач, можно продемонстрировать 2 примера.
Пример 1. В свое время компания Solta Medical добавила в показания для лазера Fraxel re:store DUAL актинический кератоз – заболевание, которое является предвестником рака кожи и которое в США лечат по страховке. Это было сделано для успешного продвижения и продаж Fraxel в клиники, которые занимаются лечением актинического кератоза, а это очень большой рынок для США.
Пример 2 – лазерный модуль ResurFX аппарат M22 (Lumenis), у которого есть следующее общее показание к применению: «ResurFX module and handpiece, with wavelength of 1565 nm, is indicated for: — Use in dermatological procedures requiring fractional skin resurfacing and coagulation of soft tissue» — использование в дерматологических процедурах, требующих фракционного ремоделирования кожи и коагуляции мягких тканей. Это фраза означает, что ResurXF может применятся для любых случаев, когда доктор считает необходимым проведение процедур «фракционного ремоделирования кожи», то есть для морщин, рубцов, постакне, стрий, выравнивания рельефа кожи и т.д. Производитель M22 посчитал избыточным доказывать FDA то, что его фракционный лазер может применятся для конкретных показаний, например, для лечения тонких морщин, для лечения стрий, для лечения рубцов постакне, поскольку это избыточно и очень дорого.
Кстати, говоря о модуле ResurFX аппарата M22 нужно упомянуть, что вне США компания Lumenis везде указывает следующие показания: «The 1565nm ResurFX™ laser is indicated for use in dermatological procedures requiring: Coagulation of soft tissue Skin resurfacing procedures Treatment of striae Treatment of dyschromia, such as but not limited to: Lentigines Melasma Treatment of: Periorbital wrinkles Acne scars Surgical scars. Интересно также, что эквивалентами для ResurFX является уже упомянутый Fraxel, а также лазер Palomar Lux1540.
Из этих примеров видно, что указанные в Premarket Notification 510(k) показания к применению не являются прямым отражением качеств медицинского изделия. Они лишь говорят о том, как компания-производитель хочет продавать свое изделие в США и какие усилия она потратила для входа на американский рынок (время и деньги). У американских производителей и компаний, ориентированных на американский рынок таких “показаний, одобренных FDA” как правило проще, поскольку для американских производителей процедура 510(k) проходит проще. Наконец, существует много компаний, которые и не собираются выходить на рынок США, потому что нем могут, как например, компании, которые попадают под санкции, или не хотят, потому что сфокусированы на своем локальном рынке, у таких компаний нет и не должно быть «одобрений FDA”.
Получение одобрения De Novo
В ряде случаев производитель желает продавать в США медицинское изделие, которое не имеет эквивалентов. Это или изделие с каким-то абсолютно новым принципом воздействия или с абсолютно новыми показаниями. В таком случае классифицировать изделие невозможно и производитель идет в FDA отдельным путем, который называется регистрация De Novo. Это гораздо более длительный и сложный процесс, который требует от прозводителя иного досье, что в процедуре 510(k), но при отсутствии других вариантов регистрация De Novo имеет место быть и на рынке оборудования для эстетической медицины. Так, в свое время одобрение De Novo получил аппарат Zeltiq, поскольку у него не было эквивалентов на американском рынке. При получении такого типа одобрения изделие автоматически причисляется к третьему – самому опасному классу, поскольку про него пока еще мало что понятно и его на всякий случай считают опасным. Поэтому компания должна дополнительно предоставить обширные научные и клинические данные, доказывающие безопасность, для того, чтобы FDA перевело его во второй класс. Компании, получающие одобрение De Novo являются первопроходцами рынка, они снимают сливки с продаж, выходя на рынок первыми, но они же прокладывают дорогу остальным компаниям, поскольку остальным достаточно только доказать эквивалентность первопроходцу.
Одобрение через процедуру Premarket Approval
Мы приближаемся к 3 классу медицинских изделий по версии FDA – это самые потенциально опасные устройства, функционирование которых может нести существенный вред здоровью или может привести к смерти. Например, это кардиостимуляторы. Такие изделия должны получать Premarket Approval (PMA) или предпродажное одобрение при этом процесс его получения напоминает то, как получают одобрение новые лекарства (DNA). Для получения такого одобрения производителю медицинского аппарата нужно предоставить обширные данные исследований, которые собираются годами (доклинические исследования, клинические исследования I, II, III фазы). Сам анализ данных досье, собранного производителем, занимает у FDA уже не 90, как при 510(k), а 180 дней, при этом обязательна инспекция заводов представителями FDA. Считается, что прохождение PMA примерно в 3 раза дороже, чем прохождение Premarket Notification 510(k). Но таким путем вынуждены идти те производители медицинских аппаратов, которые по назначению и показаниям попадают в 3 класс. То есть, если вы хотите продавать в США имплантируемые водители сердечного ритма, то вы не сможете сделать это кроме как получив Premarket Approval.
К счастью, аппараты, которые используются в дерматологии, косметологии и пластической хирургии не попадают в 3 класс по версии FDA. Например, чисто хирургический аппарат VASER, который предназначен для липосакции и липоскульптурирования, относится к классу 2. Интересно, что термин Premarket Approval переводится как предпродажное одобрение, а термин Premarket Notification переводится как предпродажное уведомление, но как раз Premarket Notification по процедуре 510(k) продавцы всех аппаратов в России называют одобрением FDA. Также успешное получение разрешения через процедуру 510(k) часто называют FDA clearance или очисткой FDA.
Почему наличие одобрения FDA – это хорошо?
Практически все крупные производители медицинских изделий мечтают выйти на рынок США, поскольку этот рынок просто огромен и очень привлекателен, несмотря на высокую конкуренцию. Но прохождение процедур в FDA требует денег и времени, а также строгого изначального соответствия производителя многим требованиям. Например, нельзя делать медицинский аппарат у себя в гараже, нужно производство, сертифицированное в соответствии с требованиями FDA. Нельзя получить одобрение FDA по классу 2 не доказав безопасность и эффективность аппарата, не предоставив качественные клинические данные. Наличие у косметологического аппарата одобрения FDA показывает, что он разрешен к продаже на территории США и, следовательно, безопасен и эффективен, это также доказывает, что у производителя этого аппарата есть ресурсы на получение такого одобрения.
Производитель, который провел свое медизделие через процедуру 510(k) несет ответственность за все, что связано с его продукцией. Если данные в досье были ошибочны или подделаны, что привело в конечном итоге к проблемам у пациента, такой производитель рискует не только получить запрет на продажу медизделия, но также будет отвечать перед пациентом.
Когда вы видите надпись «одобрено FDA» на рекламном буклете аппарата — это хорошо, это косвенно доказывает его эффективность и безопасность. Однако, отсутствие такого одобрение не обязательно означает, что аппарат неэффективен и небезопасен, оно лишь означает, что аппарат не продается в США. Всегда проверяйте у продавца наличие одобрения FDA, если оно заявлено. Это простой документ в pdf формате, который доступен на сайте организации и должен быть у продавца. В большинстве случаев эти документы можно найти в секции 510(k).
Показания к применению и показания, одобренные FDA – это разные вещи.
Показания к применению медицинского аппарата – это то, для чего аппарат рекомендуется применять в клинической практике, то, для чего аппарат создал производитель. Показанием к применению может быть указание на лечение конкретного заболевания, которое указано в международном классификаторе болезней (МКБ-10 или IDC-10), которая в том числе используется в России. Например, poikiloderma of Civatte (пойкилодермия Сиватта, код в МКБ L57.3) является показанием к применению универсального IPL модуля M22. Но не всегда показание – это болезнь. Часто косметологические аппараты используются для устранения чисто эстетических проблем, которые не указаны в МКБ-10. Например, в этом классификаторе нет морщин, дряблости кожи, неровной текстуры, расширенных пор и т.д., это просто не считается болезнью на сегодняшний день. Поэтому показаниями к применению аппарата, которые указывает производитель, могут включать в себя как конкретные болезни, так и термины, не относящиеся к болезням, а относящиеся к эстетике. Например, одним из показаний для IPL M22 является удаление нежелательных волос.
Про показания, одобренные FDA было подробно рассказано выше. Они отражают позицию производителя на то, как медицинский аппарат будет продаваться в США. Если в документе FDA — ответе на Premarket Notification производителя написано конкретное показание в виде заболевания – значит врачи в США будут смело предлагать аппарат для лечения этого заболевания, и все, кто хочет, будут рекламировать этот аппарат для лечения все того же конкретного заболевания. Но это не работает в отношении «не заболеваний». То есть, если аппарат одобрен для «фракционного ремоделирования» — врач сам решает, когда ему необходимо выполнять это ремоделирование – при лечении морщин, рубцов, стрий или для восстановления упругости кожи. Плюс, врач в США может предупреждать пациента и договариваться, что он применяет аппарат “off label” вне официальных показаний к применению.
Итак, анализируя возможности аппарата и определяя его показания к применению, стоит обращаться к тем показаниям, которые указывает производитель. Показания к применению всегда перечислены в руководстве пользователя аппарата и они имеют прямое отношение к его коммерческому использованию аппарата и к регистрационному удостоверению. Уточняйте, какие показания перечислены для аппарата в руководстве пользователя, поскольку некоторые производители искусственно расширяют список этих показаний.
Регистрационное удостоверение, выданное Росздравнадзором – главный документ, разрешающий оборот изделий медицинского назначения в России. В этом документе так и написано «разрешено к импорту, продаже и применению на территории Российской Федерации». И, хотя в руководстве пользователя нет показаний к применению и даже назначения аппарата, этот документ всегда опирается на руководство пользователя, которое было предоставлено производителем в Росздравнадзор в составе большого досье, а, значит, это удостоверение опирается и на список показаний к применению.
О количестве показаний, одобренных FDA
Часто продавцы аппаратов для эстетической медицины в России указывают в качестве основного конкурентного преимущества количество одобрений FDA и привлекают своих покупателей яркими лозунгами о количестве этих одобрений. Эти лозунги рассчитаны на российских специалистов, которые не разбираются в том, что такое «одобрения FDA» и только верят, что это хорошо и что чем больше показаний FDA, тем лучше. Но, как мы помним, количество показаний, одобренных FDA говорит только о том, как аппарат планируют продавать в США.
На самом деле, количество показаний FDA сильно зависит не только от того, насколько производитель ориентирован на американский рынок, но также от того, сколько у медицинского аппарата различных модулей, и, следовательно, функций. Например, суперимпульсный лазер Acupulse имеет больше 134 показаний, одобренных FDA, при этом только 34 – это показания для применения в дерматологии и эстетической медицине, а остальные 100 – это показания для применения в различных областях медицины – гинекологии, отоларингологии, неврологии, ортопедии и т.д. Для реализации возможностей Acupulse для разных показаний нужен разный набор аксессуаров – световодов, зеркал, сканеров, адаптеров и т.д. Поэтому, если вы рассматриваете покупку Acupulse для косметологии, дерматологии и пластической хирургии, то вам не важно сколько у этого лазера показаний, одобренных FDA – 34 или 134.
Всегда рассматривайте свойства приобретаемых аппаратов для эстетической медицины в подробностях. Количество показаний, одобренных FDA – это само по себе не преимущество. Узнайте для чего именно одобрен аппарат. Может оказаться, что среди многочисленных одобренных показаний будет много таких, которые вам встретятся в вашей клинической практике в единичных случаях. Если аппарат одобрен FDA для лечения бородавок, а ваше основное направление – процедуры омоложения, то как это одобрение поможет вам?
Если аппарат состоит из модулей, всегда проверяйте, для чего одобрен FDA каждый модуль. В ответе на Premarket Notification всегда перечислены показания к применению для каждого модуля по отдельности, часто в этом документе идет речь даже не об одном аппарате, а о целом семействе аппаратов. Если вам говорят: «посмотрите у нас больше 65 показаний, одобренных FDA, поэтому мы самые крутые!» — спросите продавца, для каких рукояток и манипул какие указаны показания. Проверьте это в оригинальном документе FDA. Скорее всего для реализации всех 65 показаний вам нужно будет купить аппарат в самой полной комплектации и он будет стоить очень дорого, при этом половина показаний вам будет встречаться в вашей практике в редко и это не будет приносить вам большой прибыли.