Что такое аваскулярность опухоли
Чем отличается доброкачественная опухоль от злокачественной
В медицине понятие доброкачественности означает лёгкое течение болезни, хорошие результаты лечения и неопасность для жизни. Под злокачественным процессом подразумевают разрушительное течение, сложность терапии, высокий риск смертности.
Для опухолей такое разделение условно. Тем не менее пациентам и врачам крайне важно определить вид опухоли. От этого зависят тактика лечения и прогноз.
Характеристика доброкачественных и злокачественных опухолей
Существуют чёткие критерии:
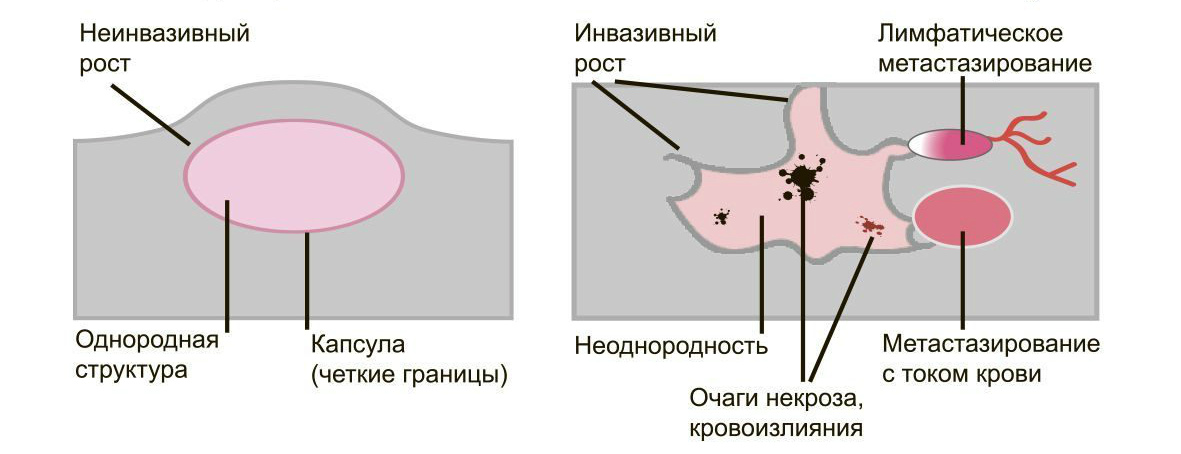
Доброкачественные опухоли чётко отграничены от здоровых тканей, часто имеют капсулу. Рак прорастает окружающие ткани, внедряется в сосуды, его контуры более аморфны.
Большинство доброкачественных опухолей могут расти годами, не проявляя симптомов. Карциномы растут быстро, нарушая функции органов и отравляя организм. Рост сопровождается утомляемостью, слабостью, потерей веса, болью.
Доброкачественные образования “сидят” на одном месте, постепенно растут и раздвигают здоровые ткани, подвижны при прощупывании. Раковые клетки слабо скреплены друг с другом, легко отделяются и разносятся лимфой и кровью по организму. Они оседают в лимфоузлах, костях, внутренних органах, образуя новые опухолевые очаги — метастазы. При пальпации узел спаян с тканями и не сдвигается.
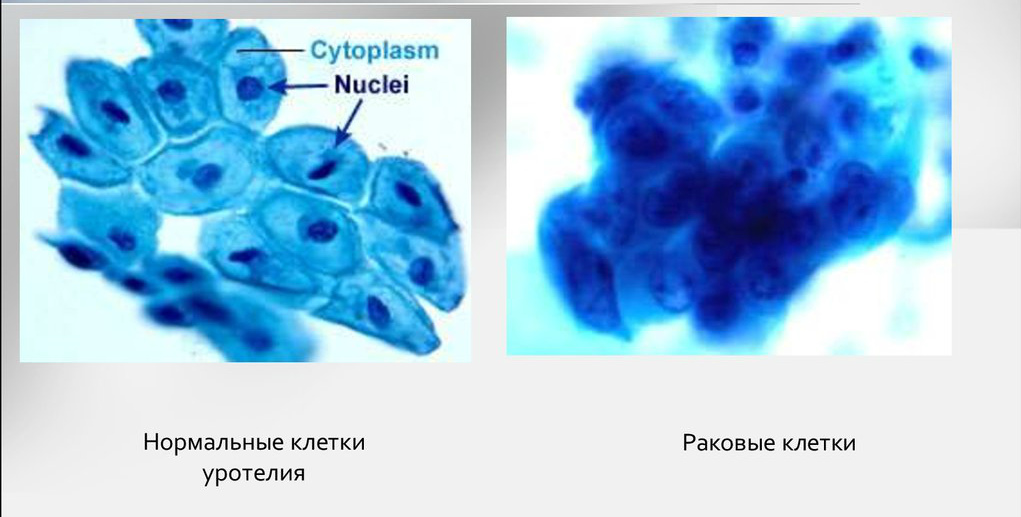
Много информации даёт биопсия. Исследование показывает, что доброкачественные клетки похожи на здоровые, их структура более чёткая. Структура злокачественных клеток сильно изменена из-за выраженных мутаций. Чем меньше клетки напоминают ткань, из которой выросли, тем хуже прогноз для лечения и жизни.
Доброкачественную опухоль, такую как аденома простаты, можно удалить и добиться полного излечения. Если возникнет рецидив, он будет на том же месте, где нашли первичный очаг. Злокачественные образования трудно удалить полностью. Даже одна оставшаяся клетка даст новую опухоль либо на старом месте, либо там, куда она попала по сосудам. Выживаемость больных существенно ниже.
Общие свойства доброкачественных и злокачественных опухолей
Есть моменты, объединяющие оба вида новообразований:
Тяжесть симптомов зависит не только от степени сдавления тканей опухолью, но и от неспособности новообразования выполнять функцию здоровых клеток.
Виды опухолей
Различия не всегда очевидны. Нужна тщательная диагностика для поиска атипичных клеток.
Может ли доброкачественная опухоль стать злокачественной
Любая опухоль способна к малигнизации. Миомы, липомы, фибромы редко переходят в рак. Кисты — крайне редко. Невусы, аденомы, полипы в желудке или кишечнике — очень часто. Многое зависит от условий, в которых находится опухоль, питания, экологии, уровня стресса, гормональных сбоев, наличия предраковых болезней.
В Клинике урологии имени Р. М. Фронштейна доступна современная диагностика опухолей, разработаны эффективные методики лечения. Обращайтесь на консультацию и наши специалисты вам помогут.
Что такое аваскулярность опухоли
хирург-онколог, маммолог, кандидат медицинских наук
Ленинградская область, Всеволожский район, пос.Кузьмоловский, Заозерная ул., 2
Врач в третьем поколении. Закончил в 1998 году с отличием Санкт-Петербургскую государственную медицинскую академию им. И.И. Мечникова, после чего сразу же поступил в клиническую ординатуру по хирургии этой же академии. Во время обучения в клинической ординатуре, которую с отличием закончил в 2000 году, получил специализацию по онкологии (1999). Начиная с 1999 года, обучение проводилось на базе Ленинградского областного онкологического диспансера (отделение общей онкологии). С 2000 по 2004 год проходил обучение в аспирантуре и в 2004 году защитил кандидатскую диссертацию на тему «Хирургическое и адъювантное лечение ранних форм рака молочной железы». Имею действительные сертификаты по хирургии (2021) и онкологии (2018), реконструктивной и пластической хирургии (2019). Являюсь лучшим маммологом Санкт-Петербурга 2016 года по версии сайта НаПоправку, лучшим маммологом Санкт-Петербурга в 2020 и 2021 годах по версии Prodoctorov.Ru
Лечу рак молочной железы по федеральным квотам в Клинической больнице Российской академии наук, принимаю и лечу пациентов в клинике онкологических решений ЛУЧ
С 2004 года являюсь главным исследователем и координатором международных клинических исследований по раку молочной железы в Ленинградском областном клиническом онкологическом диспансере, клинике онкологических решений ЛУЧ.
Имею более 10 печатных работ, в том числе в центральной зарубежной печати.
Рабочий телефон +7921 945 33 18
Мобильный телефон +7 921 945 33 18
Телефон администратора +7 981 710 40 41
Анэхогенное аваскулярное образование в яичнике: что делать?
Содержание
Образования в яичниках у женщин сегодня не редкость. Они имеют разное происхождение, характер, некоторые требуют срочного лечения, в том числе и оперативного, а отдельные – пропадают так же резко, как и появляются. Стоит ли беспокоится при диагнозе «анэхогенное аваскулярное образование в яичнике», рассмотрим далее.
Особенности новообразования в яичнике
Давайте сначала разберем этимологию самого определения «анэхогенное аваскулярное образование в яичнике». Анэхогенным называют образование, не дающее возможности отразить звук. То есть получается, что исследуемое включение содержит материал, не отражающий звук. Такие характеристики свойственны для жидкостей.
Аваскулярным образованием в яичнике называют образование, которое не кровоснабжается. Из такой характеристики получается, что речь идет о функциональной кисте. Что делать в таком случае, попробуем разобраться.
Что такое функциональная киста
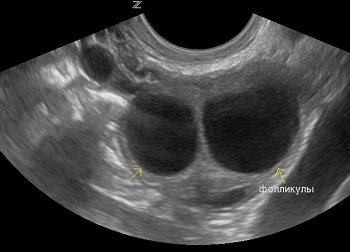
Функциональные кисты могут быть нескольких видов:
Чаще всего такое анэхогенное аваскулярное образование в яичнике не имеет ярко выраженной симптоматики и случайно обнаруживается при плановом УЗИ репродуктивной системы. Редко женщину может беспокоить нерегулярность менструаций.
Опасна ли фолликулярная киста?
Фолликулярная разновидность кисты имеет вид однокамерного образования, может достигать в диаметре до 10 см. Как правило, это одиночное анэхогенное аваскулярное образование с тонкой капсулой и жидким содержимым однородной консистенции. Они имеют характерную особенность возникать без определенных причин и так же неожиданно через некоторое время самостоятельно рассасываться. Но если такое образование диагностировано, лучше проводить регулярный контроль его изменений посредством УЗИ-мониторинга.
Киста желтого тела: что это?
Лечим или удаляем?
Окончательное заключение относительно характера образования и метода его лечения может дать только гинеколог после тщательной диагностики и анализов. Если киста не несет дискомфорта, оперативное вмешательство не обязательно. Но при угрозе ее инфицирования, стремительно быстром увеличении ее в размерах, появлении риска ее озлокачествления, операция является неизбежной.
Следует уяснить, что далеко не каждая киста исчезает самостоятельно, большинство из них требуют лечения, иногда и хирургического. Иначе образование может вырастать до огромных размеров и мешать функционировать соседним органам. Кроме того, некоторые кисты по виду похожи на гриб на ножке, на которой в определенных условиях они способны перекручиваться. Последствия такого процесса могут быть плачевными и даже летальными, если вовремя не обратиться к врачу.
Цветовое допплеровское картирование в исследовании новообразований молочных желез
Журнал «SonoAce Ultrasound»
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Компьютерная томография не оправдала возлагаемых на нее надежд, и принципиальную помощь оказывает в оценке распространенности неопластического процесса на грудную стенку и метастатического поражения зон регионарного лимфооттока.
Бесконтрастная ядерно-магнитно-резонансная томография не показала преимуществ перед рентгеновской маммографией, что, по-видимому, обусловлено невизуализацией микрокальцинатов первым методом, а также отсутствием существенных различий по времени релаксации между доброкачественными и злокачественными опухолями. Очень обнадеживают результаты исследования молочных желез с использованием контрастных препаратов, однако высокая цена исследования вносит известные ограничения для широкого использования.
В наибольшей степени как дополнительный к рентгеновской маммографии оптимален метод, основанный на использовании ультразвуковой волны. Благодаря экономической рентабельности и очень низкому риску вредного воздействия на человека, ультразвуковое исследование заняло прочное положение в арсенале диагностических методов.
Для злокачественных опухолей характерно появление большого числа новообразованных сосудов [3], которые можно рассматривать как маркер агрессивности опухоли. Исследованию васкуляризации новообразований молочной железы и посвящена эта работа.
Материалы и методы
Нами было проведено ультразвуковое исследование молочных желез 78 женщинам в возрасте от 15 до 89 лет (средний возраст составил 49,7 лет) как традиционное в режиме серой шкалы, так и с применением цветового допплеровского картирования с применением широкополосного датчика 7,5-12 МГц. Документация проводилась на термобумаге Sony и видеокассетах SVHS.
Абсолютно все наблюдения верифицированы гистологически. Удалено 96 новообразований, из них 68 злокачественных опухолей и 28 доброкачественных образований. Структура удаленных доброкачественных образований:
Из всех удаленных образований 76 пальпировались, 20 были выявлены благодаря профилактической маммографии.
Результаты
При доброкачественных процессах васкуляризация наблюдалась в 10 случаях (34,8% всех доброкачественных новообразований), из них имели артериальное кровоснабжение 7 фиброаденом, 1 внутрипротоковая папиллома, 1 участок склерозирующего аденоза, 1 участок фиброзно-кистозной мастопатии, содержащий мелкие множественные кисты с густым содержимым. Варианты кровоснабжения фиброаденом: от 2 до 4 огибающих образование сосудов в 6 наблюдениях с максимальной скоростью кровотока (V max) от 3,3 см/сек до 11,0 см/сек (среднее значение = 7,3 см/сек). Минимальная скорость кровотока (V min) в артериях фиброаденом составила от 0,6 см/сек до 3,1 см/сек (среднее значение = 2,28 см/сек) (рис. 1).
Рис. 1. Типичный огибающий кровоток фиброаденомы.
В 1 наблюдении интраканаликулярной фиброаденомы (рис. 2) в центре доброкачественного новообразования определялся 1 питающий артериальный сосуд (Vmax = 7,6 см/сек, V min = 0,6 см/сек, RI = 0,92).
Рис. 2. Питающий сосуд входит в центр интраканаликулярной фиброаденомы.
В другом случае доброкачественного поражения (склерозирующего аденоза) размером до 1,2 см ультразвуковая картина в режиме серой шкалы была подозрительна на рак: образование сниженной неоднородной эхогенности, неправильной формы с неровными нечеткими контурами, к которому подходила 1 питающая артерия с V max = 10,5 см/сек, Vmin = 1,6 см/сек, RI = 0,85 (рис. 3).
Рис. 3. Склерозирующий аденоз.
Аваскулярными были все кисты, 5 фиброаденом, фибролипома, абсцесс, цистаденопапиллома.
Из 68 удаленных злокачественных опухолей 21 была аваскулярна (30,88% всех злокачественных поражений). У 47 раковых опухолей лоцировался артериальный кровоток (69,ПУо всех злокачественных опухолей). Количество сосудов составило от 1 до 11 (среднее количество составляло 4,29). Ни разу не встретился огибающий образование, повторяющий его контуры, кровоток, как у фиброаденом. Мы наблюдали артериальные сосуды, питающие опухоль, которые подходили к ней под прямым или косым углом. Количество питающих опухоль сосудов колебалось от 1 до 7 (среднее значение = 2,6). В центре опухоли нам встретились от 1 до 9 сосудов (резко извитых, мелких, беспорядочно расположенных) (среднее значение = 3,06) (рис. 4 а-в).
Рис. 4. Варианты кровотока (а-в) в инфильтрирующих карциномах.
Количественные показатели артериального кровотока в злокачественной опухоли выглядели следующим образом: Vmax = 4,6-56,6 см/сек (среднее значение = 18,98 см/сек), Vmin = 0,3-9,8 см/сек (среднее значение = 2,99 см/сек), RI =0,56-1,34 (среднее значение = 0,82 ).
Обсуждение
Из представленных данных видно, что цветовое допплеровское картирование в дифференциальной диагностике новообразований молочной железы со 100%-ной уверенностью помогло в случае простых кист, которые были аваскулярны. 5 фиброаденом были аваскулярны, 6 имели сосуды, огибающие доброкачественное образование, с довольно низкой скоростью кровотока (до 11,0 см/сек). Однако 1 фиброаденома вызывала сомнения в своей доброкачественности только в связи с нетипичным кровотоком: в центр ее входил артериальный сосуд, хотя и с низкой скоростью потока (7,6 см/сек), но с высоким RI=0,91. При склерозирующем аденозе (1 наблюдение) оценка кровотока не помогла в сложной диагностике как пальпаторной, так и маммографической и в режиме серой шкалы, по данным которых были высказаны подозрения на рак молочной железы, так как существовал 1 питающий сосуд, хотя и с низкой скоростью кровотока (V mах=10,5 см/сек), но высоким RI=0,85. Аваскулярность солидных образований давала надежду на доброкачественную природу процесса. Но как выяснилось в ходе дальнейшей работы, до 30,9% раковых опухолей также были аваскулярными. Наоборот, большое количество подходящих питающих сосудов, наличие множественных сосудов в центре новообразования, их характер (резкая извитость, беспорядочность расположения, иногда в виде «сеточки») с большой долей вероятности свидетельствует о раке молочной железы. Для раковых опухолей была также характерна высокая скорость кровотока по сравнению с доброкачественными образованиями [4]. Таким образом, чем больше количество сосудов в опухоли, чем выше скорость потока крови и больше индекс резистентности, тем выше вероятность рака молочной железы.
Отсутствие новообразованных сосудов в солидном образовании, в особенности при высокой степени подозреваемости на рак, не позволяет исключить злокачественность, так как почти 31% случаев рака в нашем исследовании были аваскулярными. Нам хочется надеяться, что применение цветового допплеровского картирования, а также контрастной эхографии, окажут помощь в мониторинге больных раком молочной железы, подвергающихся на первом этапе лечения лучевой и (или) химиотерапии.
Литература
Журнал «SonoAce Ultrasound»
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Ультразвуковая оценка васкуляризации узловых образований щитовидной железы
ФГБУ «Федеральный медицинский биофизический центр им. А.И. Бурназяна» ФМБА России
E-mail:
РЕФЕРАТ: В статье проанализирован опыт комплексного ультразвукового исследования объемных образований щитовидной железы у 249 пациентов, подвергшихся оперативному вмешательству.
По распространенности в популяции узловые образования доминируют в структуре тиреоидной патологии, особенно в эндемичных районах, составляя 40-50% всех заболеваний щитовидной железы. Клиническая значимость узловой патологии щитовидной железы определяется высокой распространенностью рака щитовидной железы, который встречается в 5-10% выявленных узлов 3.
Среди методов лучевой диагностики ведущие позиции занимает ультразвуковое исследование, достоинства которого – простота, неинвазивность, доступность, относительно низкие экономические затраты – сочетаются с высокой информативностью. В большинстве случаев ультразвуковое исследование, дополненное тонкоигольной аспирационной биопсией патологических очагов, является основным методом диагностики узловых образований щитовидной железы 6. Совершенствование ультразвуковых технологий и внедрение в практику методик допплеровского картирования позволили выполнять ультразвуковую ангиографию щитовидной железы, качественно и количественно оценивать особенности ее васкуляризации [7, 10-14]. Вместе с тем, данные литературы относительно взаимосвязи выраженности васкуляризации узла и его злокачественности по-прежнему весьма разнообразны.
Материалы и методы
Диагностические возможности ультразвукового исследования (УЗИ) в выявлении и дифференциальной диагностике узловой патологии щитовидной железы (ЩЖ) проанализированы на основании обследования 249 больных. Результаты УЗИ сопоставлены с интраоперационными данными и верифицированы результатами гистологического исследования удаленной ЩЖ.
Всем пациентам было проведено традиционное клиническое и лабораторное обследование, а также инструментальная диагностика.
Комплексное ультразвуковое исследование щитовидной железы выполнялось по общепринятой методике на ультразвуковых диагностических аппаратах HDI 5000 (ATL, США), Acuson «Sequoia» – 512 (Siemens, Германия), Vivid-7 (GE, США), Voluson-730 Pro (GE, США), мультичастотными датчиками 5-12 МГц с использованием различных режимов сканирования.
В процессе исследования при полипозиционном сканировании в В-режиме оценивались положение, форма, контуры железы, ее эхогенность и эхо-структура, наличие дополнительных образований и локальных участков ткани железы с нарушенной акустической структурой, анатомо-топографические соотношения железы с соседними органами.
При наличии дополнительных образований (узлов) оценивали их количество, локализацию, контуры, эхогенность и эхо-структуру, распространение за капсулу ЩЖ. Всем без исключения больным в обязательном порядке по общепринятой методике осматривались зоны регионарного лимфооттока.
Качественный анализ кровотока в паренхиме железы и узловых образованиях проводили с использованием режимов цветового допплеровского кодирования (ЦДК) и энергетического допплера (ЭД). Для оптимизации цветового изображения использовали индивидуальные настройки параметров аппаратуры: мощность сигнала, частота повторения импульсов, фильтры. Однако сравнительную оценку васкуляризации паренхимы и узловых образований у одного и того же пациента в динамике или у различных пациентов проводили при стандартных настройках ультразвуковых приборов в программах «Thyroid». Качественный анализ кровоснабжения паренхимы щитовидной железы проводили в режиме ЦДК и ЭД, выделяя различную выраженность васкуляризации паренхимы (скудную, обычную, повышенную).
Ангиоархитектонику узловых образований определяли согласно градациям, используемым отечественными и зарубежными авторами [3, 106, 152, 198], и дифференцировали узловые образования с 4 типами сосудистого рисунка.
При изучении интенсивности кровоснабжения, как и в ряде исследований [8, 13, 15], выделяли узлы с интранодулярной гиперваскуляризацией (при наличии выраженной внутриузловой сосудистой сети) и интранодулярной гиповаскуляризацией (с наличием единичных сосудов внутри узла).
При оценке внутриузловой ангиоархитектоники отмечали такие качественные характеристики, как ход сосуда, протяженность, характер сосудистого рисунка, равномерность диаметра сосудов, внутриузловую «насыщенность» сосудами и т.д.
В ряде случаев исследование ангиоархитектоники узловых образований щитовидной железы дополняли трехмерной реконструкцией сосудистого рисунка в режиме энергетического допплера (3D-ангио).
Сравнение выборок, не подчиняющихся нормальному распределению, проводили с использованием методов непараметрической статистики. Такие данные в тексте, таблицах и рисунках представляли в виде Ме (медианы), минимальных и максимальных значений. При сопоставлении двух независимых выборок пользовались критерием Манна-Уитни (T). Для сравнения относительных показателей при анализе качественных переменных использовались критерии z и критерий χ 2 (хи-квадрат) с поправкой Йетса на непрерывность. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Используя принцип решающей матрицы, оценивали показатели диагностических тестов (истинно отрицательные результаты (ИО), истинно положительные результаты (ИП), ложно отрицательные результаты (ЛО), ложно положительные результаты (ЛП)) и информативность данных признаков (чувствительность, специфичность, точность, прогностическая ценность положительного результата, прогностическая ценность отрицательного результата). Указанные статистические показатели рассчитывали по формулам:
Результаты исследования и обсуждение результатов
Среди 249 оперированных пациентов у 49 человек (19,7%) установлен рак ЩЖ, который в 3 случаях сочетался с аденомой, у 41 (16,5%) – аденомы ЩЖ, у 151 (60,6%) – узловой коллоидный пролиферирующий зоб, в том числе в 16 случаях рецидивный, и у 5 (2,0%) – узловая форма аутоиммунного тиреоидита (АИТ). В 1 наблюдении (0,4%) пациенту удалена невринома шеи, в 1 (0,4%) случае – аденома паращитовидной железы и еще у 1 пациентки (0,4%) – аберрантная ЩЖ. В 24,5% наблюдений узловая патология ЩЖ сочеталась с диффузным или диффузно-узловым аутоиммунным тиреоидитом.
Результаты наших исследований, свидетельствующие о наличии узловых образований в ЩЖ, совпали с интраоперационными и морфологическими данными у 239 больных. В 157 (65,7%) наблюдениях обнаружено многоузловое поражение ЩЖ, с наличием от 2 до 9 узлов в каждой доле, и в 82 (34,3%) – одиночные узлы ЩЖ. Пятеро пациентов оперированы по поводу диффузно-узловой формы АИТ, ни при УЗИ, ни на операции других узловых образований у них выявлено не было. Результативность УЗИ в выявлении узловых образований ЩЖ составила: чувствительность – 98,8%, специфичность – 87,5%, точность – 98,4%, прогностическая ценность положительного результата – 99,6%, прогностическая ценность отрицательного результата – 70,0%.
В 5 наблюдениях (2,0%) результаты УЗИ были ошибочны: в одном случае за крупный узел нижнего полюса правой доли ЩЖ принята невринома надключичной области (рис. 1), в другом за гиперплазированные паратрахеальные лимфоузлы – аденома паращитовидной железы (рис. 2). У 3 оперированных больных не распознаны узлы ЩЖ, сформировавшиеся на фоне диффузного зоба или АИТ.
Рисунок 1. Эхограмма невриномы (двусторонняя стрелка) шеи.
Сканирование в режиме ЦДК.
Рисунок 2. Аденома паращитовидной железы (стрелки).
В общей сложности у 239 пациентов проанализированы и сопоставлены с результатами гистологического исследования эхографические характеристики 528 узловых образований ЩЖ. При этом изучались серошкальное изображение узлов и их ангиоархитектоника в режимах ЦДК и ЭД, а при необходимости – в режиме трехмерной реконструкции сосудистого рисунка (3D-ангио). Из 528 узлов 56 (10,6%) соответствовали различным формам рака ЩЖ, 45 (8,5%) – доброкачественным опухолям (фолликулярным аденомам) ЩЖ и остальные 427 (80,9%) – узловому в разной степени пролиферирующему зобу. Результаты сопоставления ультразвукового изображения узловых образований с их морфологическим строением и статистическая значимость полученных данных представлены в таблицах 1-3.
Таблица 1. Размеры узловых образований щитовидной железы
различной морфологической структуры
| Размеры узлов | Морфологическое строение узлов | |||||||
|---|---|---|---|---|---|---|---|---|
| Рак | Аденома | Коллоидные узлы | Итого | |||||
| Кол-во | % | Кол-во | % | Кол-во | % | Кол-во | % | |
| До 10 мм | 16 | 28,6 | 5 | 11,1 | 195 | 45,6 | 216 | 40,9 |
| 11-20 мм | 17 | 30,4 | 15 | 33,3 | 102 | 23,9 | 134 | 25,4 |
| 21-30 мм | 13 | 23,2 | 16 | 35,6 | 66 | 15,5 | 95 | 18,0 |
| 31-40 мм | 5 | 8,9 | 5 | 11,1 | 32 | 7,5 | 42 | 8,0 |
| > 40 мм | 5 | 8,9 | 4 | 14,9 | 32 | 7,5 | 41 | 7,8 |
| Всего | 56 | 100,0 | 45 | 100,0 | 427 | 100,0 | 528 | 100,0 |
Таблица 2. Локализация узловых образований щитовидной железы
различной морфологической структуры
| Размеры узлов | Морфологическое строение узлов | |||||||
|---|---|---|---|---|---|---|---|---|
| Рак | Аденома | Коллоидные узлы | Итого | |||||
| Кол-во | % | Кол-во | % | Кол-во | % | Кол-во | % | |
| Верхний полюс | 14 | 25,0 | 2 | 4,4 | 104 | 24,4 | 120 | 22,3 |
| Средняя треть | 24 | 42,9 | 20 | 44,4 | 141 | 33,0 | 185 | 35,0 |
| Нижний полюс | 10 | 17,9 | 20 | 44,4 | 147 | 34,4 | 177 | 34,0 |
| Перешеек | 8 | 14,3 | 3 | 6,8 | 35 | 8,2 | 46 | 8,7 |
| Всего | 56 | 100,0 | 45 | 100,0 | 427 | 100,0 | 528 | 100,0 |
В структуре опухолевых заболеваний ЩЖ обращает внимание присутствие мелких очагов, размерами менее 10 мм (до 28,6% среди раков и до 11,1 % среди аденом) (табл. 1). Это затрудняло их дифференциацию при полинодозном поражении ЩЖ и обнаружение среди мелких пролиферирующих коллоидных узелков и инциденталом. До 17,8% раковых узлов были представлены крупными очаговыми образованиями, размерами более 30 мм в диаметре, что также было характерно и для узлового пролиферирующего зоба. Зависимости частоты встречаемости рака от размеров узла нами не выявлено (χ 2 =3,70, р=0,448).
Малигнизированные узлы чаще локализировались в средней трети доли, тогда как аденомы преимущественно располагались как в нижнем полюсе, так и в средней трети доли (табл. 2). Эхографические характеристики узловых образований различной морфологической структуры отличались большим разнообразием ультразвуковых признаков, что также затрудняло диагностику злокачественной патологии с помощью УЗИ (табл. 3).
Таблица 3. Ультразвуковые признаки узловых образований щитовидной железы
в сопоставлении с результатами морфологического исследования
| Признаки | Морфологическое строение узлов | Статистическая значимость | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Рак | Аденома | Узловой кол. зоб | |||||||
| Кол-во узлов | % | Кол-во узлов | % | Кол-во узлов | % | χ 2 | р | ||
| Эхогенность | Гипоэхогенность | 40 | 71,4 | 18 | 40,0 | 164 | 38,4 | 7,711 | 0,021 |
| Изоэхогенность | 13 | 23,2 | 19 | 42,2 | 172 | 40,3 | 3,116 | 0,211 | |
| Гиперэхогенность | 2 | 3,6 | 2 | 4,4 | 33 | 7,7 | 1,069 | 0,447 | |
| Смешанная | 1 | 1,8 | 6 | 13,3 | 58 | 13,6 | 5,479 | 0,065 | |
| Итого: | 56 | 100 | 45 | 100 | 427 | 100 | |||
| Границы | Ровные | 24 | 42,9 | 42 | 93,3 | 366 | 85,7 | 8,077 | 0,018 |
| Неровные | 32 | 57,1 | 3 | 6,7 | 61 | 14,3 | 35,948 | 0,0001 | |
| Итого: | 56 | 100 | 45 | 100 | 427 | 100 | |||
| Контур | Четкий | 24 | 42,9 | 43 | 95,6 | 394 | 92,3 | 9,677 | 0,008 |
| Нечеткий | 32 | 57,1 | 2 | 4,4 | 33 | 7,7 | 63,644 | 0,0001 | |
| Итого: | 56 | 42,9 | 45 | 100 | 427 | 100 | |||
| Ободок | Ободок Halo | 6 | 10,7 | 14 | 31,1 | 45 | 10,5 | 10,944 | 0,004 |
| Нет | 50 | 89,3 | 31 | 68,9 | 382 | 89,5 | 1,163 | 0,559 | |
| Итого: | 56 | 100 | 45 | 100 | 427 | 100 | |||
| Структура | Однородная | 14 | 25,0 | 10 | 22,2 | 153 | 35,8 | 2,873 | 0,238 |
| Неоднородная | 42 | 75,0 | 35 | 77,8 | 284 | 66,5 | 18,376 | 0,0001 | |
| Итого: | 56 | 100 | 45 | 100 | 427 | 102,3 | |||
| Кальцинаты | Кальцинаты | 23 | 41,1 | 14 | 31,1 | 27 | 6,3 | 48,497 | 0,0001 |
| Нет | 33 | 58,9 | 31 | 68,9 | 400 | 93,7 | 5,297 | 0,071 | |
| Итого: | 56 | 100 | 45 | 100 | 427 | 100 | |||
| Жидкость | Жидкостные участки | 12 | 21,4 | 9 | 20,0 | 123 | 28,8 | 1,59 | 0,451 |
| Нет | 44 | 78,6 | 36 | 80,0 | 304 | 71,2 | 0,41 | 0,815 | |
| Итого: | 56 | 100 | 45 | 100 | 427 | 100 | |||
| Капсула ЩЖ | Нарушение капсулы ЩЖ | 7 | 12,5 | 0 | 0,0 | 0 | 0,0 | 53,14 | 0,0001 |
| Нет | 49 | 87,5 | 45 | 100 | 427 | 100 | 0,21 | 0,9 | |
| Итого: | 56 | 100 | 45 | 100 | 427 | 100 | |||
| I | 2 | 3,6 | 0 | 0,0 | 22 | 7,5 | 4,124 | 0,125 | |
| II | 3 | 5,4 | 2 | 4,4 | 76 | 25,8 | 14,533 | 0,0001 | |
| III с внутриузловой гиперваскуляри-зацией | 12 | 21,4 | 21 | 46,7 | 77 | 26,1 | 4,847 | 0,089 | |
| III с внутриузловой гиповаскуляри-зацией | 32 | 57,1 | 19 | 42,2 | 108 | 36,6 | 3,271 | 0,195 | |
| IV | 7 | 12,5 | 3 | 6,7 | 12 | 4,1 | 5,544 | 0,063 | |
| Итого: | 56 | 100 | 45 | 100 | 295 | 100 | |||
В процессе ультразвукового обследования пациентов с узловыми образованиями ЩЖ решали несколько диагностических задач, которые определяли дальнейшую хирургическую тактику, в том числе выбор объема операции. Главная из них – определение морфологической структуры обнаруженных очагов тиреоидной паренхимы. При обнаружении злокачественной патологии не менее важно было оценить стадийность заболевания, то есть распространение процесса за пределы ЩЖ. И наконец, в-третьих – выявление всех узловых образований в тиреоидной паренхиме, определение их размеров, пространственного расположения, дифференциация участков неизмененной паренхимы, подлежащих сохранению.
При обнаружении узловых образований в тиреоидной паренхиме в первую очередь дифференцировали их злокачественную или доброкачественную природу.
Ретроспективный анализ показал, что в наших наблюдениях рак ЩЖ чаще встречался при множественном узловом поражении ЩЖ (в 62,5% случаев) и присутствовал в одном или нескольких узлах при многоузловом зобе. Одиночные раковые узлы выявлены в 21 случае (37,5%). Вместе с тем частота встречаемости рака ЩЖ в общей структуре моно- и полинодозного поражения ЩЖ практически не различалась и составляла соответственно 28,6%, и 19,9% (различия статистически не значимы, критерий χ 2 =0,912, р=0,340).
Одновременно несколько раковых очагов в одной или обеих долях гистологически верифицированы у 7 (14,3%) пациентов (у 2 в одной доле и у 5 в обеих долях (рис. 3)), причем в 2 случаях в виде микрофокусов до 3-5 мм в диаметре. В этих 2 наблюдениях (4,1% больных) микрофокусы злокачественных новообразований были предположены при УЗИ и определялись в виде гипоэхогенных участков неправильной формы с неровными контурами, размерами 4-5 мм в диаметре, расположенных в непосредственной близости с «основным» раковым узлом (рис. 4). В остальных 5 наблюдениях дополнительные злокачественные новообразования в тиреоидной паренхиме при УЗИ найдены не были.
Рисунок 3. Узлы папиллярного рака (белые стрелки) в правой доле и левой доле ЩЖ.
Рисунок 4. Узел папиллярного рака (двусторонняя стрелка)
и микрофокус рака (белая стрелка и пунктирные маркеры).
По морфологическому строению преобладали высокодифференцированные раки: 58,9% узлов соответствовали папиллярной карциноме, 26,8% – фолликулярной карциноме. Солидный (папиллярный и фолликулярный) рак встретился в 7,1% узлов, медуллярный – в 5,4% и недифференцированный – в единичном наблюдении (1,8%). В 10 наблюдениях (20,4%, 10/49) раку ЩЖ сопутствовал аутоиммунный тиреоидит с выраженными диффузно-псевдоузловыми изменениями паренхимы ЩЖ, а у 3 (6,1%, 3/49) больных рак ЩЖ сочетался с фолликулярными аденомами.
Стадия Т1-2 верифицирована у 33 (67,3%) больных, Т3 – у 7 (14,3%), Т4 – у 9 (18,4%). Лимфогенное метастазирование на стороне поражения обнаружено у 10,2% пациентов. Отдаленные метастазы в кости скелета были выявлены у одного больного (2,0%).
Раковые узлы несколько чаще локализовались в средней трети долей (42,9% узлов), реже в верхнем полюсе (25,0%), в нижней трети (17,9%) и в перешейке (14,2%) (критерий χ 2 =8,220, р=0,0540). И, как уже отмечалось, практически 1/3 узлов (28,6%) составили очаги менее 10 мм в диаметре (табл. 1, 2).
По сравнению с доброкачественными образованиями для раковых узлов были характерны следующие эхографические признаки: гипоэхогенность узла (71,4%), неоднородность структуры (75,0%), нечеткие неровные контуры (51,7%), более высокая встречаемость микрокальцинатов (41,1%) (таблица 3, рис. 5) Такие признаки были выявлены у 67,9% злокачественных очагов. При узлах менее 20 мм в диаметре «типичное» ультразвуковое изображение рака ЩЖ встретилось в 78,8% наблюдений, а при более крупных узлах (свыше 20 мм в диаметре) – лишь в 36,4%.
Рисунок 5. Узел папиллярного рака (двусторонняя стрелка).
«Типичное» ультразвуковое изображение злокачественного узла ЩЖ.
В 32,1% случаев определялось иное ультразвуковое изображение ракового узла, больше соответствующее коллоидному зобу (рис. 6) или аденоме (рис. 7). Такое «нетипичное» ультразвуковое изображение рака ЩЖ чаще выявлялось среди узловых образований размерами свыше 20 мм в диаметре (52,4%), а также среди фолликулярных аденокарцином, при солидных раках и в случае низкодифференцированного рака ЩЖ. Установлению правильного диагноза в этих случая на дооперационном этапе особенно помогала тонкоигольная аспирационная биопсия.
Рисунок 6. Узел папиллярного рака ЩЖ (двусторонняя стрелка). «Нетипичное»
ультразвуковое изображение злокачественного узла ЩЖ. Панорамное сканирование.
Рисунок 7. Узел папиллярного рака ЩЖ (двусторонняя стрелка). «Нетипичное»
ультразвуковое изображение злокачественного узла в перешейке ЩЖ.
Изучение сосудистого рисунка узловых образований тиреоидной паренхимы не способствовало значимому повышению результативности УЗИ в дифференциальной диагностике рака среди других узловых образований ЩЖ (табл. 4).
Таблица 4. Сравнение информативности серошкального УЗИ
и УЗИ с использованием цветокодирующих методик
| Показатели | Серошкальное УЗИ | Серошкальное УЗИ + цветокодирующие методики | Значения критерия z |
|---|---|---|---|
| Чувствительность | 62,5% | 64,3% | 0.002, р=0.942 |
| Специфичность | 84,5% | 87,7% | 1.327, р=0.185 |
| Точность | 82,2% | 85,2% | 1.336, p=0.216 |
| Прогностическая ценность положительного результата | 32,4% | 38,3% | 0.817, р=0.414 |
| Прогностическая ценность положительного результата | 95,0% | 95,4% | 0.248, р=0.808 |
Для большинства (78,5%) раковых узлов была характерна смешанная перинодулярная и внутриузловая ангиоархитектоника с преобладанием внутриузловой гиповаскуляризации, что не отличало их от трети коллоидных узлов и половины аденом (табл. 3, рис. 8). Рассчитанный критерий χ 2 для частоты встречаемости III типа сосудистого рисунка среди раков, аденом и узловых коллоидных узлов составил χ 2 =2,790, р=0,248.
Рисунок 8. Узел папиллярного рака ЩЖ (двусторонняя стрелка).
Сосудистый рисунок узла в режиме ЦДК (слева) и ЭД (справа).
Отсутствие васкуляризации в раковых узлах встретилось лишь в 2 наблюдениях (3,6%) при узлах менее 10 мм в диаметре. Невозможность визуализации их ангиоархитектоники объяснялась наличием кальцинатов, которые частично (рис. 9) или практически полностью выполняли очаги.
Рисунок 9. Аваскулярный узел папиллярного рака (стрелка)
с кальцинатами в структуре. Сканирование в режиме ЭД.
Аваскулярные узловые образования нередко встречались среди коллоидных пролиферирующих узлов (в 7,5% случаев), но это, как правило, были мелкие узелки диаметром не более 6-7 мм. Несмотря на отсутствие значимых различий, среди злокачественных новообразований чаще, чем среди коллоидных узлов и аденом, выявлялись очаги с отсутствием перинодулярной васкуляризации (IV тип сосудистого рисунка). В таких узлах в режимах ЦДК (ЭД) регистрировался внутриузловой, как правило, малоинтенсивный кровоток с отдельными внутриузловыми «обрубленными» и хаотично расположенными сосудами (рис. 10). В этих случаях применение 3-мерной реконструкции сосудистого рисунка (режим 3D-ангио) способствовало уточнению ангиоархитектоники узла, наличия, хода, выраженности и взаиморасположения узловых сосудов (рис. 11).
Рисунок 10. Скудная внутриузловая васкуляризация узла папиллярного рака
(двусторонняя стрелка) (IV тип сосудистого рисунка). Сканирование в режиме ЭД.
Рисунок 11. Сосудистый рисунок узла папиллярного рака (двусторонние стрелки)
в режиме ЭД (слева) и в режиме 3D-ангио.
Несмотря на отсутствие значимого повышения информативности УЗИ с использованием доплеровских методик в дифференциальной диагностике узловых образований различного морфологического строения, результаты ЦДК, ЭД, 3-мерной реконструкции сосудистого рисунка (режим 3D-ангио) следует учитывать при интерпретации ультразвукового изображения любого внутрипаренхиматозного очага. В случае выявления узлового образования только с внутриузловой васкуляризацией (IV тип сосудистого рисунка) и хаотичным дезорганизованным ходом сосудов с большой долей вероятности можно предполагать злокачественную природу узла, особенно при наличии «серошкальных ультразвуковых признаков злокачественности». При получении сосудистого рисунка с перинодулярной и внутриузловой васкуляризацией (III тип) дифференцировать рак, аденому и коллоидный узел при сходной серошкальной картине сложно. Вместе с тем, перинодулярная и внутриузловая гиперваскуляризация с правильным равномерным «спицеобразным» ходом сосудов чаще (в наших наблюдениях в половине случаев) соответствует аденоме (рис. 12). Таким образом, несмотря на то, что цветовое картирование существенно не повышает информативности ультразвуковой диагностики узловых образований щитовидной железы, это исследование является, на наш взгляд, необходимым не только для полноты характеристики обнаруженных образований, но и для корректного проведения обязательной пункционной биопсии.
Рисунок 12. Сосудистый рисунок аденомы ЩЖ в режиме 3D-ангио.
Анализируя сосудистый рисунок выявленных узловых образований, мы обратили внимание, что степень васкуляризации узлов в большей степени определялась размером узла, а не его морфологической структурой (табл. 5).
Таблица 5. Зависимость васкуляризации узловых образований от размеров узлов
| Тип сосудистого рисунка | Размеры узловых образований в мм | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ≤ 10 | от 11 до 20 | от 21 до 30 | от 31 до 40 | > 40 | Всего | |||||||
| Кол-во | % | Кол-во | % | Кол-во | % | Кол-во | % | Кол-во | % | Кол-во | % | |
| I | 23 | 18,1 | 1 | 0,9 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 24 | 6,1 |
| II | 48 | 37,8 | 22 | 20,6 | 7 | 8,4 | 2 | 4,9 | 2 | 5,3 | 81 | 20,5 |
| III с внутриузловой гиперваскуляризацией | 15 | 11,8 | 42 | 39,3 | 30 | 36,1 | 12 | 29,3 | 11 | 28,9 | 110 | 27,8 |
| III с внутриузловой гиповаскуляризацией | 31 | 24,4 | 35 | 32,7 | 45 | 54,2 | 25 | 61,0 | 23 | 60,5 | 159 | 40,2 |
| IV | 10 | 7,9 | 7 | 6,5 | 1 | 1,2 | 2 | 4,9 | 2 | 5,3 | 22 | 5,6 |
| Итого | 127 | 100 | 107 | 100 | 83 | 100 | 41 | 100 | 38 | 100 | 396 | 100 |
| значения χ 2 значения р | 28,241 0,0001 | 49,128 0,0001 | 75,567 0,0001 | 39,884 0,0001 | 36,059 0,0001 | |||||||
Так, среди мелких узлов (менее 10 мм в диаметре) преобладали (63,8%) узлы со скудной васкуляризацией (II или IV типа) или аваскулярные очаги. С увеличением размеров узлов уменьшалась частота встречаемости скудно васкуляризированных образований (с 36,2% при размерах менее 10 мм до 9,8% и 10,6% при размерах очагов свыше 30 и 40 мм). Кроме того, среди образований мелкого и среднего калибра (до 20 мм) с III типом сосудистого рисунка в наших наблюдениях встречались преимущественно узлы с внутриузловой гиперваскуляризацией, а среди более крупных (свыше 20 см и особенно свыше 40 мм в диаметре) – с интранодулярной гиповаскуляризацией.
В общей сложности на дооперационном этапе обследования информативность УЗИ в диагностике злокачественных опухолей ЩЖ составила: чувствительность – 63,4%, специфичность – 87,7%, точность – 85,2%, прогностическая ценность положительного результата – 38,3%, прогностическая ценность отрицательного результата – 95,4%. Информативность УЗИ во многом зависела от размеров опухоли, акустической структуры опухолевого узла, распространенности процесса, количества узлов, наличия синхронных поражений ЩЖ. Так, чувствительность УЗИ при выявлении рака при одиночном и многоузловом поражении составляла соответственно 85,7% против 51,4% (различия статистически значимы, z=2,305, р=0,021). Преобладание в наших наблюдениях пациентов с множественными узловыми образованиями ЩЖ (62,5% против 37,5%), высокая встречаемость «нетипичного» ультразвукового изображения ракового узла (32,1%), большое количество (41,0%) крупных узлов диаметром свыше 2 см объясняли недостаточно высокую чувствительность УЗИ в дифференциации злокачественной патологии ЩЖ. Существенному повышению результативности диагностики рака ЩЖ способствовали тонкоигольные аспирационные биопсии (ТАБ) подозрительных узлов с цитологическим исследованием пунктата. При сочетании УЗИ и ТАБ чувствительность метода возросла до 83,9%, специфичность – до 90,9%, точность – до 89,8%, прогностическая ценность положительного результата – до 62,7%, прогностическая ценность отрицательного результата – до 96,9%.
В случае обнаружения подозрительного в плане злокачественности очага в паренхиме ЩЖ возможностями УЗИ определяли распространенность опухолевого процесса, обращая внимание на нарушение целостности капсулы ЩЖ, наличие измененных лимфоузлов. Дополнительно проводили ультразвуковое обследование других органов и систем (печень, почки), учитывая возможность отдаленного метастазирования.
При исследовании всех образований, а особенно с прикапсульной локализацией и подозрительных на малигнизацию, в обязательном порядке изучали целостность капсулы ЩЖ. Среди заподозренных при УЗИ раках ЩЖ нарушения целостности капсулы в виде неровности, «смазанности» и прерывистости ее контура выявлено у 7 больных с раком ЩЖ (рис. 13).
Рисунок 13. Нарушение целостности капсулы ЩЖ (стрелки)
с инвазией опухоли (двусторонняя стрелка) в прилежащие мышцы.
Измененные лимфоузлы в зонах регионарного лимфооттока найдены при УЗИ у 19 пациентов с раковыми узлами в тиреоидной паренхиме. В 3 наблюдениях ультразвуковое изображение пораженных лимфоузлов очень походило на эхографическую картину ракового узла в ЩЖ. Лимфоузлы были гипоэхогенные, с ровным или неровным четким контуром, ближе к округлой форме, с соотношением длины к ширине Вверх