Что такое agcl в химии
Хлорид серебра (AgCl), формула, диссоциация, свойства
При обнаружении в ионной форме оба элемента могут образовывать соединение хлорида серебра либо естественным путем (как можно найти в некоторых месторождениях), либо химическим синтезом, который дешевле получить.
Хлорид серебра находится в нативном виде в виде хлоргидрита («хлор» для хлора, «аргыр» для аргента). Окончание «ите» указывает на название минерала.
Он имеет зеленовато-желтый вид (очень типичный для хлора) и сероватый по серебру. Эти тональности могут варьироваться в зависимости от других веществ, которые могут быть найдены в окружающей среде.
Полученный синтетически хлорид серебра выглядит как белые кристаллы, очень похожие на кубическую форму хлорида натрия, хотя в целом он будет выглядеть как белый порошок.
Как получить хлорид серебра?
В лаборатории его можно легко получить следующим способом:
Нитрат серебра вступает в реакцию с хлоридом натрия и образуется хлорид серебра, который выпадает в осадок, как показано стрелкой вниз, а нитрат натрия растворяется в воде.
диссоциация
Диссоциация в химии относится к возможности того, что ионное вещество может быть разделено на его компоненты или ионы, когда оно встречает вещество, которое позволяет такое разделение.
Это вещество известно как растворитель. Вода универсальный растворитель, который может диссоциировать большинство ионных соединений.
Низкая диссоциация в воде
AgCl, который принадлежит к этому типу соединений, имеет очень низкую диссоциацию в воде. Такое поведение может быть вызвано следующими причинами:
— Когда образуется AgCl, именно в коллоидном состоянии, когда молекула диссоциирует на свои ионы серебра (+) и хлора (-), сразу же образуется исходная молекула хлорида серебра AgCl, устанавливающая динамическое равновесие между ними. (диссоциированный продукт и нейтральная молекула).
— Из-за молекулярной стабильности AgCl, когда образуется связь, его прочность имеет тенденцию быть более ковалентной, чем ионной, создавая устойчивость к диссоциации.
— Плотность серебра намного выше, чем у хлора, и именно серебро уменьшает диссоциацию и увеличивает осаждение AgCl в растворе.
Одним из факторов, влияющих на растворимость вещества, является температура. При нагревании вещества, растворенного в воде, растворимость увеличивается, и, следовательно, диссоциация его компонентов легче. Однако перед нагреванием AgCl подвергается разложению в газообразном Ag и Cl.
Физические свойства
Это те характеристики, которыми обладает вещество и которые позволяют идентифицировать его и отличать от других. Эти свойства не изменяют внутреннюю структуру вещества; то есть они не изменяют расположение атомов в формуле.
Хлорид серебра имеет твердый белый кристаллический цвет без запаха и в чистом виде имеет геометрию в форме октаэдра. Основные физические свойства описаны ниже:
— Температура плавления: 455 ° C
— Точка кипения: 1547 ° C
— Плотность: 5,56 г / мл
— Молярная масса: 143,32 г / моль.
Когда он обнаружен как хлораргирит (минерал), он имеет твердый вид и может быть бесцветным, зелено-желтым, зелено-серым или белым, в зависимости от места и веществ, которые находятся вокруг него. Твердость по шкале Мооса от 1,5 до 2,5..
Считается также блеском, адамантином (алмазом), смолой и шелковистостью. Это относится к несколько яркой внешности.
Химические свойства
Речь идет о реакционной способности химического вещества, когда он находится в контакте с другим. В этом случае его внутренняя структура не сохраняется, поэтому атомное расположение в формуле изменяется.
Разложение под воздействием тепла или света
Разлагает хлорид серебра на элементы.
Осаждение серебра
растворимость
Хлорид неба очень нерастворим в воде, но растворим в низкомолекулярных спиртах (метанол и этанол), в аммиаке и в концентрированной серной кислоте..
Использование и приложения
фотография
Хлорид серебра используется из-за его высокой чувствительности к свету. Этот процесс был открыт Уильямом Генри Фоксом Тэлботом в 1834 году..
гравиметрия
Гравиметрический анализ состоит в определении количества элемента, радикала или соединения, которое содержится в образце. Для этого необходимо удалить все вещества, которые могут создавать помехи, и преобразовать вещество, подлежащее исследованию, в вещество определенного состава, которое можно взвесить.
Это получается с помощью веществ, которые легко осаждаются в водной среде, как это происходит с AgCl.
Анализ воды
Этот процесс осуществляется посредством оценки, которая проводится с использованием AgNO3 в качестве титранта и индикатора, определяющего окончание реакции (изменение цвета); то есть, когда в воде больше нет хлоридов.
Эта реакция приводит к осаждению AgCl вследствие сродства хлорид-иона к катиону серебра.
волюметрия
Это оценка образца с неизвестной концентрацией (хлориды или бромиды). Чтобы найти концентрацию образца, он реагирует с веществом; конечная точка реакции распознается по образованию осадка. В случае хлоридов это будет хлорид серебра.
Свойства хлорида серебра
Если подружить благородный металл серебро и соляную кислоту, получится хлорид серебра — бесцветные кристаллы или белая соль, способная плавиться при температуре 455° С и кипеть без разложения при 1554° С. Популярность пришла на заре развития фотографии. Способность изменять цвет завораживала. Но помимо светочувствительности, соединение хлора с серебром несет в себе много других замечательных свойств.
И целой страны мало
Серебро по латыни аргентум, поэтому обозначено в химии Ag. В честь него названа целая страна Аргентина, хотя рудники и добыча ведется по всему миру не одно тысячелетие. Есть стойкое убеждение, что запасов его гораздо меньше, чем золота, и придет время, когда их положение в иерархии драгоценностей поменяется. Время покажет, оправданы такие ожидания или нет.
А пока серебро широко используется не только ювелирами. Оно, как в чистом виде, так и в соединениях, широко используется в промышленности и в технике.
Формула хлорида серебра очень проста: одновалентный хлор соединяется с одновалентным Ag и на выходе получают вещество, которое записывается символом AgCl. Но в действительности процесс несколько сложнее. Хлор относится к группе галогенов, активных элементов 17-й группы периодической таблицы Д. И. Менделеева. Галоген с греческого «порождающий соль», потому что все галогены — активные окислители, в чистом виде в природе практически не встречаются.
Серебро, наоборот, принадлежит сообществу благородных металлов, включающему помимо него золото и платиновую группу. Все они, в той или иной степени, химически инертны, «неохотно» вступают в химические реакции. В природе существуют в соединениях и в чистом виде, таком как слитки, самородки, жилы и россыпи, за что их ценят ювелиры и монетные дворы.
Оно более активно, чем золото. Чтобы получить его хлорид, запускают взаимодействие растворимых серебросодержащих солей, обычно — нитрата серебра, с хлоридами, той же поваренной солью. В результате реакции замещения происходит выпадение осадка белого цвета. Соединение нестойкое, через некоторое время под воздействием света темнеет, потому что происходит выделение молекул чистого аргентума, которые соединяются с молекулами серы.
Сероводород всегда присутствует в атмосфере, вот почему серебряные вещи тускнеют и покрываются патиной. Соль, меняющая цвет, подтолкнула к идее фотографического изображения.
Вещество одно, свойств много
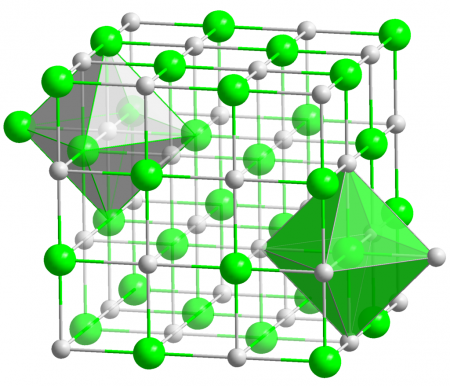
У хлорида серебра кристаллическая структура кубического вида, где центральный атом образует с соседями октаэдр, почти такой же, как у поваренной соли NaCl (хлорид натрия). Но в отличие от последней, плохо растворим в воде. При 25° C произведение растворимости составляет всего 1,77•10−10. Показатели растворимости AgCl в минеральных маслах нулевые. Он не растворяется в минеральных кислотах, этиловом и метиловом спирте, ацетоне. Зато растворим в водных растворах аммиака и в жидком аммиаке.
Модель молекулы аммиака
Аммиак — активное соединение водорода и азота, при его окислении образуются кислоты азота, которые легко увлекают металлы, создавая с ними соли, относящиеся к азотнокислым. В частности, нитрат серебра (формула AgNO3) — кристаллическое вещество, используемое для гальванического серебрения, в производстве зеркал, в медицине (ляпис) и для получения других соединений серебра, в том числе хлорида.
Светочувствительность AgCl, когда цвет меняется на глазах, быстро нашла применение в фотографии, но развитие химии показало, что бромид серебра обладает лучшими свойствами менять цвет под воздействием света.
Тем не менее, AgCl нашел себя в других областях человеческой деятельности. В первую очередь, в медицине и косметике, ведь антибактерицидные свойства серебра известны давно. Вода, в которую опустили серебряный крестик, не портится и не зацветает, становится святой.
И для людей, и для науки
Любое полезное свойство быстро находит применение. Препараты, в основе которых хлорид серебра, встречаются:
В промышленности используется не менее широко:
AgCl большей частью производится лабораторным способом, но его можно встретить и в природе в виде минерала хлораргирита.
При работе всегда есть опасность раздражения на коже и на слизистых оболочках с последующими осложнениями.
Хлорид серебра I
Хлорид серебра I (хлористое серебро) — AgCl, неорганическое бинарное соединение серебра с хлором, серебряная соль хлороводородной (соляной) кислоты. В нормальных условиях представляет собой белый порошок или бесцветные кристаллы. Встречается в природе в виде минерала хлораргирита.
Содержание
Молекулярная и кристаллическая структура
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4. Центральный атом образует с соседями октаэдр, координационное число равно 6.
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера.
Физические свойства
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением:
log10 P = 4,95155 − 8775,980/T−62,718
Получение
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):
Химические свойства
Применение
Безопасность
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.
Хлорид Серебра (свойства реакции применение)
Получение в лабораторных условиях

Реакцией растворимых солей с солями хлоридов :
Нагреванием сульфида серебра с хлоридом натрия в кислороде при нагревании 600°C :
Реакции хлорида серебра

4AgCl + 4КОН = 4КСl + 4Ag + O2 + 2Н2O
Нагревание хлорида натрия с оксидом бария при температуре выше 330°C приводит к свободному серебру хлориду бария и кислороду :
4AgCl + 2BaO = 2BaCl2 + 4Ag + O2

Соединение аммиакат серебра с ацетиленом дает стабильный ацетиленид серебра, который считается инициирующим взрывчатым веществом и работа с ним очень опасна так как ацетиленид легко детонирует от трения, удара и нагрева:
Единственный способ утилизации его реакция с серной кислотой.
Подобно ( нашатырному спирту ) реагирует с карбонатом аммония образуя комплексного соединения и углекислого газа :
AgCl + 2KCN = K[Ag(CN)2] + KCl
Реакция с (тиоцианидом, роданидом, сульфоцианидом) калия даёт сложное комплексное соединение при комнатной температуре и хлорид калия :
Применение хлорида серебра
Статья на тему хлорид серебра
Похожие страницы:
Понравилась статья поделись ей
Свойства, особенности и применение хлорида серебра
В таблице Менделеева нет такого элемента, как AgCl, или хлорид серебра. Он образуется при соединении хлора одновалентного (Cl) с серебром (Ag) такой же валентности.
Образующий соединение хлор (Cl) является галогеном и выступает активным окисляющим веществом, встретить его в природе отдельно большая редкость. Ag является благородным металлом, чистое серебро химически инертно и потому практически не участвует в каких-либо реакциях. Может существовать в форме слитков, самородков, серебряных жил и россыпей.
Серебро в несколько раз более активно, нежели хлор, и для того чтобы образовался хлорид серебра, следует провести операцию, где серебросодержащая соль будет взаимодействовать с хлоридами. К примеру, взаимодействующими элементами могут быть нитрат серебра и хлорид натрия.
Взаимодействие этих веществ осуществляется в ходе реакции замещения, итогом которой является образование белого осадка. Полученное соединение не отличается стойкостью. Попадая под солнечные лучи, осадок темнеет, выделяются молекулы серебра, вступающие в реакцию с молекулами серы в атмосфере. Именно по этой причине темнеют все серебряные изделия.
Особенности
Хлорид серебра имеет кристаллическую структуру. Форма кристаллов кубическая. Расположенный в центре атом соединяется с другими атомами и образует октаэдр. AgCl имеет следующие химические особенности:
Работа с хлоридом серебра
Физические свойства хлористого серебра таковы:
Хлорид серебра — твердое вещество. По шкале твердости соединение оценивается в 2,5 балла. После плавки образуется практически прозрачная масса желто-коричневого цвета, известная как «роговое серебро».
Полученное серебро из хлорида серебра
Применение
AgCl обладает повышенной чувствительностью к свету. Это его свойство используется при изготовлении фотографических эмульсий. Соединение применяется в процессе производства хлор-серебряно-цинковых батарей, а также как покрытие для радаров.
Хлорид серебра входит в состав веществ, из которых изготавливают электропроводящие стекла и линзы для спектрометров. При производстве электродов химических источников тока также используют AgCl. Пытаясь получить рассматриваемое соединение в домашних условиях, действовать следует осторожно. Попав на кожу, вещество может вызвать раздражение.