Что такое абт в медицине
Внебольничная пневмония у взрослых (рекомендации по лечению амбулаторных пациентов)
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Диагностический минимум обследования
Помимо сбора анамнеза и физического обследования диагностический минимум должен включать исследования, позволяющие установить диагноз «внебольничная пневмония» (ВП) и решить вопрос о тяжести течения и необходимости госпитализации пациента. К ним относятся: рентгенография органов грудной клетки в 2-х проекциях, общий анализ крови.
Диагноз ВП может быть установлен только на основании клинической картины заболевания и данных физического обследования без проведения рентгенологического исследования. Однако рентгенография грудной клетки целесообразна в плане оценки тяжести заболевания и для решения вопроса о госпитализации.
Рутинная микробиологическая диагностика ВП в амбулаторной практике недостаточно информативна и не оказывает существенного влияния на выбор антибактериального препарата (категория доказательств В).
Выбор стартовой антибактериальной терапии
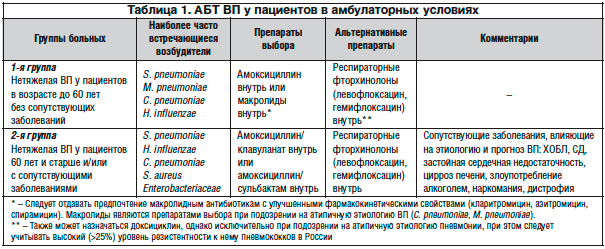
Рекомендации по эмпирической терапии ВП у амбулаторных больных представлены в таблице 1. Среди пациентов, которые могут получать лечение в амбулаторных условиях, выделяют 2 группы, различающиеся между собой по этиологической структуре и тактике антибактериальной терапии (АБТ).
В 1-ю группу включены пациенты в возрасте до 60 лет без сопутствующей патологии. У этих пациентов адекватный клинический эффект может быть получен при применении пероральных препаратов (категория доказательств С). В качестве препаратов выбора рекомендуются амоксициллин (категория доказательств D) или макролидные антибиотики. Несмотря на то, что in vitro аминопенициллины не перекрывают весь спектр потенциальных возбудителей, в ходе клинических исследований не выявлено различий в эффективности этих антибиотиков, а также отдельных представителей класса макролидов или респираторных фторхинолонов (категория доказательств А).
Макролидам следует отдавать предпочтение в первую очередь при непереносимости β-лактамов или при подозрении на атипичную этиологию заболевания (микоплазма, хламидии). В качестве альтернативных препаратов у этой группы пациентов рекомендуются респираторные фторхинолоны.
Во 2-ю группу включены лица пожилого возраста (60 лет и старше) и/или пациенты с сопутствующими заболеваниями, которые влияют на этиологию и являются факторами риска неблагоприятного прогноза при ВП:
У пациентов этой группы адекватный клинический эффект также может быть получен при назначении пероральных антибиотиков. Поскольку вероятность этиологической роли грамотрицательных микроорганизмов (в т. ч. обладающих некоторыми механизмами резистентности) у этих больных возрастает, в качестве препарата выбора рекомендуется амоксициллин/клавуланат. У пациентов данной категории возможно проведение комбинированной терапии β-лактамами и макролидами в связи с возможной хламидийной этиологией ВП. Альтернативой комбинированной терапии β–лактамами и макролидами может быть применение респираторных фторхинолонов (левофлоксацин, моксифлоксацин). Распространенную в некоторых регионах практику широкого использования аминогликозидов (гентамицин и др.) при лечении ВП следует признать ошибочной, т. к. они не активны в отношении пневмококка и атипичных возбудителей.
Парентеральное введение антибиотиков в амбулаторных условиях
Парентеральные антибиотики при лечении ВП в амбулаторных условиях не имеют доказанных преимуществ перед пероральными. Они могут применяться лишь в единичных случаях. У пациентов
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Только для зарегистрированных пользователей
Что такое абт в медицине
Эта глава направлена на то, чтобы в дальнейшем мы могли говорить на одном языке и понимать друг друга.
Автор: Трубачева Е.С., врач – клинический фармаколог
Итак, «Азбука Антибиотиков». Почему «Азбука»? Потому что любое новое направление изучения чего-либо должно начинаться с самых азов. Публикаций по антибактериальной терапии великое множество, книг не меньше, только есть одна маленькая загвоздка – все они предназначены, что называется, для продвинутого пользователя. Вопрос в том, как этим продвинутым стать. Мы решили попытаться решить эту задачу, и поэтому данный цикл не будет содержать ни науки, ни даже наукообразия. Здесь в максимально доступной, а где-то даже в просторечной форме, просто об очень сложном, будет публиковаться материал, без которого постижение антибактериальной терапии становится очень трудоемкой и времязатратной задачей, а то и вовсе вырождается в тоску зеленую. Вот эту самую трудность мы и попытаемся снять, чтобы в дальнейшем было легко ориентироваться в том, что написано для продвинутых пользователей.
Почему «Антибиотиков»? Безусловно, правильно говорить «антимикробный препарат» и «антимикробная терапия». Во-первых, потому что антибиотик – это «антижизнь», и тогда куда девать бактериостатики, которые лишь подавляют размножение? В микробиологические контрацептивы относить? Во-вторых, истинные антибиотики – это то, что природа сама насинтезировала в процессе эволюции в течение даже не веков, а тысячелетий – пенициллин, например. Думать о том, что микромир примитивен – это крайне наивное заблуждение. У микробов формируются целые сообщества (классический пример – биопленка), внутри которых ведется бурная социальная, да, я не оговорилась, именно социальная жизнь. Члены сообщества обмениваются информацией, осуществляют горизонтальный перенос факторов устойчивости, кого-то геноцидят, а кого-то холят и лелеют, как своеобразный back up, на случай гибели популяции. Кроме того, там постоянно ведется борьба за «место под солнцем», и одни популяции тиранят другие, вплоть до межвидовых сражений на уничтожение одних другими. А чем удобнее всего сражаться? Правильно – применением антибиотиков. Или подавлять размножение ненужной популяции в рамках одного сообщества бактериостатиками – именно по этому принципу дикие формы уничтожают антибиотикорезистентные – вторые банально не выдерживают накала внутривидовой борьбы. Все остальное, людьми сочиненное и синтезированное – это антимикробные препараты, перекрывающие весь возможный на данный момент спектр возбудителей и обладающие как бактерицидным, так и бактериостатическим действием. Но как дань традиции и, скажем честно, просто привычке, в медицинской среде всю антимикробную терапию привычно обзывают антибиотиками, и кто мы такие, чтобы эту самую традицию менять. Поэтому все, что будет написано далее, будет называться антибиотиками и антибиотикотерапией (АБТ), подразумевая под собой исключительно антимикробность существующего.
Как будет строиться наш цикл? Во-первых, от простого к более сложному, во-вторых, по алфавиту, для простоты навигации. И сегодня мы поговорим о первой букве алфавита А – «азах».
А – «Азы»
Эта глава направлена на то, чтобы в дальнейшем мы могли говорить на одном языке и понимать друг друга. Что-то объяснено подробно, а что-то пока надо принять за аксиому, так как объяснения займут объем, намного превосходящий данную статью. Мы поговорим и об этом, но чуть позже.
1. С какими возбудителями инфекций мы имеем дело в повседневной практике?
В 95% случаев это будет дикая, непуганая микрофлора, ни разу не встретившая на своем пути сделанный человечеством антибиотик. Таких возбудителей мы будем называть дикими (пару раз в литературе встречалось название «наивные», но оно не прижилось, ибо где, например Yersinia pestis (возбудитель чумы), а где наивность?).
Все, что будет написано в дальнейшем, будет касаться дикой микрофлоры, если не будет указано иное.
2. Что мы понимаем под антимикробной активностью препарата.
Казалось бы, вопрос очень простой – открываем аннотацию к любому антибиотику, и там все подробно написано. Но все не так просто.
Как определяется антимикробная активность? Правильно – в чашке Петри, на которой в присутствии дисков с антимикробными препаратами (или в жидкой питательной среде с разными концентрациями антибиотиков) засевают изучаемую культуру и смотрят, вырастет ли она вообще (тогда говорят о чувствительности к данному препарату), а если вырастет, то в каком количестве (те самые пресловутые один, два или три креста), в результате чего микроб будет объявлен умеренно чувствительным или полностью резистентным. В более продвинутых случаях детекцию антибиотикочувствительности проводят в автоматических анализаторах с определением минимальных подавляющих концентраций возбудителя (MIC или МПК возбудителя). И в этом кроется главная заковыка – все эти чашки и анализаторы не являются живым человеком, а мы даже близко не чашки Петри. В организме имеется великое множество ферментных систем и естественных барьеров, за которые умеют прятаться возбудители и куда не могут пробиться антибиотики. Кроме того, в чашке и анализаторе можно создать совершенно убийственную для микроба среду, а если то же самое повторить с пациентом, пациент может кончиться намного быстрее, чем кончится микроб (об этом мы поговорим в главе «Безопасность»). Давайте примем за аксиому, что то, что написано в аннотации, – это то, что произошло исключительно в чашках и анализаторах, но чаще всего не имеет никакой клинической значимости, то есть по описанному в аннотации антимикробному спектру ориентироваться нельзя, нужна клиническая эффективность.
Кроме того, достаточно регулярно появляются публикации о том, что какой-то пытливый ум провел очередной эксперимент с каким-нибудь НПВС или антиконвульсантом, или еще чем-нибудь совершенно не антимикробным: замешав его в питательную среду, попытался вырастить какой-нибудь микроб, и тот не вырос. И так мы получаем очередную «сенсацию». А сенсация ли это? Конечно, нет. Напомню еще раз – человек не чашка Петри, а главной целью антимикробного препарата является микроб, а никак не человек. А теперь представьте, какую концентрацию того же НПВС в теле человека надо будет создать, чтобы некоторое количество микробной популяции хотя бы придавить. И что будет с тушкой этого человека после этого, так как первоначальная точка приложения данной группы препаратов отнюдь не патогенная флора, не говоря уж о том, что и спектр действия подобной «терапии» совершенно неясен. Что-то упорно подсказывает, что на фоне подобных экспериментов опыты доктора Менгеле покажутся детским лепетом.
Так на что же мы должны ориентироваться в определении антимикробной активности? Как мы уже договорились выше, говорить будем в основном о дикой микрофлоре, и для нее антимикробная активность является табличным справочным материалом, который можно использовать в качестве шпаргалки на первых порах освоения вопроса. Где же взять эти таблицы? Для начала – это любой качественный справочник по антимикробной терапии с соответствующей вкладкой. Причем любой за последние 10-15 лет, так как принципиально в антимикробных спектрах дикой флоры ничего не поменялось, а введенные в практику новые антибиотики – это препараты настолько глубокого резерва, что без специальных знаний их не то, что использовать, трогать нельзя. Вопросы безопасности АБТ мы обсудим отдельно в соответствующей главе.
Какие справочники мы могли бы посоветовать? Во-первых, это издания Смоленского НИИ антимикробной химиотрерапии, которые каждый год реализуются в рамках Конгресса МАКМАХ в Москве в мае. Во-вторых, это в том числе переведенные на русский язык Сэнфордские справочники антимикробной терапии и, отдельно для педиатров, – «Антимикробная терапия у детей по Нельсону». Все они карманного формата и помимо антимикробных спектров содержат огромное количество полезной и необходимой для работы информации. Если вы владеете английским на уровне чтения технической литературы, перед вами раскроются такие источники как справочник по антимикробной терапии Хопкинса (отдельные материалы доступны по этой ссылке) и оригинальный Сэнфорд, которые можно установить в свои гаджеты.
3. Каких возбудителей мы будем истреблять?
В обязательном порядке всех абсолютных патогенов (возбудителей чумы, малярии, тифа и далее по списку). Этих представителей микромира в норме в человеке быть не может. А если они есть, да не просто на коже (тогда бы вымерли все хирурги, АиРы и дерматовенерологи), а во внутренних средах организма – это патоген в 95% случаев. Оставшиеся 5% оставим ацинеткам и синегнойкам на так называемую контаминацию/колонизацию, не вызывающую заболевания, но такие состояния надо уметь отличать от истинного заболевания.
Кроме того, меры высшей социальной защиты применяем по отношению к так называемым условным патогенам, то есть тем микробам, которые в местах своего естественного обитания являются нормальными жителями (например, кишечная палочка в кишке выполняет множество полезных функций, начиная с синтеза витамина К), но стоит им выбраться из этой среды туда куда не надо – тут же начинаются грандиозные проблемы (та же E.coli, влетевшая в легкие в процессе аспирации, вызывает тяжелую пневмонию, а попав в мочевыводящие пути не менее тяжелый пиелонефрит).
Для того чтобы понимать, в какой локации какой микроб норма, а какой уже патология, необходимо знать микробиологию на достаточно высоком уровне, чем мы и будем заниматься в дальнейших главах нашего проекта, а именно постигать АБТ через призму микробиологии, а не банальное перечисление групп препаратов и отдельных их представителей (согласитесь, подобных описаний и так в достатке). Но так как для этого потребуется время, а работать надо здесь и сейчас, то вам помогут вышеуказанные справочники, которые содержат главы «Антибиотикотерапия в зависимости от локализации инфекции», где указываются патогенные микробы для конкретных сред и локаций организма, как уже упомянутая E.coli в бронхоальвеолярном лаваже.
4. Виды антимикробной терапии
Эмпирическую терапию мы используем ежедневно, назначая антибактериальные препараты и не зная наверняка, какой именно возбудитель вызвал заболевание, но предполагая совершенно определенный спектр возбудителей, вызывающих данную инфекцию в зависимости от жалоб, анамнеза и локализации оной. Так как пациента лечить надо сразу, так как при многих состояниях задержка с назначением адекватной терапии увеличивает летальность в 2-3 раза, не говоря о тяжести течения и осложнениях, то были разработаны соответствующие схемы эмпирической терапии. Это тоже является справочным материалом, и толковая книжка в кармане очень помогает решить проблему. Кроме того, в назначении эмпирической терапии может помочь микробиологическая лаборатория, даже в условиях минимального ее оснащения, просто покрасив мазок по Граму, что занимает максимум час с учетом доставки до места. Это поможет сориентироваться, грамположительный или грамотрицательный микроб вызвал текущую проблему (классический пример – покрасить мазок с патологически измененных миндалин и увидеть стрептококк), и назначить антимикробный препарат с соответствующим спектром активности. Еще одним видом помощников являются экспресс-тесты. Подробнее вопрос обсудим в главе по микробиологической диагностике.
Этиотропную терапию мы используем, когда микробиологическая лаборатория выдает результаты посева и чувствительности к антибиотикам и теперь уже почти точно известно, что вызвало заболевание. Почти – это не оговорка, лаборатория может выдать очень странный результат, и задача врача понимать, пришел ли действительно возбудитель, или контаминат, или вообще артефакт. А еще вопрос в том, как быстро лаборатория выдаст этот результат. Идеальной является ситуация, когда лаборатория оснащена системами автоматической детекции и результат выдается в течение максимум 48 часов, укладываясь в рамки сроков оценки эффективности АБТ и принятия последующих решений. Но чаще всего получается так, что пациент давно выписан или переведен в другое отделение, а результаты только-только прибыли, и в такой ситуации смотрим следующий пункт.
5. Критерии эффективности АБТ
– основываются на субъективном мнении врача и клинических критериях.
К клиническим критериям улучшения состояния относятся:
В зависимости от механизма действия препарата, мы используем либо «правило 48 часов», либо «правило 72 часов»
«Правило 48 часов» заключается в том, что мы оцениваем клинические результаты применения антибиотика не ранее, чем через 48 часов, а именно на 3-и сутки. Мы четко должны видеть положительную динамику в виде снижения температуры и интоксикации на фоне приема антибактериальных препаратов. Это правило используется при применении бактерицидных препаратов.
6. Критерии окончания АБТ
Общим правилом для прекращения приема антимикробных препаратов является наступление явного клинического улучшения, определяемого на основании субъективного мнения врача и объективных признаков, таких как:
Антибактериальная терапия инфекционных заболеваний в отделениях реанимации и интенсивной терапии
В.Б. Белобородов
Российская медицинская академия последипломного образования, Москва
Антибактериальная терапия (АБТ) является одним из важнейших компонентов лечения пациентов отделений интенсивной терапии и реанимации (ОИТР). Применение АБТ в условиях ОИТР преследует, как правило, две цели: лечение ведущего патологического процесса и/или нозокомиальной инфекции. В обоих случаях эффективность АБТ может существенно влиять на течение и исход заболевания.
Появление в 70-е годы специализированных ОИТР для больных инфекционными заболеваниями было объективной необходимостью, связанной с появлением новых возможностей лечения. Роль АБТ бактериальных инфекций существенно возрастала в связи с тем, что основной причиной развития жизнеугрожающих состояний был именно инфекционный процесс. Развитие жизнеугрожающего состояния было тесно связано с этиологией возбудителя, его вирулентностью и способностью макроорганизма адекватно реагировать на агрессию. Поэтому эффективное подавление патогенной бактериальной флоры являлось одним из важнейших условий лечения. Естественно, что определенные особенности физиологии ответа макроорганизма на инфекцию, например, закономерные иммунологические нарушения, связанные с возрастом (маленькие дети и пожилые пациенты), также играли важную роль и являлись независимым прогностическим фактором исхода заболевания.
Особенности применения АБТ в инфекционной патологии
Огромный опыт применения АБТ у инфекционных больных был накоплен в процессе развития инфекционной патологии как клинической дисциплины. Сопоставление клинических и бактериологических данных привело к формированию феномена этиологической диагностики. Она подразумевает систему клинико-этиологических сопоставлений и выявление клинических признаков, тесно связанных с этиологией возбудителя. Применение этого подхода в дальнейшем позволило на основании клинических признаков с высокой вероятностью предполагать этиологию возбудителя. Необходимо отметить, что внедрение современных технологий микробиологических исследований в неинфекционной клинике на современном этапе может способствовать развитию аналогичного подхода в общемедицинской практике.
С другой стороны, большой опыт проведения этиотропной терапии ряда инфекционных заболеваний указал на невысокую эффективность или опасность развития неблагоприятного течения заболевания. Это касается, в первую очередь, пациентов c острыми кишечными инфекциями. Были доказаны два основополагающих положения: тяжесть состояния пациентов напрямую связана со степенью выраженности водно-электролитных расстройств, и применение АБТ может приводить к хронизации процесса и формированию носительства патогенных бактерий. Проведение этих исследований совпало по времени с внедрением в клиническую практику антибактериальных препаратов нитрофуранового ряда и левомицетина.
Эффективность АБТ в лечении анаэробной клостридиальной инфекции оценивается противоречиво. Убедительно показана первостепенная важность проведения хирургической обработки и полноценного удаления пораженных тканей в плане прогноза исхода заболевания и купирования клинических признаков (например, столбняка и газовой гангрены). Несмотря на доказанную чувствительность возбудителей этих заболеваний in vitro к ряду антибактериальных препаратов и обязательность их применения, в большинстве случаев эта мера не позволяет контролировать распространение инфекции на окружающие ткани. Развитие инфекции преимущественно в нежизнеспособных тканях, которые не перфузируются кровью, а стало быть, лишены главного пути доставки антибактериальных препаратов, ставит под сомнение эффективность АБТ. Тем более, учитывая, что важнейшим патогенетическим звеном этих инфекций является действие экзотоксинов, а не самих бактерий.
В некоторых случаях локализация возбудителей также может оказывать влияние на эффективность АБТ. Так, известна высокая эффективность пенициллинов и макролидов в отношении Corinebacterium diphtheriae. Однако локализация микроорганизмов в толще многослойных фибриновых пленок на поверхности слизистой оболочки верхних дыхательных путей, в условиях гибели подлежащего эпителия, также является важным фактором ограничения доставки антибактериальных препаратов, вероятности создания ингибирующих рост микроорганизмов концентраций антибиотиков. Применение специфических антитоксической сыворотки или иммуноглобулина для связывания экзотоксина и профилактика цитотоксических эффектов, местное применение антисептиков оказываются намного более эффективными средствами лечения по сравнению с системным применением антибиотиков.
Таким образом, в ряде инфекционных заболеваний недостаточная эффективность АБТ связана с особенностями патогенеза, локализаций возбудителя или ограниченной возможностью создания бактерицидных концентраций в области персистенции патогена.
Особенности применения АБТ при генерализованных инфекциях
Некоторые инфекционные заболевания при определенных условиях могут протекать в виде генерализованных форм. К таким заболеваниям относятся сепсис, брюшной тиф, менингококковая инфекция, лептоспироз и др. Отличительной особенностью этих инфекций является наличие бактеремической фазы, когда возбудители способны размножаться в кровотоке, вызывать генерализованную воспалительную реакцию, поражение сосудистого эндотелия и органную патологию.
Еще одной особенностью является применение АБТ у пациентов с острой печеночно-почечной недостаточностью, например, при иктерогеморрагическом лептоспирозе. В этой ситуации АБТ проводится на фоне органозаместительной терапии (продленная ультрафильтрация, гемодиализ). Характерная клиническая картина и известная чувствительность лептоспир к антибиотикам позволяют проводить эффективную эмпирическую АБТ (пенициллин, ампициллин). При этом дозировка и кратность введения антибиотиков тесно связаны со степенью выраженности почечной недостаточности и характером проведения органозаместительной терапии. В ряде случаев (например, при проведении непрерывной гемофильтрации в течение нескольких суток) выбор дозировки препарата представляет определенную проблему из-за отсутствия информации о реальной концентрации препарата в крови из-за его выделения через мембрану гемофильтра в экстракорпоральный контур.
Отсутствие характерных клинических данных, указывающих на этиологию возбудителя, резко снижает эффективность эмпирической терапии и требует применения комбинации препаратов для максимального расширения спектра антимикробной активности.
В случае развития сепсиса выбор АБТ является достаточно сложным. Это связано с многообразием клинической картины сепсиса и крайней ограниченностью клинических симптомов, позволяющих с высокой степенью вероятности предположить этиологию заболевания. Тяжесть состояния пациентов, высокая вероятность развития органной недостаточности и септического шока диктуют необходимость применения АБТ. Важными факторами, облегчающими выбор антибиотиков, являются данные микробиологического мониторинга этиологии сепсиса в конкретном регионе или стационаре. Основной тенденцией эмпирического выбора препаратов является применение комбинированной терапии (цефалоспорины III-IV поколения + аминогликозиды) или монотерапии препаратом с ультрашироким антибактериальным спектром (карбапенемы). Важным фактором выбора именно этих препаратов является их спектр антибактериальной активности и наличие достоверных данных об их эффективности именно у пациентов ОИТР.
В отсутствие бактериологических данных о возбудителе сепсиса эффективность и длительность комбинированной терапии оцениваются по клиническим данным, важнейшими из которых являются снижение интенсивности генерализованной воспалительной реакции (температуры, лейкоцитоза, палочкоядерного сдвига, тахикардии, одышки, уровня белков острой фазы). В случае проведения комбинированной терапии развитие в процессе лечения резистентности возбудителя сепсиса маловероятно, поэтому при получении позитивного клинического эффекта переход к применению других антибактериальных препаратов нецелесообразен.
После выделения возбудителя сепсиса и определения его антибиотикорезистентности АБТ может претерпеть существенные изменения. Основными принципами выбора целенаправленной АБТ являются высокая эффективность, возможность монотерапии, применение препаратов с низкой токсичностью, применение менее дорогостоящих препаратов. При подтверждении высокой эффективности одного из препаратов, выбранных для проведения комбинированной эмпирической терапии, возможен также переход на монотерапию. Последующий переход на другой препарат в процессе АБТ нецелесообразен. Принципиальное изменение АБТ у больных сепсисом может потребоваться при развитии нозокомиальной инфекции.
Особенности применения АБТ у больных гнойными менингитами
Пациенты с гнойными менингитами являются одной из наиболее тяжелых категорий пациентов инфекционных ОИТР. Это связано с несколькими проблемами: быстрым развитием патологического процесса, значительной продолжительностью догоспитального периода, крайней тяжестью при поступлении, необходимостью поддержания ингибирующей концентрации препарата в субарахноидальном пространстве. Необходимо отметить, что все пациенты ОИТР с гнойными менингитами имеют различную степень нарушения сознания, высокую внутричерепную гипертензию, симптомы дислокации структур мозга. Высокая внутричерепная гипертензия связана с несколькими факторами: развитием местной воспалительной реакции, поражением капилляров с формированием интерстициального (вазогенного) отека головного мозга. В последующем это приводит к нарушению капиллярного кровотока с развитием метаболических (гипоксических) нарушений в клетках головного мозга, снижением доставки и пенетрации антибиотиков
В случае вторичных менингитов у нейрохирургических и ЛОР-пациентов эмпирическая антибактериальная терапия должна учитывать актуальность резистентных пневмококков, метициллинрезистентного S.aureus и коагулазонегативных стафилококков. Поэтому эмпирической терапией является комбинация ванкомицина и цефалоспорина III поколения. Применение ванкомицина для лечения менингита требует дополнительного обсуждения. Это связано с очень низкой проницаемостью препарата через гематоэнцефалический барьер. Идеальным является исследование концентрации ванкомицина в ликворе в процессе проведения терапии с возможной коррекцией уровня с помощью интратекального введения препарата. Доказанная эффективность применения кортикостероидов в комплексе лечения гнойных менингитов также способствует снижению пенетрации ванкомицина.
Особенности применения АБТ при нозокомиальных инфекциях
Нозокомиальные инфекции являются неизбежным злом длительного лечения пациентов в ОИТР. Первым этапом этого процесса является колонизация кожи и слизистой госпитальными штаммами микроорганизмов. Особенностью этих штаммов является приобретение непредсказуемой антибиотикорезистентности в соответствии с практикой применения антимикробных препаратов в данном отделении или учреждении.
Факторами, способствующими переходу колонизации в нозокомиальную инфекцию, являются повреждение слизистых оболочек и кожи, длительная катетеризация сосудов и мочевых путей, имплантация инородных тел и протезов, недостаточное кормление, снижение резистентности организма и др.
Многочисленными исследованиями, проведенными в различных стационарах, показана возможность снижения количества нозокомиальных инфекций только на одну треть даже при оптимальной организации лечебного процесса. Применение антибиотиков с целью профилактики нозокомиальных инфекций оказалось неэффективным.
Особенностью нозокомиальных инфекций в инфекционных ОИТР является то, что они развиваются у пациентов, уже страдающих тяжелым или осложненным инфекционным заболеванием. В этих случаях наличие клинических признаков тяжелой инфекции приводит к стиранию остроты появления клинических симптомов присоединения нозокомиальной инфекции. Поэтому диагностика нозокомиальной инфекции является ответственным и непростым делом. Наличие клинических данных позволяет диагностировать нозокомиальную инфекцию, однако данные микробиологического исследования и антибиотикограммы играют принципиальную роль для выбора АБТ. Необходимо помнить о высокой вероятности выделения штаммов микроорганизмов, не играющих этиологической роли в отношении данного вида нозокомиальной инфекции (контаминация). Даже в том случае, когда по результатам исследования антибиотикорезистентности они могут быть расценены как нозокомиальные. Поэтому от правильности проведения забора материала, проведения микробиологического исследования и адекватной клинической интерпретации полученных результатов зависит в целом эффективность лечения нозокомиальной инфекции. Необходимо напомнить, что только повторные высевы коагулазонегативных стафилококков во всех или подавляющем количестве образцов крови, взятых, по крайней мере, из двух периферических вен (не из катетеров), могут с высокой достоверностью указывать на этиологическую роль данного возбудителя. Применение бронхоальвеолярного лаважа или взятие образца для посева из трахеи под визуальным контролем с использованием специальных защищенных щеточек являются обязательным условием в определении этиологической значимости выделения возбудителя нозокомиальной пневмонии. Получение возбудителя из стерильного, только что введенного катетера из мочевых путей является подтверждением роли данного микроорганизма в этиологии инфекции. Эти методические приемы должны стать рутинными для проведения забора материала на микробиологическое исследование. Обсуждение роли отдельных микроорганизмов в этиологической структуре нозокомиальных инфекций, их антибиотикорезистентность и рекомендации по использованию антибактериальных препаратов могут проводиться только с использованием достоверных данных.
Таблица. Наиболее частые возбудители нозокомиальных инфекций в США
| Возбудитель | Количество случаев | % |
|---|---|---|
| Инфекции кровотока | ||
| Коагулазонегативные стафилококки | 8432 | 33,5 |
| S.aureus | 3381 | 13,4 |
| Энтерококки | 3161 | 12,8 |
| Пневмония | ||
| P.aeruginosa | 8307 | 17,4 |
| S.aureus | 8292 | 17,4 |
| Enterobacter | 5466 | 11,4 |
| Инфекции мочевых путей | ||
| E.coli | 8119 | 19,2 |
| Candida albicans | 6092 | 14,4 |
| Энтерококки | 5975 | 14,1 |
| P.aeruginosa | 4757 | 11,2 |
В заключение необходимо отметить, что электрофизиологический и лабораторный мониторинг пациентов ОИТР играет важную роль для контроля состояния пациентов, планирования объема необходимого лечения и прогноза заболевания. Важность микробиологического мониторинга пациентов ОИТР с применением современных методик неизмеримо возрастает при лечении инфекций, вызванных микроорганизмами с неизвестной антибиотикорезистентностью. Недостаточное внимание к этой серьезнейшей проблеме специалистов, проводящих комплексное лечение наиболее тяжелых пациентов, может сводить на нет огромные затраты, связанные с оказанием разнообразной специализированной помощи. С другой стороны, внедрение мер по профилактике и оптимизации этиотропной терапии инфекционных заболеваний и осложнений может существенно расширить возможности и повысить эффективность оказания помощи пациентам ОИТР. Нерациональная АБТ является экономически невыгодной и снижает эффективность как интенсивной терапии, так и всего комплекса лечения тяжелых больных.