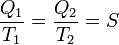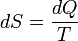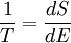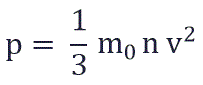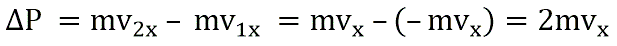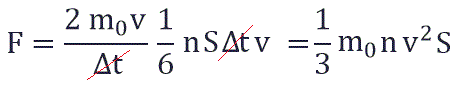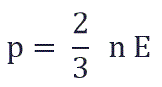Что такое абсолютное значение температуры
абсолютная температура
Смотреть что такое «абсолютная температура» в других словарях:
АБСОЛЮТНАЯ ТЕМПЕРАТУРА — (термодинамическая температура), параметр состояния, характеризующий макроскопич. систему в состоянии термодинамич. равновесия (при этом А. т. всех её макроскопич. подсистем одинакова). А. т. введена в 1848 англ. физиком У. Томсоном (Кельвином)… … Физическая энциклопедия
АБСОЛЮТНАЯ ТЕМПЕРАТУРА — (термодинамическая температура) температура Т, отсчитываемая от абсолютного нуля. Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической… … Большой Энциклопедический словарь
абсолютная температура — (физ.) – измеряемая выше абсолютного нуля. Большой словарь иностранных слов. Издательство «ИДДК», 2007 … Словарь иностранных слов русского языка
АБСОЛЮТНАЯ ТЕМПЕРАТУРА — АБСОЛЮТНАЯ ТЕМПЕРАТУРА, измеряется в градусах Цельсиевой шкалы, но отсчитывается от точки, лежащей на 273° ниже точки замерзания воды. Такая система отсчета особенно удобна для выражения состояния газа формулой Бойля Гей Люссака (Boyle, Gay… … Большая медицинская энциклопедия
абсолютная температура — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN absolute temperatureabsolute temperatureabs … Справочник технического переводчика
Абсолютная температура — Хаотическое тепловое движение на плоскости частиц газа таких как атомы и молекулы Существует два определения температуры. Одно с молекулярно кинетической точки зрения, другое с термодинамической. Температура (от лат. temperatura надлежащее… … Википедия
Абсолютная температура — ► absolute temperature Температура, отсчитываемая от абсолютного нуля (минимально возможная температура во Вселенной). Измеряется в кельвинах (0K = 273.16°С). Например, абсолютная температура кипения воды равна 100°С + 273.16°С = 373.16K … Нефтегазовая микроэнциклопедия
абсолютная температура — термодинамическая (абсолютная) температура Температура, отсчитываемая по термодинамической шкале температур от абсолютного нуля … Политехнический терминологический толковый словарь
абсолютная температура — absoliučioji temperatūra statusas T sritis Standartizacija ir metrologija apibrėžtis Nesisteminis termodinamės temperatūros pavadinimas. atitikmenys: angl. absolute temperature vok. absolute Temperatur, f rus. абсолютная температура, f pranc.… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
абсолютная температура — absoliučioji temperatūra statusas T sritis Standartizacija ir metrologija apibrėžtis Temperatūra, skaičiuojama nuo absoliučiojo nulio, t. y. 0 K arba 273,16 ºC. atitikmenys: angl. absolute temperature vok. absolute Temperatur, f rus. абсолютная… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Абсолютная температура
Температу́ра (от лат. temperatura — надлежащее смешение, нормальное состояние) — физическая величина, примерно характеризующая приходящуюся на одну степень свободы среднюю кинетическую энергию частиц макроскопической системы, находящейся в состоянии термодинамического равновесия.
В системе СИ температура измеряется в кельвинах. Но на практике часто применяют градусы Цельсия из-за привязки к важным характеристикам воды — температуре таяния льда (0° C) и температуре кипения (100° C). Это удобно, так как большинство климатических процессов, процессов в живой природе и т. д. связаны с этим диапазоном.
Существуют также шкалы Фаренгейта и некоторые другие.
Содержание
Молекулярно-кинетическое определение
Температура с молекулярно-кинетической точки зрения — физическая величина, характеризующая интенсивность хаотического, теплового движения всей совокупности частиц системы и пропорциональная средней кинетической энергии поступательного движения одной частицы.
Связь между кинетической энергией, массой и скоростью выражается следующей формулой:
Ek = 1 /2m • v 2
Таким образом частицы одинаковой массы и имеющие одинаковую скорость имеют и одинаковую температуру.
Средняя кинетическая энергия частицы связана с термодинамической температурой постоянной Больцмана:
Eср = i/2kBT
где:
i — число степеней свободы kB = 1.380 6505(24) × 10 −23 Дж/K — постоянная Больцмана T — температура;
Термодинамическое определение
Температура — величина, обратная изменению энтропии (степени беспорядка) системы при добавлении в систему единичного количества теплоты: 1/T = ΔS/ΔQ.
История термодинамического подхода
Слово «температура» возникло в те времена, когда люди считали, что в более нагретых телах содержится большее количество особого вещества — теплорода, чем в менее нагретых. Поэтому температура воспринималась как крепость смеси вещества тела и теплорода. По этой причине единицы измерения крепости спиртных напитков и температуры называются одинаково — градусами.
В равновесном состоянии температура имеет одинаковое значение для всех макроскопических частей системы. Если в системе два тела имеют одинаковую температуру, то между ними не происходит передачи кинетической энергии частиц (тепла). Если же существует разница температур, то тепло переходит от тела с более высокой температурой к телу с более низкой, потому что суммарная энтропия при этом возрастает.
Температура связана также с субъективными ощущениями «тепла» и «холода», связанными с тем, отдает ли живая ткань тепло или получает его.
Некоторые квантовомеханические системы могут находится в состоянии, при котором энтропия не возрастает, а убывает при добавлении энергии, что формально соответствует отрицательной абсолютной температуре. Однако такие состояния находятся не «ниже абсолютного нуля», а «выше бесконечности», поскольку при контакте такой системы с телом, обладающим положительной температурой, энергия передается от системы к телу, а не наоборот (подробнее см. Квантовая термодинамика).
Свойства температуры изучает раздел физики — термодинамика. Температура также играет важную роль во многих областях науки, включая другие разделы физики, а также химию и биологию.
Измерение температуры
Для измерения температуры выбирается некоторый термодинамический параметр термометрического вещества. Изменение этого параметра однозначно связывается с изменением температуры.
На практике для измерения температуры используют
Единицы и шкала измерения температуры
Из того, что температура — это кинетическая энергия молекул, ясно, что наиболее естественно измерять её в энергетических единицах (т.е. в системе СИ в джоулях). Однако измерение температуры началось задолго до создания молекулярно-кинетической теории, поэтому практические шкалы измеряют температуру в условных единицах — градусах.
Шкала температур Кельвина
Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической температурной шкалой. Единица абсолютной температуры — кельвин (К).
Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры — абсолютный ноль, то есть наиболее низкая возможная температура, при которой в принципе невозможно извлечь из вещества тепловую энергию.
Абсолютный ноль определён как 0 K, что приблизительно равно −273.15 °C.
Шкала температур Кельвина — температурная шкала, в которой начало отсчёта ведётся от абсолютного нуля.
Используемые в быту температурные шкалы — как Цельсия, так и Фаренгейта (используемая, в основном, в США), — не являются абсолютными и поэтому неудобны при проведении экспериментов в условиях, когда температура опускается ниже точки замерзания воды, из-за чего температуру приходится выражать отрицательным числом. Для таких случаев были введены абсолютные шкалы температур.
Одна из них называется шкалой Ранкина, а другая — абсолютной термодинамической шкалой (шкалой Кельвина); температуры по ним измеряются, соответственно, в градусах Ранкина (°Ra) и кельвинах (К). Обе шкалы начинаются при температуре абсолютного нуля. Различаются они тем, что кельвин равен градусу Цельсия, а градус Ранкина — градусу Фаренгейта.
Температуре замерзания воды при стандартном атмосферном давлении соответствуют 273,15 K. Число градусов Цельсия и кельвинов между точками замерзания и кипения воды одинаково и равно 100. Поэтому градусы Цельсия переводятся в кельвины по формуле K = °C + 273,15.
Шкала Цельсия
В быту используется шкала Цельсия, в которой за 0 принимают точку замерзания воды, а за 100° точку кипения воды при нормальном атмосферном давлении. Поскольку температура замерзания и кипения воды недостаточно хорошо определена, в настоящее время шкалу Цельсия определяют через шкалу Кельвина: градус Цельсия равен кельвину, абсолютный ноль принимается за −273,15° C. Шкала Цельсия практически очень удобна, поскольку вода очень распространена на нашей планете и на ней основана наша жизнь. Ноль Цельсия — особая точка для метеорологии, поскольку связана с замерзанием атмосферной воды. Шкала предложена Андерсом Цельсием в 1742 г.
Шкала Фаренгейта
В Англии и, в особенности, в США используется шкала Фаренгейта. Ноль градусов Цельсия — это 32 градуса Фаренгейта, а градус Фаренгейта равен 5/9 градуса Цельсия.
Энергия теплового движения при абсолютном нуле
Когда материя охлаждается, многие формы тепловой энергии и связанные с ней эффекты одновременно уменьшаются по величине. Вещество переходит от менее упорядоченного состояния к более упорядоченному. Газ превращается в жидкость и затем кристаллизуется в твёрдое тело (гелий и при абсолютном нуле остается в жидком состоянии при атмосферном давлении). Движение атомов и молекул замедляется, их кинетическая энергия уменьшается. Сопротивление большинства металлов падает из-за уменьшения рассеяния электронов на колеблющихся с меньшей амплитудой атомах кристаллической решётки. Таким образом даже при абсолютном нуле электроны проводимости движутся между атомами со скоростью Ферми порядка 1×10 6 м/с.
Температура, при которой частицы вещества имеют минимальное количество движения, сохраняющееся только благодаря квантовомеханическому движению, — это температура абсолютного нуля (Т = 0К).
Температура с термодинамической точки зрения
Существует множество различных шкал температур. Когда-то температура определялась очень произвольно. Мерой температуры служили метки, нанесённые на равных расстояниях на стенах трубочки, в которой при нагревании расширялась вода. Потом решили измерить температуру ртутным термометром и обнаружили, что градусные расстояния не одинаковы. В термодинамике дается определение температуры, не зависящее от каких-либо частных свойств вещества.
Поскольку найденная функция возрастает с температурой, то можно считать, что она сама по себе измеряет температуру, начиная со стандартной температуры в один градус. Это означает, что можно найти температуру тела, определив количество тепла, которое поглощается тепловой машиной, работающей в интервале между температурой тела и температурой в один градус. Полученная таким образом температура называется абсолютной термодинамической температурой и не зависит от свойств вещества. Таким образом, для обратимой тепловой машины выполняется равенство:
Температура и излучение
При повышении температуры растёт энергия, излучаемая нагретым телом. Энергия излучения абсолютно чёрного тела описывается законом Стефана — Больцмана
Шкала Реомюра
Предложена в 1730 году Р. А. Реомюром, который описал изобретённый им спиртовой термометр.
Единица — градус Реомюра (°R), 1 °R равен 1/80 части температурного интервала между опорными точками — температурой таяния льда (0 °R) и кипения воды (80 °R)
В настоящее время шкала вышла из употребления, дольше всего она сохранялась во Франции, на родине автора.
Переходы из разных шкал
| в\из | Кельвин | Цельсий | Фаренгейт |
|---|---|---|---|
| Кельвин (K) | = K | = С + 273,15 | = (F + 459,67) / 1,8 |
| Цельсий (° C) | = K − 273,15 | = C | = (F − 32) / 1,8 |
| Фаренгейт (°F) | = K · 1,8 − 459,67 | = C · 1,8 + 32 | = F |
Сравнение температурных шкал
| Описание | Кельвин | Цельсий | Фаренгейт | Ранкин | Делиль | Ньютон | Реомюр | Рёмер |
|---|---|---|---|---|---|---|---|---|
| Абсолютный ноль | 0 | −273.15 | −459.67 | 0 | 559.725 | −90.14 | −218.52 | −135.90 |
| Температура таяния смеси Фаренгейта (соль и лёд в равных количествах) | 255.37 | −17.78 | 0 | 459.67 | 176.67 | −5.87 | −14.22 | −1.83 |
| Температура замерзания воды (Нормальные условия) | 273.15 | 0 | 32 | 491.67 | 150 | 0 | 0 | 7.5 |
| Средняя температура человеческого тела ¹ | 310.0 | 36.6 | 98.2 | 557.9 | 94.5 | 12.21 | 29.6 | 26.925 |
| Температура кипения воды (Нормальные условия) | 373.15 | 100 | 212 | 671.67 | 0 | 33 | 80 | 60 |
| Плавление титана | 1941 | 1668 | 3034 | 3494 | −2352 | 550 | 1334 | 883 |
| Поверхность Солнца | 5800 | 5526 | 9980 | 10440 | −8140 | 1823 | 4421 | 2909 |
Некоторые значения в этой таблице были округлены.
Характеристика фазовых переходов
Для описания точек фазовых переходов различных веществ используют следующие значения температуры:
Абсолютная температура
Абсолютная температура — это безусловная мера температуры и одна из главных характеристик термодинамики.
Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической температурной шкалой. Единица абсолютной температуры — кельвин (К).
Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры:
абсолютный ноль — наиболее низкая возможная температура, при которой ничего не может быть холоднее и теоретически невозможно извлечь из вещества тепловую энергию.
Абсолютный ноль определен как 0 K. Что приблизительно равно −273.15 °C. Один Кельвин эквивалентен одному градусу Цельсия (Кельвин не равен одному градусу цельсия)
Содержание
Абсолютная температура с молекулярно-кинетической точки зрения
Мгновенное состояние системы частиц, участвующих в хаотическом тепловом движении.
Термодинамическая температура с молекулярно-кинетической точки зрения — физическая величина, характеризующая интенсивность хаотического, теплового движения всей совокупности частиц системы и пропорциональная средней кинетической энергии поступательного движения одной частицы.
Связь между кинетической энергией, массой и скоростью выражается следующей формулой:
Ek = 1 /2m • v 2
Таким образом частицы одинаковой массы и имеющие одинаковую скорость имеют и одинаковую температуру.
Средняя кинетическая энергия частицы связана с термодинамической температурой постоянной Больцмана:
Eср = 3/2kBT
где:
kB = 1.380 6505(24) × 10 −23 Дж/K — постоянная Больцмана T — термодинамическая температура, К
Энергия теплового движения при абсолютном нуле
Когда материя охлаждается, многие формы тепловой энергии и связанные с ней эффекты одновременно уменьшаются по величине. Вещество переходит от менее упорядоченного состояния к более упорядоченному. Газ превращается в жидкость и затем кристаллизуется в твердое тело (гелий и при абсолютном нуле остается в жидком состоянии при атмосферном давлении). Движение атомов и молекул замедляется, их кинетическая энергия уменьшается. Сопротивление большинства металлов падает из-за уменьшения рассеяния электронов на колеблющихся с меньшей амплитудой атомах кристаллической решетки. Таким образом даже при абсолютном нуле электроны проводимости движутся между атомами со скоростью Ферми порядка 1×10 6 м/с.
Температура с термодинамической точки зрения
Существует множество различных шкал температур. Когда-то температура определялась очень произвольно. Мерой температуры служили метки, нанесенные на равных расстояниях на стенах трубочки, в которой при нагревании расширялась вода. Потом решили измерить температуру ртутным термометром и обнаружили, что градусные расстояния не одинаковы. В термодинамике дается определение температуры, не зависящее от каких-либо частных свойств вещества.
Поскольку найденная функция возрастает с температурой, то можно считать, что она сама по себе измеряет температуру, начиная со стандартной температуры в один градус. Это означает, что можно найти температуру тела, определив количество тепла, которое поглощается тепловой машиной, работающей в интервале между температурой тела и температурой в один градус. Полученная таким образом температура называется абсолютной термодинамической температурой и не зависит от свойств вещества. Таким образом, для обратимой тепловой машины выполняется равенство:
Для системы, в которой энтропия S может быть функцией S(E) ее энергии Е, термодинамическая температура определяется как:
Абсолютная температура
Абсолютная температура — это безусловная мера температуры и одна из главных характеристик термодинамики.
Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической температурной шкалой. Единица абсолютной температуры — кельвин (К).
Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры:
абсолютный ноль — наиболее низкая возможная температура, при которой ничего не может быть холоднее и теоретически невозможно извлечь из вещества тепловую энергию.
Абсолютный ноль определен как 0 K. Что приблизительно равно −273.15 °C. Один Кельвин эквивалентен одному градусу Цельсия (Кельвин не равен одному градусу цельсия)
Содержание
Абсолютная температура с молекулярно-кинетической точки зрения
Мгновенное состояние системы частиц, участвующих в хаотическом тепловом движении.
Термодинамическая температура с молекулярно-кинетической точки зрения — физическая величина, характеризующая интенсивность хаотического, теплового движения всей совокупности частиц системы и пропорциональная средней кинетической энергии поступательного движения одной частицы.
Связь между кинетической энергией, массой и скоростью выражается следующей формулой:
Ek = 1 /2m • v 2
Таким образом частицы одинаковой массы и имеющие одинаковую скорость имеют и одинаковую температуру.
Средняя кинетическая энергия частицы связана с термодинамической температурой постоянной Больцмана:
Eср = 3/2kBT
где:
kB = 1.380 6505(24) × 10 −23 Дж/K — постоянная Больцмана T — термодинамическая температура, К
Энергия теплового движения при абсолютном нуле
Когда материя охлаждается, многие формы тепловой энергии и связанные с ней эффекты одновременно уменьшаются по величине. Вещество переходит от менее упорядоченного состояния к более упорядоченному. Газ превращается в жидкость и затем кристаллизуется в твердое тело (гелий и при абсолютном нуле остается в жидком состоянии при атмосферном давлении). Движение атомов и молекул замедляется, их кинетическая энергия уменьшается. Сопротивление большинства металлов падает из-за уменьшения рассеяния электронов на колеблющихся с меньшей амплитудой атомах кристаллической решетки. Таким образом даже при абсолютном нуле электроны проводимости движутся между атомами со скоростью Ферми порядка 1×10 6 м/с.
Температура с термодинамической точки зрения
Существует множество различных шкал температур. Когда-то температура определялась очень произвольно. Мерой температуры служили метки, нанесенные на равных расстояниях на стенах трубочки, в которой при нагревании расширялась вода. Потом решили измерить температуру ртутным термометром и обнаружили, что градусные расстояния не одинаковы. В термодинамике дается определение температуры, не зависящее от каких-либо частных свойств вещества.
Поскольку найденная функция возрастает с температурой, то можно считать, что она сама по себе измеряет температуру, начиная со стандартной температуры в один градус. Это означает, что можно найти температуру тела, определив количество тепла, которое поглощается тепловой машиной, работающей в интервале между температурой тела и температурой в один градус. Полученная таким образом температура называется абсолютной термодинамической температурой и не зависит от свойств вещества. Таким образом, для обратимой тепловой машины выполняется равенство:
Для системы, в которой энтропия S может быть функцией S(E) ее энергии Е, термодинамическая температура определяется как:
Абсолютная температура, её определение и связь температурных шкал. Свойства абсолютной температуры



Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической температурной шкалой. Единица абсолютной температуры — кельвин (К). Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры — абсолютный ноль, то есть наиболее низкая возможная температура, при которой в принципе невозможно извлечь из вещества тепловую энергию. Абсолютный ноль определён как 0 K, что равно −273.15 °C.
В технике, медицине, метеорологии и в быту в качестве единицы измерения температуры используется шкала Цельсия. В настоящее время в системе СИ термодинамическую шкалу Цельсия определяют через шкалу Кельвина: t(°С) = Т(К) — 273,15 (точно), т. е. цена одного деления в шкале Цельсия равна цене деления шкалы Кельвина.
В Англии и, в особенности, в США используется шкала Фаренгейта. Ноль градусов Цельсия — это 32 градуса Фаренгейта, а 100 градусов Цельсия — 212 градуса Фаренгейта.
В настоящее время принято следующее определение шкалы Фаренгейта: это температурная шкала, 1 градус которой (1 °F) равен 1/180 разности температур кипения воды и таяния льда при атмосферном давлении, а точка таяния льда имеет температуру +32 °F. Температура по шкале Фаренгейта связана с температурой по шкале Цельсия (t °С) соотношением t °С = 5/9 (t °F — 32), t °F = 9/5 t °С + 32. Предложена Г. Фаренгейтом в 1724 году.
Предложена в 1730 году Р. А. Реомюром, который описал изобретённый им спиртовой термометр.
Единица — градус Реомюра (°Ré), 1 °Ré равен 1/80 части температурного интервала между опорными точками — температурой таяния льда (0 °Ré) и кипения воды (80 °Ré)
Связь температуры с кинетической энергией и скоростью движения молекул.
33.Уравнение Клапейрона-Менделеева. Постоянная Больцмана. Число Лошмидта.
Уравнение Клапейрона — Менделеева
Как уже указывалось, состояние некоторой массы газа определяется тремя термодинамическими параметрами: давлением р,объемомVи температуройТ.Между этими параметрами существует определенная связь, называемаяуравнением состояния,которое в общем виде дается выражением
где каждая из переменных является функцией двух других.
Французский физик и инженер Б. Клапейрон (1799—1864) вывел уравнение состояния идеального газа, объединив законы Бойля — Мариотта и Гей-Люссака. Пусть некоторая масса газа занимает объем V1,имеет давлениер1и находится при температуреT1.Эта же масса газа в другом произвольном состоянии характеризуется параметрамир2, V2,T2(рис. 63). Переход из состояния1в состояние2осуществляется в виде двух процессов: 1) изотермического (изотерма1–1′),2) изохорного (изохора1’–2).
В соответствии с законами Бойля — Мариотта (41.1) и Гей-Люссака (41.5) запишем:
Исключив из уравнений (42.1) и (42.2) получим
Так как состояния 1и2были выбраны произвольно, то для данной массы газа величинаpV/Tостается постоянной, т. е.
Выражение (42.3) является уравнением Клапейрона,в которомВ —газовая постоянная,различная для разных газов.
Русский ученый Д. И. Менделеев (1834—1907) объединил уравнение Клапейрона с законом Авогадро, отнеся уравнение (42.3) к одному молю, использовав молярный объем Vm.Согласно закону Авогадро, при одинаковыхриТмоли всех газов занимают одинаковый молярный объемVm,поэтому постояннаяВбудетодинаковой для всех газов.Эта общая для всех газов постоянная обозначаетсяRи называется молярном газовой постоянной.Уравнению
удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа,называемым такжеуравнением Клапейрона — Менделеева.
Числовое значение молярной газовой постоянной определим из формулы (42.4), полагая, что моль газа находится при нормальных условиях (р0=10×1,0135Па,T0=273,15 К,Vm10×=22,41–3м3/моль):RК).×=8,31 Дж/(моль
От уравнения (42.4) для моля газа можно перейти к уравнению Клапейрона — Менделеева для произвольной массы газа. Если при некоторых заданных давлении и температуре один моль газа занимает молярный объем Vm,то при тех же условиях массатгаза займет объемV= (т/М)Vm, гдеМ — молярная масса(масса одного моля вещества). Единица молярной массы — килограмм на моль (кг/моль). Уравнение Клапейрона — Менделеева для массытгаза
где n =m/M — количество вещества.
Часто пользуются несколько иной формой уравнения состояния идеального газа, вводя постоянную Больцмана:
Исходя из этого уравнение состояния (42.4) запишем в виде
где NA/Vm = n — концентрация молекул (число молекул в единице объема). Таким образом, из уравнения
следует, что давление идеального газа при данной температуре прямо пропорционально концентрации его молекул (или плотности газа). При одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул. Число молекул, содержащихся в 1 м3газа принормальных условиях,называетсячислом Лошмидта*
34.Основные положения молекулярно-кинетической теории идеального газа и её основное уравнение.
Основное уравнение молекулярно-кинетической теории (МКТ) с выводом
В статье рассмотрена модель идеального газа, приведено основное уравнение молекулярно-кинетической теории и его вывод.
молекулы имеют пренебрежимо малый объем в сравнении с объемом емкости
при сближении частиц друг с другом и с границами емкости имеют место силы отталкивания
Основное уравнение молекулярно-кинетической теории
p – давление молекул газа на границы емкости,
m0 – масса одной молекулы,
Вывод основного уравнения МКТ
Частицы идеального газа при соударениях с границами емкости ведут себя как упругие тела. Такое взаимодействие описывается согласно законам механики. При соприкосновении частицы с границей емкости проекция vx скоростного вектора на ось ОХ, проходящую под прямым углом к границе сосуда, меняет свой знак на противоположный, но сохраняется неизменной по модулю:
Поэтому после соударения частицы с границей емкости проекция импульса молекулы на ось ОХ меняется с mv1x = –mvxна mv2x = mvx.
Изменение импульса молекулы ΔP равняется удвоенному произведению массы молекулы на ее скорость:
Поскольку в каждом из шести основных направлений декартовой системы координат (вверх, вниз, вперед, назад, вправо, влево) движется одна шестая часть частиц N/6. Тогда число частиц, которые сталкиваются с каждой стенкой за время Δt равно:
S – площадь этой стенки
Давление p равно отношению силы F к площади S, на которую действует эта сила:
Суммарная сила, с которой частицы давят на стенку равна отношению произведения числа этих частиц N и изменения импульса ΔP ко времени, в течение которого происходит давление:
Исходя из вышенаписанного получаем:
и подставить эту формулу в основное уравнение МКТ, получим давление идеального газа:
Давление идеального газа равняется двум третям средней кинетической энергии поступательного движения молекул на единицу объема. При решении задач реальный газ можно считать идеальным газом, если он одноатомный и можно пренебречь взаимодействием между частицами.