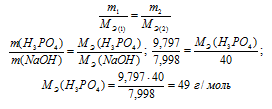Что такое абсолютная масса атома
Атомная масса: определение, виды, как ее вычислить, примеры
Содержание:
В ядре атома находятся протоны и нейтроны; первый с положительным зарядом, а второй с нейтральным зарядом. Эти две субатомные частицы имеют массу, намного превышающую массу электрона; следовательно, масса атома определяется его ядром, а не вакуумом или электронами.
Из-за этого обычно предполагается, что масса атома или атомная масса зависит только от массы ядра; который, в свою очередь, состоит из суммы нейтронов и протонов. Из этого рассуждения вытекают две концепции: массовое число и атомная масса, оба тесно связаны.
При таком большом количестве «пустот» в атомах и поскольку их масса почти полностью зависит от ядра, следует ожидать, что последнее будет чрезвычайно плотным.
Если мы удалим указанную пустоту из любого тела или объекта, его размеры резко уменьшатся. Кроме того, если бы мы могли построить небольшой объект на основе атомных ядер (без электронов), то он имел бы массу в миллионы тонн.
С другой стороны, атомные массы помогают различать разные атомы одного и того же элемента; это изотопы. Поскольку изотопов больше, чем других, необходимо оценить среднюю массу атомов для данного элемента; среднее значение, которое может варьироваться от планеты к планете или от одного космического региона к другому.
Определение и понятие
Атомная масса не может многое сказать об истинной идентичности этого элемента X. Вместо этого используется атомный номер, который соответствует протонам в ядре X. Если это число равно 7, то разница ( 15-7) будет равно 8; то есть X имеет 7 протонов и 8 нейтронов, сумма которых равна 15.
Атомная единица массы
Атомы слишком малы, чтобы можно было измерить их массы обычными методами или обычными весами. Именно по этой причине были изобретены ума, у или да (дальтоник). Эти единицы, разработанные для атомов, позволяют вам понять, насколько массивны атомы элемента по отношению друг к другу.
Но что именно представляет собой ума? Должна быть ссылка на установление массовых отношений. Для этого в качестве эталона использовался атом. 12 C, который является наиболее распространенным и стабильным изотопом углерода. Имея 6 протонов (его атомный номер Z) и 6 нейтронов, его атомная масса равна 12.
Предполагается, что протоны и нейтроны имеют одинаковые массы, так что каждый дает 1 а.е.м. Тогда атомная единица массы определяется как одна двенадцатая (1/12) массы атома углерода-12; это масса протона или нейтрона.
Эквивалентность в граммах
И теперь возникает вопрос: сколько граммов равна 1 а.е.м.? Поскольку поначалу не было достаточно продвинутых методов для его измерения, химики должны были довольствоваться выражением всех масс с помощью amu; однако это было преимуществом, а не недостатком.
Например, возвращаясь к 15 X и 9 Итак, мы имеем, что их атомные массы составляют 15 а.е.м. и 9 а.е.м. соответственно. Поскольку эти единицы настолько малы и напрямую не говорят, сколько вещества нужно «взвесить», чтобы ими манипулировать, они преобразуются в соответствующие им молярные массы: 15 г / моль и 9 г / моль (вводя понятия молей и числа Авогадро).
Средняя атомная масса
Не все атомы одного и того же элемента имеют одинаковую массу. Это означает, что у них должно быть больше субатомных частиц в ядре. Поскольку это один и тот же элемент, атомный номер или количество протонов должны оставаться постоянными; следовательно, существует только изменение количества нейтронов, которыми они обладают.
Вот как это следует из определения изотопов: атомы одного и того же элемента, но с разными атомными массами. Например, бериллий почти полностью состоит из изотопа 9 Быть, со следовыми количествами 10 Быть. Однако этот пример не очень полезен для понимания концепции средней атомной массы; нам нужен один с большим количеством изотопов.
пример
Каждый из трех изотопов J имеет свою атомную массу; то есть их сумма нейтронов и протонов. Однако эти массы необходимо усреднить, чтобы иметь под рукой атомную массу для J; здесь, на Земле, так как могут быть другие регионы Вселенной, где изобилие 86 J составляет 56%, а не 60%.
Чтобы вычислить среднюю атомную массу J, необходимо получить средневзвешенное значение масс его изотопов; то есть с учетом процента численности для каждого из них. Таким образом, мы имеем:
Средняя масса (Дж) = (86 а.е.м.) (0,60) + (88 а.е.м.) (0,20) + (90 а.е.м.) (0,20)
То есть средняя атомная масса (также известная как атомная масса) J составляет 87,2 а.е.м. Между тем его молярная масса составляет 87,2 г / моль. Обратите внимание, что 87,2 ближе к 88, чем к 86, и это также далеко от 90.
Абсолютная атомная масса
Относительная атомная масса
Относительная атомная масса численно идентична средней атомной массе для данного элемента; Однако, в отличие от второго, первому недостает единства. Следовательно, он безразмерен. Например, средняя атомная масса бериллия 9,012182 ед. в то время как его относительная атомная масса просто 9,012182.
Вот почему эти понятия иногда неверно интерпретируются как синонимы, поскольку они очень похожи, а различия между ними неуловимы. Но к чему эти массы относительно? Относительно одной двенадцатой массы 12 С.
Таким образом, элемент с относительной атомной массой 77 означает, что он имеет массу в 77 раз больше, чем 1/12 12 С.
Те, кто смотрел на элементы в периодической таблице, увидят, что их массы относительно выражены. У них нет единиц а.е.м., и они интерпретируются так: атомная масса железа составляет 55 846, что означает, что оно в 55 846 раз больше массы, чем масса 1/12 части тела. 12 C, который также может быть выражен как 55,846 а.е.м. или 55,846 г / моль.
Как рассчитать атомную массу
Математически был приведен пример того, как рассчитать это на примере элемента J. В общих чертах, должна применяться формула средневзвешенного значения, которая будет:
P = Σ (атомная масса изотопа) (содержание в десятичных дробях)
То есть, имея атомные массы (нейтроны + протоны) каждого изотопа (обычно естественного) для данного элемента, а также их соответствующие земные содержания (или любой другой рассматриваемый регион), можно рассчитать указанное средневзвешенное значение.
И почему не только среднее арифметическое? Например, средняя атомная масса J составляет 87,2 а.е.м. Если мы снова вычислим эту массу, но арифметически, мы получим:
Средняя масса (Дж) = (88 а.е.м. + 86 а.е.м. + 90 а.е.м.) / 3
Обратите внимание, что между 88 и 87 есть важное различие. Это потому, что среднее арифметическое предполагает, что содержание всех изотопов одинаково; Поскольку существует три изотопа J, каждый должен иметь содержание 100/3 (33,33%). Но на самом деле это не так: изотопов гораздо больше, чем других.
Вот почему рассчитывается средневзвешенное значение, поскольку оно учитывает, насколько распространен один изотоп по отношению к другому.
Примеры
Углерод
Чтобы вычислить среднюю атомную массу углерода, нам нужны его природные изотопы с их соответствующим содержанием. В случае углерода это: 12 С (98,89%) и 13 С (1,11%). Их относительные атомные массы равны 12 и 13 соответственно, которые, в свою очередь, равны 12 а.е.м. и 13 а.е.м. Решение:
Средняя атомная масса (C) = (12 а.е.м.) (0,9889) + (13 а.е.м.) (0,0111)
Следовательно, масса атома углерода в среднем составляет 12,01 а.е.м. Поскольку есть следовые количества 14 C практически не влияет на это среднее значение.
Натрий
Все земные атомы натрия состоят из изотопа 23 Na, поэтому его содержание составляет 100%. Поэтому в обычных расчетах его массу можно принять просто равной 23 а.е.м. или 23 г / моль. Однако его точная масса составляет 22,98976928 а.е.м.
Кислород
Три изотопа кислорода с их соответствующими содержаниями: 16 О (99,762%), 17 О (0,038%) и 18 О (0,2%). У нас есть все, чтобы рассчитать его среднюю атомную массу:
Средняя атомная масса (O) = (16 а.е.м.) (0,99762) + (17 а.е.м.) (0,00038) + (18 а.е.м.) (0,002)
Хотя его заявленная точная масса на самом деле составляет 15,9994 а.е.м.
Азот
Повторяя те же шаги с кислородом, мы получаем: 14 N (99,634%) и 15 N (0,366%). Так:
Средняя атомная масса (N) = (14 а.е.м.) (0,99634) + (15 а.е.м.) (0,00366)
Обратите внимание, что заявленная масса азота составляет 14,0067 а.е.м., что немного выше, чем мы рассчитали.
Хлор
Изотопы хлора с их соответствующими содержаниями: 35 Cl (75,77%) и 37 Cl (24,23%). Рассчитав его среднюю атомную массу, мы имеем:
Средняя атомная масса (Cl) = (35 а.е.м.) (0,7577) + (37 а.е.м.) (0,2423)
Очень похоже на сообщенный (35 453 а.е.м.).
Диспрозий
И, наконец, будет рассчитана средняя масса элемента с множеством природных изотопов: диспрозия. Вот эти и их соответствующие количества: 156 Dy (0,06%), 158 Dy (0,10%), 160 Dy (2,34%), 161 Dy (18,91%), 162 Dy (25,51%), 163 Dy (24,90%) и 164 Dy (28,18%).
Действуем, как в предыдущих примерах, чтобы вычислить атомную массу этого металла:
Средняя атомная масса (Dy) = (156 а.е.м.) (0,0006%) + (158 а.е.м.) (0,0010) + (160 а.е.м.) (0,0234) + (161 а.е.м.) (0,1891) + (162 а.е.м.) (0,2551) + (163 а.е.м.) (0,2490) + (164 а.е.м.) (0,2818)
Сообщенная масса составляет 162 500 а.е.м. Обратите внимание, что это среднее значение составляет от 162 до 163, поскольку изотопы 156 Ды, 158 Дай и 160 Dy немногочисленны; в то время как преобладающие 162 Ды, 163 Дай и 164 Dy.
Ссылки
Омепразол: что это такое, показания и побочные эффекты
Формула, используемая для преобразования:
Атомная масса атомов, ионов или атомных ядер немного меньше суммы масс составляющих их протонов, нейтронов и электронов из-за потери массы энергии связи (на E = mc 2 ).
СОДЕРЖАНИЕ
Относительная изотопная масса
Относительную изотопную массу (свойство отдельного атома) не следует путать со средней атомной массой (см. Выше), то есть средним значением для многих атомов в данном образце химического элемента.
Похожие термины для разных количеств
Атомная масса (относительная изотопная масса) определяется как масса отдельного атома, который может быть только одним изотопом (нуклидом) за раз, и не является средневзвешенным по содержанию, как в случае относительной атомной массы / атомной массы. масса. Следовательно, атомная масса или относительная изотопная масса каждого изотопа и нуклида химического элемента является числом, которое в принципе может быть измерено с высокой точностью, поскольку ожидается, что каждый образец такого нуклида будет точно идентичен любому другому образцу. поскольку ожидается, что все атомы данного типа в одном и том же энергетическом состоянии и каждый образец определенного нуклида будут точно идентичны по массе любому другому образцу этого нуклида. Например, ожидается, что каждый атом кислорода-16 будет иметь точно такую же атомную массу (относительную изотопную массу), что и любой другой атом кислорода-16.
В случае многих элементов, которые имеют один встречающийся в природе изотоп ( мононуклидные элементы ) или один доминирующий изотоп, разница между атомной массой наиболее распространенного изотопа и (стандартной) относительной атомной массой или (стандартной) атомной массой может быть небольшой. или даже nil, и не влияет на большинство массовых вычислений. Однако такая ошибка может существовать и даже быть важной при рассмотрении отдельных атомов для элементов, которые не являются мононуклидами.
Для немононуклидных элементов, которые имеют более одного общего изотопа, численное различие в относительной атомной массе (атомном весе) даже от наиболее распространенной относительной изотопной массы может составлять половину единицы массы или более (например, см. Случай хлора, где атомарный вес) масса и стандартная атомная масса около 35,45). Атомная масса (относительная изотопная масса) необычного изотопа может отличаться от относительной атомной массы, атомного веса или стандартного атомного веса на несколько единиц массы.
Относительные изотопные массы всегда близки к целым числам, но никогда (за исключением случая углерода-12) точно целым числам по двум причинам:
Отношение атомной массы к массовому числу (числу нуклонов) варьируется от 0,998 838 1346 (51) для 56 Fe до 1.007 825 031 898 (14) для 1 H.
Массовые дефекты в атомных массах
Вот некоторые значения отношения атомной массы к массовому числу:
| Нуклид | Отношение атомной массы к массовому числу |
|---|---|
| 1 ч | 1,007 825 031 898 (14) |
| 2 ч | 1,007 050 888 9220 (75) |
| 3 ч | 1,005 349 760 440 (27) |
| 3 Он | 1,005 343 107 322 (20) |
| 4 Он | 1.000 650 813 533 (40) |
| 6 Ли | 1,002 520 481 24 (26) |
| 12 С | 1 |
| 14 с.ш. | 1.000 219 571 732 (17) |
| 16 O | 0,999 682 163 704 (20) |
| 56 Fe | 0,998 838 1346 (51) |
| 210 По | 0,999 918 4461 (59) |
| 232 Чт | 1.000 164 0242 (66) |
| 238 U | 1.000 213 3905 (67) |
Измерение атомных масс
Связь между атомной и молекулярной массами
| Молярная масса of CH 4 | |||
|---|---|---|---|
| Стандартный атомный вес | Число | Общая молярная масса (г / моль) или молекулярная масса (Да или г / моль) | |
| C | 12,011 | 1 | 12,011 |
| ЧАС | 1,008 | 4 | 4,032 |
| CH 4 | 16,043 | ||
| Молекулярная масса 12 C 1 H 4 | |||
| Масса нуклида | Число | Общая молекулярная масса (Da или u) | |
| 12 С | 12.00 | 1 | 12.00 |
| 1 ч | 1,007825 | 4 | 4,0313 |
| CH 4 | 16.0313 | ||
История
В 1860-х годах Станислао Канниццаро уточнил относительные атомные массы, применив закон Авогадро (особенно на Конгрессе в Карлсруэ 1860 года). Он сформулировал закон для определения относительных атомных масс элементов: различные количества одного и того же элемента, содержащиеся в разных молекулах, являются целыми кратными атомному весу, и определил относительные атомные массы и молекулярные массы, сравнивая плотность пара в совокупности газов с молекулы, содержащие один или несколько рассматриваемых химических элементов.
В 20-м веке, до 1960-х годов, химики и физики использовали две разные шкалы атомных масс. Химики использовали шкалу «атомных единиц массы» (а.е.м.), так что естественная смесь изотопов кислорода имела атомную массу 16, в то время как физики присвоили то же число 16 только атомной массе наиболее распространенного изотопа кислорода ( 16 O, содержащий восемь протонов и восемь нейтронов). Однако, поскольку кислород-17 и кислород-18 также присутствуют в природном кислороде, это привело к двум различным таблицам атомных масс. Единая шкала, основанная на углероде-12, 12 C, удовлетворила потребность физиков основывать шкалу на чистом изотопе, будучи численно близкой к шкале химиков. Это было принято как «единая атомная единица массы». Текущая международная система единиц (СИ) рекомендует в качестве названия этой единицы использовать дальтон и символ «Да». Название «единая атомная единица массы» и символ «u» являются признанными названиями и символами для одной и той же единицы.
В 1979 году в качестве компромисса был введен термин «относительная атомная масса» как вторичный синоним атомного веса. Двадцать лет спустя приоритет этих синонимов изменился, и теперь термин «относительная атомная масса» стал предпочтительным.
Однако термин « стандартные атомные веса» (относящийся к стандартным ожидаемым атомным весам различных образцов) не был изменен, поскольку простая замена «атомного веса» на «относительную атомную массу» привела бы к термину «стандартный относительный атомный вес». масса «
Относительная атомная масса элемента
Абсолютные массы атомов Одним из фундаментальных свойств атомов, является их масса. Абсолютная (истинная) масса атома – величина чрезвычайно малая. Взвесить атомы на весах невозможно, поскольку таких точных весов не существует. Их массы были определены с помощью расчетов.
Например, масса одного атома водорода равна 0,000 000 000 000 000 000 000 001 663 грамма!
Масса атома урана – одного из самых тяжелых атомов, составляет приблизительно 0,000 000 000 000 000 000 000 4 грамма. Записывать и читать эти числа непросто; можно ошибиться, пропустив ноль или добавить лишний. Существует другой способ записи – в виде произведения: 4 ∙ 10−22 (22 – количество нулей в предыдущем числе).
Точное значение массы атома урана – 3,952 ∙ 10−22 г, а атома водорода, самого легкого среди всех атомов, – 1,673 ∙ 10−24 г. Производить расчеты с малыми числами неудобно. Поэтому вместо абсолютных масс атомов используют их относительные массы.
Относительная атомная масса
О массе любого атома можно судить, сравнивая ее с массой другого атома (находить отношение их масс). С момента определения относительных атомных масс элементов использовались различные атомы в качестве сравнения. Своеобразными эталонами для сравнения в свое время были атомы водорода и кислорода.
Единая шкала относительных атомных масс и новая единица атомной массы, принята Международным съездом физиков (1960) и унифицирована Международным съездом химиков (1961). По сегодняшний день эталоном для сравнения является 1/12 часть массы атома углерода. Данное значение называют атомной единицей массы, сокращенно а.е.м
Атомная единица массы (а.е.м.) – масса 1/12 части атома углерода
Сравним, во сколько раз отличается абсолютная масса атома водорода и урана от 1 а.е.м., для этого разделим эти числа одно на другое:
Полученные при расчетах значения и являются относительными атомными массами элементов – относительно 1/12 массы атома углерода.
Так, относительная атомная масса водорода приблизительно равна 1, а урана – 238. Обратите внимание, что относительная атомная масса не имеет единиц измерения, так как при делении единицы измерения абсолютных масс (граммы) сокращаются. Относительные атомные массы всех элементов указаны в Периодической Системе химических элементов Д.И. Менделеева. Символ, при помощи которого обозначают относительную атомную массу – Аr (буква r – сокращение от слова relative, что означает относительный).
Значения относительных атомных масс элементов используются во многих расчетах. Как правило, значения, приведенные в Периодической Системе, округляются до целых чисел. Обратите внимание, что элементы в Периодической Системе размещены в порядке увеличения относительных атомных масс. Например, при помощи Периодической Системы определим относительные атомные массы ряда элементов:
Ar(Na) = 23;
Относительную атомную массу хлора принято записывать равной 35,5!
Вычисление количества вещества эквивалента, молярной массы эквивалента, абсолютной атомной и молекулярной массы
Задание 18.
Исходя из молярной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах.
Решение:
Моль – это количество вещества, в котором содержится число частиц любого определённого сорта равное постоянной Авогадро (6,02 . 10 23 ). Молярная масса вещества – это масса одного моля, выраженная в граммах, (г/моль) и численно равная его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а. е. м. ). Так как атомная масса углерода и молекулярная масса воды соответственно равны 12 и 18 а. е.м., то их молярные массы равны: М(С) = 12 г/моль; М(Н2О) = 18 г/моль. Исходя из того, что 1 моль любого вещества содержит 6,02 . 10 23 частиц (атомов или молекул). Рассчитаем массу атома углерода и массу молекулы воды, получим:
Задание 19.
На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NаОН. Вычислите количество вещества эквивалента, молярную массу эквивалента и основность Н3РО4 в этой реакции. На основании расчета напишите уравнение реакции.
Решение:
М(H3PO4) = 98 г/моль; М(NaOH) = 40 г/моль; МЭ(NaOH) = 40 г/моль.
Согласно закону эквивалентов массы (объёмы) реагирующих веществ m1 и m2 пропорциональны их молярным массам (объёмам):
Количество вещества эквивалента равно:
Э = М Э ( H 3 PO 4)/ М( H 3 PO 4) = 49/98 = 0,5 моль.
Уравнение реакции имеет вид:
Ответ: 0,5 моль; 49 г/моль; основность кислоты 2.
Что такое абсолютная масса атома
Основные определения химии.
АБСОЛЮТНАЯ АТОМНАЯ МАССА (а.е.м.)- это 1/12 часть атома углерода.
ИЗОТОПЫ – это разновидности атомов одного элемента обладающие одинаковыми зарядами ядер, но разными массовыми числами.
МЕТАЛЛИЧНОСТЬ – это способность атома элемента отдавать электрон. Количественной характеристикой этой величины является энергия ионизации (I)
НЕМЕТАЛЛИЧНОСТЬ – это способность атома присоединять электрон. Количественной характеристикой этой величины является энергия сродства к электрону(Еср).
ОРБИТАЛЬ – это часть атомного пространства, в которой вероятность нахождения данного электрона наибольшая (равна 90%).
ОСНОВНОЕ (УСТОЙЧИВОЕ) СОСТОЯНИЕ АТОМА –это такое состояние, которое характеризуется минимальной энергией. Поэтому электроны заполняют орбитали в порядке увеличения их энергии.
ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И. МЕНДЕЛЕЕВА –свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины атомной массы элементов.
ПРАВИЛО ХУНДА (ГУНДА) – на одном уровне электроны располагаются так, чтобы абсолютное значение суммы спиновых квантовых чисел (суммарного спина) было максимальным. Это соответствует устойчивому состоянию атома.
ПРИНЦИП ПАУЛИ – в атоме не может быть 2-х электронов с одинаковым набором всех 4-х квантовых чисел.
ХИМИЧЕСКОЕ УРАВНЕНИЕ – это выражение химической реакции, в котором записаны формулы исходных веществ (реагентов и продуктов реакции), а также коэффициенты, показывающие число молекул каждого вещества.
ЭНЕРГИЯ СРОДСТВА К ЭЛЕКТРОНУ (Еср)- это энергия, которая выделяется при присоединении электрона к нейтральному атому, т.е. превращении атома в отрицательно заряженный ион: