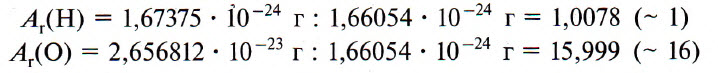Что такое абсолютная и относительная атомная и молекулярная массы
Определение абсолютной и относительной массы вещества
Абсолютная и относительная масса атомов и молекул
Массу относят к фундаментальным характеристикам атома. Поскольку ее абсолютное значение очень мало, в химии вводится понятие относительной, т.е. условной, атомной массы.
Ничтожный размер атома не исключает наличия у него атомной массы. Вся масса атома сосредоточена в ядре (протон и нейтрон практически в 2000 раз тяжелее, чем электрон). В результате почти вся масса атома приходится на общую массу нейтронов и протонов. К примеру, атомная масса кислорода равняется 2,667·10-23 г. Это его абсолютная атомная масса. Работать с таким числом неудобно. Поэтому было предложено ввести еще одну величину – относительную атомную массу.
В начале XIX века Дж. Дальтон предложил, вычисляя атомную массу, использовать в качестве эталона массу атома водорода, поскольку он является самым легким элементом. Именно по отношению к нему выражались массы атомов прочих элементов.
Однако с учетом того, что на практике чаще использовались кислородные соединения для вычисления атомных масс многих элементов, в качестве эталона удобнее стало использовать атомную массу кислорода. При этом известно, что соотношение атомных масс кислорода и водорода равно 16:1. Так возникло понятие кислородной единицы – 1/16 части его атомной массы.
Таким образом, относительная атомная масса показывает, во сколько раз масса атома конкретного элемента больше массы атома, который принимается за единицу. Сегодня это 1/12 часть массы атома углерода. Это и есть атомная единица массы, которую иногда обозначают как «дальтон».
Относительная атомная масса – отношение массы атома определенного элемента к 1/12 массы атома изотопа углерода-12. По сути относительная атомная масса является безразмерной величиной (при ее расчете единицы измерения сокращаются), но иногда ее значение выражают в атомных единицах массы (а.е.м.).
Абсолютная масса атома углерода составляет 1,993·10-23 г, согласно Периодической таблице Д.И. Менделеева. Его относительная атомная масса равна 12. Следовательно, 1/12 часть массы атома углерода составляет:
Масса одного кислородного атома приблизительно в 16 раз превышает 1/12-ю массы углеродного атома 12С.
Чтобы вычислить относительную молекулярную массу вещества, нужно сложить суммы относительных атомных масс элементов, входящих в состав молекулы, с учетом индексов, которые показывают количество атомов элемента в молекуле. Абсолютная масса одной молекулы равна относительной, умноженной на одну атомную единицу массы (1 а.е.м.).
Относительная атомная масса химического элемента
Например, определение относительной массы атома водорода выглядит так:
Элемент кислород имеет следующую относительную атомную массу:
Из формул следует, что относительная атомная масса является величиной, равной отношению абсолютной атомной массы к единице массы u (или 1 а.е.м.).
Относительная молекулярная масса вещества
Если молекула состоит из атомов нескольких химических элементов, то ее относительная молекулярная масса равна сумме их относительных атомных масс с учетом индексов в формуле вещества.
Рассмотрим пример. Молекула воды имеет в своем составе два атома водорода и один – кислорода. Чтобы определить относительную молекулярную массу, нужно сложить произведения относительной атомной массы каждого элемента на соответствующее количество атомов:
Знание относительной молекулярной массы веществ в газообразном состоянии помогает в решении задач по сравнению их плотности. Для этого высчитывается относительная плотность газов друг по другу, которая равна соотношению их относительных молекулярных масс:
Поскольку закон Авогадро применим исключительно к газообразным веществам, а ученым-химикам часто необходимо знать, сколько молекул, атомов или ионов заключено в определенных порциях твердых веществ или жидкостей, введено понятие молярной массы. Ее значение численно равно относительной молекулярной массе.
Как вычислить абсолютную массу, формулы, примеры
Найти молекулярную массу серной кислоты, используя таблицу Менделеева.
Известно, что молекулярная масса вещества равна сумме атомных масс веществ, входящих в состав молекулы. Поэтому:
M r ( H 2 S O 4 ) = 1 · 2 + 32 + 16 · 4 = 98 г / м о л ь
Решение химических задач по нахождению абсолютной массы может сводиться к использованию следующих методов:
При этом молярную массу можно найти путем сложения атомных масс элементов, входящих в состав соединения. Молярная масса находится также как отношение массы вещества к его соответствующему количеству:
Относительная атомная и молекулярная масса (химия 8 класс)
Относительная и абсолютная масса атома
Абсолютная атомная масса — это реальный вес атома, измеряемый в единицах СИ килограммах, обозначается буквами ma. На сегодняшний день определен вес атомов всех известных химических элементов. Реальный вес атома измеряется с использованием сложного оборудования, поэтому как эталон этих измерений выступает 1/12 часть ma углерода.
Исключением является Аr (Cl), ее численное значение округляется до десятых и составляет 35,5.
Примеры заданий
Решение типичных задач заключается в сравнении относительных атомных масс элементов, вычислении ma при известной Ar и наоборот. Рассмотрим примеры.
Во сколько раз кальций легче брома? По периодической таблице находим:
Ответ: атом кальция в 2 раза легче атома брома.
По таблице Менделеева определяем элемент с Ar, равной 16, — это кислород.
Ответ: Ar = 16, искомый элемент — кислород.
Вычислите ma алюминия в кг.
По таблице Менделеева Ar (Al) = 27, это означает, что атом алюминия в 27 раз тяжелее 1/12 части атома углерода. Следовательно, чтобы найти ma алюминия, надо:
Относительная молекулярная масса
Все молекулы складываются из атомов, следовательно, вес молекулы составляет суммарное значение масс всех атомов.
Допустим, что необходимо Mr (Н2О). Используя периодическую таблицу, находим:
Mr (Н2О) = Ar (Н)*2 + Ar (О) = 1*2 + 16 = 18.
Решение задач
Рассмотрим примеры задач, связанных с нахождением Mr при известной формуле, и обратные задачи — нахождение формулы вещества по известной Mr.
Вычислить Mr сульфата железа (III):
Mr (Fe2 (SO4)3) = 56*2 + (32 + 16*4)*3 = 400
Х2СО3 — найти неизвестный элемент Х и правильно написать формулу вещества, зная, что его Mr = 106.
Составим уравнение:
По таблице Менделеева находим элемент с Ar = 23 — натрий.
Ответ: формула вещества Na2СО3.
Сначала вычислим Mr молекулы. Для этого реальный вес молекулы делим на массу одной атомной единицы:
По таблице Менделеева находим элемент — азот.
Ответ: молекулярная формула вещества N2.
Найди число атомов кислорода в соединении с углеродом и напиши химическую формулу вещества, если в молекуле содержится 1 атом углерода и Mr = 44.
Решение задач позволяет на практике закрепить знания об относительных атомных и молекулярных массах, строении вещества, химических формулах веществ. При этом важно умение правильно пользоваться периодической таблицей Д. И. Менделеева.
Молекулы. Химические формулы. Атомные и молекулярные массы. Элементный состав веществ
«Управление общеобразовательной организацией:
новые тенденции и современные технологии»
Свидетельство и скидка на обучение каждому участнику
1.1.1.Молекулы. Химические формулы. Атомные и молекулярные массы. Элементный состав веществ
Молекулы HCl и H 2 O также образуются из атомов, объединяемых химическими связями:
Явление образования молекул из атомов объясняется появлением химических связей между атомами. Каждый атом имеет электронную плотность, которая заряжена отрицательно. При взаимодействии электронных плотностей (при их перекрывании) образуется общая электронная плотность, удерживающая два атома друг с другом. Такой тип химической связи по типу образования общей электронной плотности между атомами неметаллов называется ковалентной. Подробное описание химических связей мы рассмотрим в следующих главах.
Химические формулы показывают как качественный, так и количественный состав молекулы.
Качественный состав дает характеристику состава молекулы (из каких атомов химических элементов она состоит).
Количественный состав характеризует стехиометрические соотношения между молекулами (Один к одному или один к двум).
Любое чистое вещество состоит из однотипных повторяющихся молекул. Тогда различия в химических свойствах веществ обусловлены различиями в составе и строении молекул, из которых состоят эти вещества. Тогда:
Молекула – это наименьшая частица вещества, которая сохраняет его химические свойства.
m ( p + ) ≈ m ( n 0 ) ≈ 1 а.е.м. (атомная единица массы) ≈ 1/12 m (атома C )
У каждого химического элемента в табл. Д.И. Менделеева есть свое значение относительной атомной массы. Относительная она потому, что ее отнесли к 1/12 части абсолютной массы атома углерода, т.е. атомной единицы массы.
Относительная атомная масса – это число, которое показывает, во сколько раз абсолютная масса атома данного элемента больше 1/12 части абсолютной массы атома углерода, т.е. атомной единицы массы.
Относительная атомная масса обозначается символом « A r ». Определение относительной атомной массы сводится к поиску заданного химического элемента в периодической таблице и определению его значения относительной атомной массы (Рисунок 3).
Рисунок 3 – Расшифровка записи химического элемента в периодической таблице
Так как значения относительной атомной массы нецелочисленные (есть цифры после запятой), то прибегают к математическим приближениям:
В случае аргона ( Ar ) значение относительной атомной массы 39,948 округляют до 40: A r ( Ar ) = 40 а.е.м.
Это означает, что сумма протонов и нейтронов составляет значение 40:
Количество протонов ( p + ) в атоме аргона равно 18 (так как порядковый номер определяет количество протонов в ядре атома). Тогда количество нейтронов находится по формуле:
Таким образом, количество нейтронов в атоме аргона получилось равным 22, а количество протонов 18. В сумме количество нуклонов образовали относительную атомную массу равную 40 а.е.м.
Атомная единица массы (а.е.м.) – это 1/12 часть абсолютной массы атома углерода.
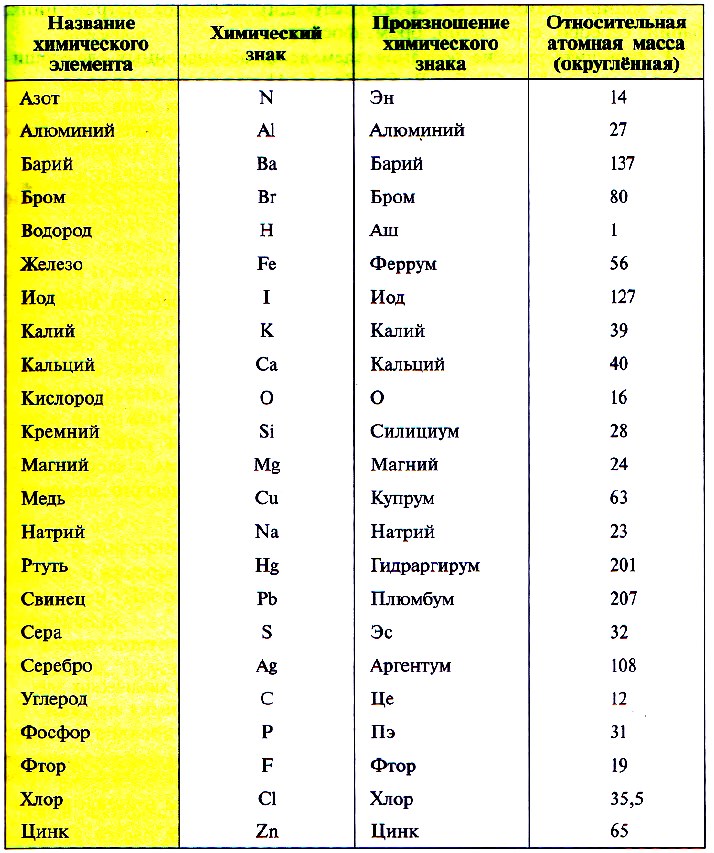
В таблице 3 приведены относительные атомные массы некоторых химических элементов.
Молекула состоит из атомов. Это означает, что зная относительную атомную массу, можно вычислить относительную молекулярную массу. Она будет складываться из суммы атомных масс входящих в состав молекулы атомов.
Относительная молекулярная масса вещества Mr – это число, которое показывает, во сколько раз абсолютная масса молекулы данного вещества больше 1/12 части абсолютной массы атома углерода C.
Что такое абсолютная и относительная атомная и молекулярная массы
Ключевые слова конспекта: атомная единица массы, относительная атомная масса химических элементов, относительная молекулярная масса.
Атомная единица массы — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Обратите внимание! На Земле встречаются три разновидности атомов углерода, различающиеся только массой. Такие разновидности атомов одного и того же элемента называют изотопами. В данном случае речь идёт о разновидности, масса атомов которой в атомных единицах массы равна 12.
Разделив массу атома какого-либо химического элемента на 1/12 массы атома углерода, получают величину, которую называют относительной атомной массой и обозначают Аr (А — от слова «атом», r — от латинского слова relativus — относительный).
Например, относительную атомную массу водорода и кислорода вычисляют следующим образом:
Относительная атомная масса элемента (Аr) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а. е. м.
Так как первую таблицу относительных атомных масс ряда элементов составил английский учёный Джон Дальтон в 1803 г, то в память о его трудах химики иногда называют атомную единицу массы дальтоном (сокращённо Da). Значение относительной атомной массы каждого химического элемента приведено в периодической таблице Д. И. Менделеева. На практике эти значения обычно округляют до целых чисел.
Относительная молекулярная масса
Массу молекул, так же как массу атомов, принято выражать в атомных единицах массы. Разделив массу молекулы какого-либо вещества на 1/12 массы атома углерода, получают величину, которую называют относительной молекулярной массой вещества.
Относительная молекулярная масса вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная молекулярная масса Мr — безразмерная величина. Она складывается из относительных атомных масс элементов, составляющих молекулу, например:
Конец конспекта «Относительная атомная масса. Относительная молекулярная масса».
Видеоурок «Относительная атомная и молекулярная массы»
Молекулярная масса
Атомы и молекулы – мельчайшие частицы любых химических вещества. Если постараться выразить их массу в граммах, то получится число, в котором перед запятой будет находиться около 20 нулей. Поэтому измерять массу в таких единицах, как граммы, неудобно. Чтобы выйти из этой ситуации, следует какую-нибудь очень малую массу принять за единицу, а все остальные массы выражать по отношению к ней. В качестве этой единицы используют 1/12 массы атома углерода.
Относительна молекулярная масса – это масса молекулы вещества, которую измеряют в атомных единицах массы. Молекулярная масса равна отношению массы молекулы того или иного вещества к 1/12 части массы атома углерода. Она показывает, во сколько раз масса молекулы определенного вещества больше 1/12 массы атома углерода.

Молекулярную массу часто путают с молярной массой, единицей измерения которой является г/моль. И действительно численно эти две величины абсолютно идентичны, однако размерность у них абсолютно разная.
Относительную молекулярную массу можно найти, сложив между собой атомные массы
Чтобы вычислить молекулярную массу простых и сложных веществ, необходимо найти сумму относительных атомных масс атомов, входящих в состав молекулы. Например, относительная молекулярная масса воды Mr (H2O), которая состоит, как известно, из двух атомов водорода и одного атома кислорода, равна 1*2+16=18.
Это означает, что масса молекулы воды в 18 раз больше 1/12 массы атома углерода. А молекулярная масса воздуха равна 29.

Видео
Молекулярная масса
Зная атомные массы отдельных элементов, можно находить и молекулярные массы молекул. Для этого надо всего лишь сложить атомные массы тех атомов, которые входят в состав молекулы.
Например, рассмотрим молекулу метана, она имеет формулу СН4, то есть состоит из 1 атома углерода (который весит 12 а. е. м.) и 4 атомов водорода (каждый массой по 1 а. е. м.). Складываем атомные массы:
12 + 1 + 1 + 1 + 1 = 12 + 4•1 = 16 а. е. м.
Итак, молекула метана имеет молекулярную массу 16 а. е. м.
Заметим, что очень часто возникает путаница из-за молекул простых газов – водорода, кислорода, азота и т. д. Дело в том, что их молекулы состоят из двух атомов, поэтому и масса у них вдвое больше, чем масса атомов. Например, атомная масса элемента кислород – 16 а. е. м., а вот молекула кислорода, имеющая формулу О2, весит уже 16•2 = 32 а. е. м.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr . При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Как вычислить абсолютную массу, формулы, примеры
Найти абсолютную массу молекулы C2H6. Решение Исходя из утверждения, что абсолютная масса молекулы равняется произведению ее относительной молекулярной массы на атомную единицу массы, получаем: m(C2H6)=Mr(C2H6)·1,661·10-27=49,82·10-27кг=49,82·10-24г
Найти молекулярную массу серной кислоты, используя таблицу Менделеева. Решение Известно, что молекулярная масса вещества равна сумме атомных масс веществ, входящих в состав молекулы. Поэтому: Mr(H2SO4)=1·2+32+16·4=98г/моль