Что такое абдоминальная боль
Хроническая абдоминальная боль и синдром раздраженного кишечника
Серьезной проблемой внутренних болезней и гастроэнтерологии была и остается абдоминальная боль. Наибольшие сложности возникают при выявлении причин хронического болевого абдоминального синдрома.
Серьезной проблемой внутренних болезней и гастроэнтерологии была и остается абдоминальная боль. Наибольшие сложности возникают при выявлении причин хронического болевого абдоминального синдрома. Понимание механизмов, лежащих в основе формирования болевого синдрома, отчасти может помочь в установлении его причины и выборе пути его купирования [2].
Появление боли связано с активацией ноцицепторов, расположенных в мышечной стенке полого органа, в капсулах паренхиматозных органов, в брыжейке и перитонеальной выстилке задней стенки брюшной полости, растяжением, напряжением стенки полого органа, мышечными сокращениями. Слизистая желудочно-кишечного тракта (ЖКТ) не имеет ноцицептивных рецепторов, поэтому ее повреждение не вызывает болевых ощущений. Воспаление, ишемия органов ЖКТ через выделение биологически активных субстанций (БАС): брадикинин, серотонин, гистамин, простагландины и др. приводят к изменению порога чувствительности сенсорных рецепторов либо напрямую их активируют. Эти же процессы могут провоцировать или усугублять спазм гладкой мускулатуры кишечника, что в свою очередь вызывает раздражение ноцицепторов и ощущение боли. Сигналы от кишечника передаются по афферентным волокнам через спинальные ганглии, достигают передних отделов головного мозга, где в постцентральной извилине происходит осознание ощущения боли. Эфферентные волокна идут на периферию и вызывают сокращение и расслабление гладкой мускулатуры, вазодилятацию. Большое количество различных нейронов оказывает модулирующее влияние на восприятие боли и ответ на нее.
В целом выделяют четыре основных механизма формирования абдоминальной боли: висцеральная, париетальная, иррадиирующая и психогенная.
Одним из вариантов абдоминальной боли вследствие органических причин может быть париетальная боль, возникающая из-за вовлечения брюшины. Она в основном острая, четко локализована, сопровождается напряжением мышц брюшной стенки, усиливается при изменении положения тела, кашле.
Наиболее частым механизмом абдоминальной боли является висцеральная боль, которая вызывается повышением давления, растяжением, натяжением, расстройством кровообращения во внутренних органах и может быть результатом как органических, так и функциональных заболеваний. Боль обычно носит характер тупой, спастический, жгучий, не имеет четкой локализации. Она нередко сопровождается разнообразными вегетативными проявлениями: потливостью, беспокойством, тошнотой, рвотой, бледностью. Благодаря большому количеству синапсов между нейронами нередко возникает двойная иннервация, лежащая в основе иррадиирующего характера боли. Под последней понимают отражение болевых ощущений при интенсивном висцеральном импульсе в области зон повышенной кожной чувствительности, в месте проекции других органов, иннервируемых тем же сегментом спинного мозга, что и вовлеченный орган.
На начальных этапах органические заболевания (аппендицит, дивертикулярная болезнь и пр.) могут сопровождаться висцеральной болью, затем в случае присоединения воспаления брюшины — париетальной.
Психогенная боль возникает при отсутствии соматических причин и обусловлена дефицитом ингибирующих факторов и/или усилением нормальных входящих афферентных сигналов, вследствие поражения центральных контролирующих механизмов и/или снижения синтеза БАС. Боль постоянная, резко снижающая качество жизни, не связана с нарушением моторики, с приемом пищи, перистальтикой кишечника, дефекацией и другими физиологическими процессами.
При функциональных заболеваниях механизмы формирования боли различны и могут носить изолированный или сочетанный характер: висцеральный генез нередко сочетается с иррадиирующим и/или психогенным механизмами. В основном боли носят дневной характер, редко возникают во время сна [4].
В практике значительно больше вероятность органической причины, лежащей в основе висцеральной боли, при наличии симптомов «тревоги», к которым относятся: преимущественно ночной характер боли, будящий больного ото сна; дебют симптомов в возрасте после 50 лет; наличие онкологических заболеваний в семье; наличие лихорадки у пациента; немотивированная потеря массы тела; выявленные при непосредственном исследовании больного изменения (гепатомегалия, спленомегалия и т. д.); изменения лабораторных показателей мочи, кала и крови; изменения, выявленные с помощью инструментальных исследований (камни в билиарном тракте, дивертикулы толстой кишки, расширенный общий желчный проток и т. д.).
Попытка дифференцировать абдоминальную боль, используя наименьшее количество нередко травматичных для пациента обследований, можно хорошо проиллюстрировать на синдроме раздраженного кишечника (СРК). Несмотря на наличие в названии термина «синдром» — эта патология относится к самостоятельным нозологическим формам. Согласно определению World Gastroenterology Organization (WGO), СРК — функциональное расстройство кишечника, при котором абдоминальная боль или дискомфорт ассоциированы с дефекацией или изменением кишечного транзита [20]. Сопутствующими симптомами могут быть вздутие, урчание, нарушения расстройства дефекации. Для постановки данного диагноза согласно Римским критериям III боль должна носить рецидивирующий характер, присутствовать хотя бы три дня в месяц в течение последних трех месяцев или больше и сочетаться хотя бы с двумя из следующих трех признаков: изменяться после дефекации, ее возникновение должно ассоциироваться с изменением частоты или формы стула. Симптомы должны беспокоить пациента три последние месяца, а впервые возникнуть шесть и более месяцев назад [12]. Для СРК, как и для большинства других функциональных заболеваний ЖКТ, характерен повышенный уровень депрессии, тревоги, склонности к ипохондрии.
Абдоминальная боль при СРК присутствует обязательно, но в зависимости от преобладающих нарушений пассажа по кишечнику возможны следующие варианты: СРК с диареей (частота жидкого стула более 25% времени, а плотных каловых масс менее 25%, чаще у мужчин), СРК с запором (твердый стул более 25% времени и соответственно жидкий менее 25%, чаще страдают женщины), СРК смешанного или циклического характера (разжиженный и твердый кал более 25%) [12, 20]. Согласно рекомендациям WGO возможно подразделение на подгруппы в зависимости от того, какие именно симптомы доминируют: СРК с преобладанием нарушений пассажа по кишечнику, СРК с преобладанием боли, СРК с преобладанием вздутия. И, наконец, соответственно провоцирующему фактору, возможно подразделение патологии на СРК постинфекционный, СРК, индуцированный приемом пищи (или определенными пищевыми продуктами), СРК стресс-индуцируемая.
Алгоритм действий практического врача разработан WGO и опубликован в 2009 году (схема). При наличии типичных признаков у пациента в возрасте до 50 лет, отсутствии признаков тревоги, при низкой частоте паразитарных инфекций и целиакии в популяции и отсутствии диареи, при отсутствии изменений результатов обычных рутинных исследований (общий анализ крови) вероятность СРК у данного пациента настолько высока, что нет необходимости в проведении других обследований [20].
При наличии стойкого диарейного синдрома, высокой частоте целиакии или паразитарных заболеваний необходимо, соответственно, провести исследования на глютеновую энтеропатию, анализ кала для выявления паразитарных заболеваний и колоноскопию (при хроническом диарейном синдроме). При отсутствии отклонений от нормальных показателей диагноз СРК будет наиболее вероятен.
Хронический абдоминальный болевой синдром с нарушениями транзита по ЖКТ, характерный для СРК, имеет сходство с симптомами, возникающими при энтеропатиях (глютеновой, лактазной, паразитарной), колоректальном раке, микроскопическом, паразитарном колите, дивертикулите и некоторых гинекологических заболеваниях: эндометриозе, раке яичников. Связано это с единым висцеральным механизмом возникновения боли, к которому нередко присоединяется и иррадиирующий ее генез, что еще больше затрудняет определение локализации патологического процесса [17].
Купирование хронической абдоминальной боли является серьезной самостоятельной проблемой, поскольку не только устранение, но даже попытка установить основную причину ее возникновения не всегда удается. Учитывая, что часто боль носит сочетанный характер, приходится в реальной практике нередко пользоваться комбинацией различных средств.
Одним из подходов к купированию висцеральной боли является снятие мышечного спазма, который является универсальным механизмом гладкой мускулатуры реагировать на любые патологические воздействия, что неизбежно приводит к возбуждению ноцицепторов, расположенных в мышечном слое ЖКТ [1–4, 18].
Группа спазмолитических препаратов многообразна и довольно разнородна с точки зрения механизма действия и точки приложения, поскольку богатый рецепторный аппарат принимает участие в сокращении мышечного волокна, а также сам этот процесс сложный и многокомпонентный. Так, препараты, подавляющие сокращение мышечного волокна, могут реализовывать свое действие следующим образом:
Назначение каждого препарата должно быть обосновано с позиций эффективности и безопасности. Чем более селективен препарат, тем меньшее число системных побочных эффектов он имеет.
Из всех селективных спазмолитических препаратов дольше всего в Европе применяется антихолинергическое четвертичное аммониевое соединение гиоcцина бутилбромид (Бускопан). Впервые препарат был зарегистрирован в Германии в 1951 г., и в настоящее время он относится к одному из наиболее изученных в эксперименте и в клинике и селективных в отношении ЖКТ спазмолитических препаратов. Важнейшими фармакологическими свойствами гиоcцина бутилбромида является его двойной расслабляющий эффект путем селективного связывания с мускариновыми рецепторами, расположенными на висцеральных гладких мышцах ЖКТ, и парасимпатический эффект блокирования нервных узлов через связывание с никотиновыми рецепторами, что обеспечивает избирательность подавления моторики ЖКТ.
Гиосцина бутилбромид вследствие высокой аффинности к мускариновым и никотиновым рецепторам распределяется главным образом в мышечных клетках органов брюшной полости и малого таза, а также в интрамуральных ганглиях органов брюшной полости. Поскольку препарат не переходит гематоэнцефалический барьер, частота системных антихолинергических (атропиноподобных) побочных реакций при использовании гиоcцина бутилбромида очень низкая и подобна плацебо. Поэтому целесообразность применения данного препарата очевидна и доказана для купирования боли висцерального компонента любого происхождения [1, 3, 18, 19].
Время наступления эффекта при приеме Бускопана внутрь составляет примерно 30 мин; продолжительность действия — 2–6 ч. После однократного применения гиосцина бутилбромида внутрь в дозах 20–400 мг средние пиковые концентрации в плазме достигаются примерно через 2 часа. Период полувыведения препарата после однократного применения внутрь в дозах 100–400 мг колеблется от 6,2 до 10,6 часа. Рекомендуемая доза при приеме внутрь: 10–20 мг 3–5 раз в день. Существует также лекарственная форма Бускопана в ректальных суппозиториях.
Опубликованное в 2006 г. сравнительное плацебо- и парацетамол-контролируемое исследование эффективности и переносимости гиоcцина бутилбромида при лечении рецидивирующих спастических болей в животе, проведенное на базе 163 клинических центров под руководством таких известных гастроэнтерологов, как С. Мюллер-Лисснер и Г. Н. Титгат, включало 1935 пациентов. Оно показало высокую эффективность и безопасность гиосцина бутилбромида при рецидивирующих абдоминальных болях [14].
Доказательством спазмолитического эффекта гиосцина бутилбромида является улучшение результатов инструментального исследования кишки при эндоскопическом и рентгенологическом исследовании, что продемонстрировано как увеличением просвета кишки, так и визуализацией полипов, дивертикулов, а также меньшей выраженностью болевых ощущений при проведении манипуляций [11, 15].
Примером эффективного купирования абдоминальной боли спазмолитиками является их применение при СРК [12].
Метаанализ, проведенный T. Poynard с соавторами, продемонстрировал, что многие спазмолитические препараты по отдельности (мебеверин, циметропия бромид, тримебутин, отилония бромид, гиосцина бутилбромид, пинаверия бромид) и в целом вся группа спазмолитиков (OR 2,13; 95% ДИ 1,77–2,58) эффективнее, чем плацебо, в лечении боли при СРК [16]. Так, вероятность улучшения состояния при применении гиосцина бутилбромида в лечении СРК в 1,56 раза выше (95% ДИ 1,14–2,15), чем при плацебо. В ряде работ показано, что, помимо спазмолитического эффекта, хороший анальгетический эффект Бускопана может быть связан и со снижением порога висцеральной гиперчувствительности, играющей важную роль в патогенезе СРК [10].
Спазмолитиками с доказанной эффективностью в лечении СРК с точки зрения специальной American Gollege Gastroenterology (ACG) являются гиосцина бутилбромид, циметропия бромид, пинаверия бромид и масло перечной мяты. Эти препараты могут купировать боль или дискомфорт при СРК [5].
Спазмолитики не только купируют боль, но также способствуют восстановлению пассажа содержимого и улучшению кровоснабжения стенки органа. Их назначение не сопровождается непосредственным вмешательством в механизмы болевой чувствительности и не затрудняет диагностику острой хирургической патологии.
Безусловно, важное место в купировании боли не только париетального генеза, но и висцерального и психогенного отводится анальгетикам. Всемирной Организацией Здравоохранения предложен следующий поэтапный подход к купированию боли: 1-я ступень — неопиоидные анальгетики, 2-я ступень — добавляются мягкие опиоиды, 3-я ступень — опиоидные анальгетики. Среди неопиоидных анальгетиков предпочтительнее назначать парацетамол из-за меньшего числа побочных эффектов на ЖКТ. В ряде исследований показан хороший эффект для купирования боли при комбинации спазмолитика гиосцина бутилбромида с анальгетиком парацетамолом [13].
Иногда приходится и при функциональных заболеваниях, в частности при СРК, применять прямые анальгетики. Назначения опиатов необходимо всячески избегать, так как при таких хронических состояниях высок риск развития привыкания и зависимости. Такие случаи описаны в литературе и носят название «narcotic bowel syndrome» (кишечный синдром, вызванный наркотическими препаратами). К критериям этого состояния относится хроническая или часто рецидивирующая прогрессирующая со временем боль, которую нельзя объяснить конкретной патологией, для купирования которой требуются большие дозы наркотических препаратов, которая нарастает при отмене опиатов и быстро купируется при их применении [8, 9].
Эффект антидепрессантов потенцировать и усиливать анальгетический эффект других препаратов хорошо известен и доказан. Принимая во внимание наличие психогенного механизма боли при функциональных заболеваниях, выявляемые клинически психоэмоциональные особенности больных (склонность к депрессиям, высокий уровень тревоги), понятен интерес к психотропным препаратам при СРК. Недавно опубликованный системный обзор хотя и указывает на дефекты некоторых дизайнов исследований, представил доказательства в поддержку использования антидепрессантов (как трицикличных, так и селективных ингибиторов повторного захвата серотонина) при СРК (амитриптилин 10–75 мг/день на ночь; селективные ингибиторы повторного захвата серотонина: пароксетин, 10–60 мг/день, циталопрам, 5–20 мг/день) [6, 20].
Объяснение генеза симптомов и прежде всего абдоминальной боли с учетом уровня образования, социального статуса больного, установление доверительных сопереживающих отношений между врачом и пациентом приносит эффект в купировании симптомов [7].
Коррекцию питания с целью уменьшения боли и купирования других симптомов следует использовать с определенной осторожностью, чтобы не вызвать нутритивных проблем у пациента (дефицита микроэлементов, витаминов, других питательных ингредиентов).
Убедительной связи между абдоминальной болью и другими симптомами при СРК не существует. Применение средств, эффективных для купирования различных расстройств при СРК, не оказывало влияния на выраженность болевого синдрома. При наличии СРК с запорами применяются различные классы слабительных средств, клетчатка и другие объемформирующие препараты. Хорошая доказательная база существует в отношении осмотических слабительных (препаратов лактулозы, полиэтиленгликоля в индивидуальных дозировках). Для ускорения получения нормализующего эффекта на пассаж по ЖКТ при СРК с запорами короткими курсами можно назначать раздражающие слабительные (Дульколакс и др.). Для лечения СРК с запорами женщинам возможно применение селективного активатора С-2 хлоридных рецепторов — лубипростона [6]. Есть данные о целесообразности применения пробиотического штамма Bifidobacterium lactis DN-173 010 в целях ускорения транзита по кишечнику.
Основным препаратом для лечения СРК с диареей является лоперамид, требующий индивидуального подбора дозировки. При тяжелом диарейном синдроме у женщин в ряде стран зарегистрирован для применения антагонист серотонинергических рецепторв (5-НТ3)-алосетрон [6, 20]. Для уменьшения газообразования применяют сорбенты и другие пеногасители, а также в некоторых рекомендациях назван антибиотик рифаксимин (по 400 мг 3 раза в день).
Некоторое влияние на улучшение общего состояния и уменьшение болевого синдрома продемонстрировали антагонист серотонинергических рецепторов (5-НТ3)-алосетрон (при СРК с диарейным синдромом), селективный активатор С-2 хлоридных рецепторов — лубипростона (у женщин с запорами) и пробиотический штамм Bifidobacterium infantis 35624.
Для купирования боли и других симптомов при функциональной патологии, в частности при СРК, применяют разнообразные методы терапии, включая психологические: когнитивная/поведенческая терапия, релаксационные методы, гипноз. ACG утверждает, что психологические методы терапии, включающие когнитивную терапию, динамическую психотерапию и гипнотерапию более эффективны в купировании общих симптомов СРК, чем стандартные методы лечения. Отношение к фитотерапии и акупунктуре в целом на сегодняшний день оптимистично сдержанное.
На течение любой патологии и особенно СРК во многом оказывают влияние как личностные особенности пациента (отношение к лечению, уровень тревоги и степень доверия/недоверия к медицинским манипуляциям, наличие хронических психотравмирующих ситуаций, индивидуальные эмоциональные особенности, а также психические заболевания), так и поведение медицинского персонала (способность установления контакта и доверительных отношений, возможность психологической поддержки пациента). Важным моментом, всегда повышающим степень доверия пациента к доктору, является быстрое купирование болевого синдрома. Поэтому выбор препаратов должен быть сделан грамотно и своевременно.
Литература
Новосибирский ГМУ, Новосибирск
Абдоминальный болевой синдром: этиология, патогенез и вопросы терапии
По механизму возникновения боли в брюшной полости подразделяются на висцеральные, паристальные (соматические), отраженные (иррадиирующие) и психогенные Каковы причины абдоминального болевого синдрома? В чем заключается терапия абдоминального болевог
По механизму возникновения боли в брюшной полости подразделяются на висцеральные, паристальные (соматические), отраженные (иррадиирующие) и психогенные
Каковы причины абдоминального болевого синдрома?
В чем заключается терапия абдоминального болевого синдрома?
Абдоминальный болевой синдром является ведущим в клинике большинства заболеваний органов пищеварения. Боль — это спонтанное субъективное ощущение, возникающее вследствие поступления в центральную нервную систему патологических импульсов с периферии (в отличие от болезненности, которая определяется при обследовании, например, при пальпации). Тип боли, ее характер не всегда зависят от интенсивности инициальных стимулов. Органы брюшной полости обычно нечувствительны ко многим патологическим стимулам, которые при воздействии на кожу вызывают сильную боль. Разрыв, разрез или раздавливание внутренних органов не сопровождаются заметными ощущениями. В то же время растяжение и напряжение стенки полого органа раздражают болевые рецепторы. Так, натяжение брюшины (опухоли), растяжение полого органа (например, желчная колика) или чрезмерное сокращение мышц вызывают абдоминальные боли. Болевые рецепторы полых органов брюшной полости (пищевод, желудок, кишечник, желчный пузырь, желчные и панкреатические протоки) локализуются в мышечной оболочке их стенок. Аналогичные рецепторы имеются в капсуле паренхиматозных органов, таких как печень, почки, селезенка, и их растяжение также сопровождается болью. Брыжейка и париетальная брюшина чувствительны к болевым стимулам, в то время как висцеральная брюшина и большой сальник лишены болевой чувствительности.
Абдоминальные боли подразделяются на острые, которые развиваются, как правило, быстро или, реже, постепенно и имеют небольшую продолжительность (минуты, редко несколько часов), а также хронические, для которых характерно постепенное нарастание. Эти боли сохраняются или рецидивируют на протяжении недель и месяцев. Этиологическая классификация абдоминальных болей представлена в табл. 1.
По механизму возникновения боли в брюшной полости подразделяются на висцеральные, париетальные (соматические), отраженные (иррадиирующие) и психогенные.
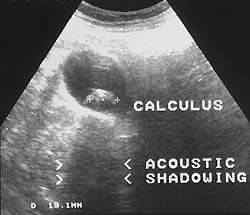 |
| Рисунок 1. Причиной абдоминальной боли может быть калькулезный холецистит (УЗИ) |
Висцеральная боль возникает при наличии патологических стимулов во внутренних органах и проводится симпатическими волокнами. Основными импульсами для ее возникновения являются внезапное повышение давления в полом органе и растяжение его стенки (наиболее частая причина), растяжение капсулы паренхиматозных органов, натяжение брыжейки, сосудистые нарушения.
Соматическая боль обусловлена наличием патологических процессов в париетальной брюшине и тканях, имеющих окончания чувствительных спинномозговых нервов.
Основными импульсами для ее возникновения являются повреждение брюшной стенки и брюшины.
Дифференциально-диагностические признаки висцеральной и соматической боли представлены в табл. 2.
Иррадиирующая боль локализуется в различных областях, удаленных от патологического очага. Она возникает в тех случаях, если импульс висцеральной боли чрезмерно интенсивен (например, прохождение камня) или при анатомическом повреждении органа (например, ущемление кишки). Иррадиирующая боль передается на участки поверхности тела, которые имеют общую корешковую иннервацию с пораженным органом брюшной области. Так, например, при повышении давления в кишечнике вначале возникает висцеральная боль, которая затем иррадиируют в спину, при билиарной колике — в спину, в правую лопатку или плечо.
Психогенная боль возникает при отсутствии периферического воздействия либо когда последнее играет роль пускового или предрасполагающего фактора. Особая роль в ее возникновении принадлежит депрессии. Последняя часто протекает скрыто и не осознается самими пациентами. Тесная связь депрессии с хронической абдоминальной болью объясняется общими биохимическими процессами и, в первую очередь, недостаточностью моноаминергических (серотонинергических) механизмов. Это подтверждается высокой эффективностью антидепрессантов, особенно ингибиторов обратного захвата серотонина, в лечении болевого синдрома. Характер психогенных болей определяется особенностями личности, влиянием эмоциональных, когнитивных, социальных факторов, психологической стабильностью больного и его прошлым «болевым опытом». Основными признаками данных болей являются их длительность, монотонность, диффузный характер и сочетание с другими локализациями (головная боль, боль в спине, во всем теле). Нередко психогенные боли могут сочетаться с другими, указанными выше типами болей и оставаться после их купирования, существенно трансформируя их характер, что необходимо учитывать при терапии.
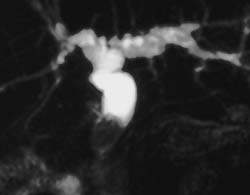 |
| Рисунок 2. Камень в общем желчном протоке у пациента после холецистэктомии (МРТ) |
Одной из разновидностей болей центрального генеза является абдоминальная мигрень. Последняя чаще встречается в молодом возрасте, носит интенсивный разлитой характер, но может быть локальной в параумбиликальной области. Характерны сопутствующие тошнота, рвота, понос и вегетативные расстройства (побледнение и похолодание конечностей, нарушения ритма сердца, артериального давления и др.), а также мигренозная цефалгия и характерные для нее провоцирующие и сопровождающие факторы. Во время пароксизма отмечается увеличение скорости линейного кровотока в брюшной аорте. Наиболее важными механизмами контроля болевого синдрома являются эндогенные опиатные системы. Опиатные рецепторы локализуются в окончаниях чувствительных нервов, в нейронах спинного мозга, в стволовых ядрах, в таламусе и лимбических структурах головного мозга. Связь данных рецепторов с рядом нейропептидов, таких как эндорфины и энкефалины, обусловливает морфиноподобный эффект. Опиатная система работает по следующей схеме: активация чувствительных окончаний приводит к выделению субстанции Р, что вызывает появление периферических восходящих и центральных нисходящих ноцицептивных (болевых) импульсов. Последние активизируют выработку эндорфинов и энкефалинов, которые блокируют выделение субстанции Р и снижают болевые ощущения.
Существенное значение в формировании болевого синдрома имеют серотонин и норадреналин. В структурах мозга находится большое количество серотонинергических и норадренергических рецепторов, а в состав нисходящих антиноцицептивных (противоболевых) структур входят серотонинергические и норадренергические волокна. Уменьшение уровня серотонина приводит к снижению болевого порога и усилению болей. Норадреналин опосредует увеличение активности антиноцицептивных систем.
Наличие болевого абдоминального синдрома требует углубленного обследования больного для уточнения механизмов его развития и выбора тактики лечения. Подавляющему большинству больных с наличием соматических болей, как правило, необходимо хирургическое лечение. Висцеральные боли, возникающие у больных как с наличием органических поражений органов пищеварения, так и без них, являются следствием нарушения, в первую очередь, моторной функции последних. В результате в полых органах повышается давление и/или наблюдается растяжение его стенки, и возникают условия для формирования восходящих ноцицептивных импульсов.
В регуляции транспорта ионов кальция участвуют ряд нейрогенных медиаторов: ацетилхолин, катехоламины (норадреналин), серотонин, холецистокинин, мотилин и др. Связывание ацетилхолина с М-холинорецепторами способствует открытию натриевых каналов и вхождению ионов натрия в клетку. Последнее снижает электрический потенциал клеточной мембраны (фаза деполяризации) и приводит к открытию кальциевых каналов, через которые ионы кальция поступают в клетку, вызывая мышечное сокращение.
Серотонин оказывает существенное влияние на моторику желудочно-кишечного тракта, активируя ряд рецепторов, локализирующихся на эффекторных клетках. Выделяют несколько подтипов рецепторов (5-МТ1-4), однако наиболее изучены 5-МТ3 и 5-МТ4. Связывание серотонина с 5-МТ3 способствует расслаблению, а с 5-МТ4 — сокращению мышечного волокна. В то же время механизмы действия серотонина на мышечные волокна желудочно-кишечного тракта до конца не установлены. Имеются лишь предположения о вовлечении в эти процессы ацетилхолина.
Тахикинины, в состав которых входят три типа пептидов (субстанция Р, нейрокинин А и В), связываясь с соответствующими рецепторами миоцитов, повышают их моторную активность не только в результате прямой активации, но и вследствие выделения ацетилхолина. Определенную роль в регуляции моторной функции кишечника играют эндогенные опиаты. При связывании их с μ- и δ-опиоидными рецепторами миоцитов происходит стимуляция, а с κ-рецепторами — замедление моторики пищеварительного тракта.
Основные направления купирования болевого абдоминального синдрома включают: а) этиологическое и патогенетическое лечение основного заболевания; б) нормализацию моторных расстройств; в) снижение висцеральной чувствительности; г) коррекцию механизмов восприятия болей.
Нарушения двигательной функции органов желудочно-кишечного тракта играют значительную роль в формировании не только болевого синдрома, но и большинства диспепсических расстройств (чувство переполнения в желудке, отрыжка, изжога, тошнота, рвота, метеоризм, поносы, запоры). Большинство из указанных выше симптомов могут иметь место как при гипокинетическом, так и при гиперкинетическом типе дискинезии, и только углубленное исследование позволяет уточнить их характер и выбрать адекватную терапию.
Одним из наиболее частых функциональных нарушений, в том числе и с наличием органической патологии органов пищеварения, является спастическая (гиперкинетическая) дискинезия. Так, при спастической дискинезии любого отдела пищеварительного тракта наблюдается повышение внутрипросветного давления и нарушение продвижения содержимого по полому органу, что создает предпосылки для возникновения боли. При этом скорость нарастания давления в органе пропорциональна интенсивности боли.
Спастическая дискинезия мышечной оболочки стенки полого органа или сфинктеров представляет собой наиболее частый механизм развития болевого синдрома при эзофагоспазме, дисфункции сфинктера Одди и пузырного протока, синдроме раздраженного кишечника.
В настоящее время для купирования болевого синдрома в комплексном лечении вышеуказанных заболеваний используются релаксанты гладкой мускулатуры, которые включают несколько групп препаратов. Антихолинергические средства снижают концентрацию интрацеллюлярных ионов кальция, что приводит к мышечной релаксации. Важно отметить, что степень релаксации находится в прямой зависимости от предшествующего тонуса парасимпатической нервной системы. Последнее обстоятельство определяет существенные различия индивидуальной эффективности препаратов данной группы. В качестве спазмолитиков используют как неселективные (препараты красавки, метацин, платифиллин, бускопан и др.), так и селективные М1-холиноблокаторы (гастроцепин и др.). Однако довольно низкая эффективность и широкий спектр побочных эффектов ограничивают их применение для купирования болевого синдрома у значительной части больных.
Механизм действия миотропных спазмолитиков в конечном итоге сводится к накоплению в клетке цАМФ и уменьшению концентрации ионов кальция, что тормозит соединение актина с миозином. Эти эффекты могут достигаться ингибированием фосфодиэстеразы, или активацией аденилатциклазы, или блокадой аденозиновых рецепторов, либо их комбинацией. Основными представителями данной группы препаратов являются дротаверин (но-шпа, но-шпа форте, спазмол), бенциклан (галидор), отилония бромида (спазмомен), метеоспазмил и др. При использовании миогенных спазмолитиков, так же как и М-холиноблокаторов, необходимо учитывать существенные индивидуальные различия их эффективности, отсутствие селективности эффектов (действуют практически на всю гладкую мускулатуру, включая мочевыделительную систему, кровеносные сосуды и др.), развитие гипомоторной дискинезии и гипотонии сфинктерного аппарата пищеварительного тракта, особенно при длительном применении. Данные препараты используются кратковременно (от однократного приема до двух-трех недель) для купирования спазма, а следовательно, болевого синдрома.
В ряду миотропных спазмолитиков следует отметить препарат мебеверин (дюспатолин), механизм действия которого сводится к блокаде быстрых натриевых каналов клеточной мембраны миоцита, что нарушает поступление натрия в клетку, замедляет процессы деполяризации и блокирует вход кальция в клетку через медленные каналы. В результате прекращается фосфорилирование миозина и отсутствует сокращение мышечного волокна. Известно также, что выход ионов кальция из внутриклеточных депо в результате активации α1-адренорецепторов приводит к открытию калиевых каналов, выходу ионов калия из клетки, гиперполяризации и отсутствию мышечного сокращения, что может становиться в течение длительного времени причиной мышечной гипотонии. В отличие от других миотропных спазмолитиков мебеверин препятствует пополнению внутриклеточных кальциевых депо, что в конечном итоге приводит лишь к кратковременному выходу ионов калия из клетки и ее гипополяризации. Последняя предупреждает развитие постоянного расслабления или гипотонии мышечной клетки. Следовательно, назначение мебеверина (дюспатолина) приводит только к снятию спазма без развития гипотонии гладкой мускулатуры, т. е. не нарушает моторики желудочно-кишечного тракта. Препарат оказался эффективным для купирования абдоминальных болей и дискомфорта, нарушений стула, обусловленных синдромом раздраженного кишечника, а также возникающих на фоне органических заболеваний.
Среди миотропных спазмолитиков также обращает на себя внимание препарат гимекромон (одестон). Одестон (7-гидрокси-4-метилкумарин) оказывает избирательное спазмолитическое действие на сфинктер Одди и сфинктер желчного пузыря, обеспечивает отток желчи в двенадцатиперстную кишку, снижает давление в билиарной системе и, как следствие, купирует билиарный болевой синдром. Одестон не обладает прямым желчегонным действием, но облегчает приток желчи в пищеварительный тракт, тем самым усиливая энтерогепатическую рециркуляцию желчных кислот, которые участвуют в первой фазе образования желчи. Преимущество одестона по сравнению с другими спазмолитиками заключается в том, что он практически не оказывает влияния на другие гладкие мышцы, в частности, кровеносной системы и кишечной мускулатуры.
Чрезвычайно перспективным направлением в лечении моторных расстройств является использование селективных блокаторов кальциевых каналов. В настоящее время из этой группы широкое распространение получил пинавериум бромид (дицетел). Дицетел блокирует потенциалзависимые кальциевые каналы миоцитов кишечника, резко снижает поступление в клетку экстрацеллюлярных ионов кальция и тем самым предотвращает мышечное сокращение. К числу достоинств дицетела относятся местное (внутрикишечное) действие препарата, тканевая селективность, отсутствие побочных, в т. ч. и кардиоваскулярных эффектов. Препарат можно применять в течение длительного времени, не опасаясь развития гипотонии кишечника. Клинические исследования показали высокую эффективность дицетела в лечении синдрома раздраженного кишечника и других заболеваний, при которых наблюдается спастическая дискинезия толстой кишки.
В купировании болевого синдрома особая роль отводится препаратам, влияющим на висцеральную чувствительность и механизмы восприятия болей. Это касается, в первую очередь, больных с функциональными заболеваниями желудочно-кишечного тракта (функциональная диспепсия, синдром раздраженного кишечника, функциональные абдоминальные боли и др.) и психогенными абдоминальными болями.
В настоящее время широко обсуждается возможность использования антидепрессантов, антагонистов 5-НТ3, агонистов κ-опиоидных рецепторов, аналогов соматостатина (октреотида). Из них лучше всего изучены антидепрессанты, реализующие противоболевой эффект двумя путями: 1) за счет уменьшения депрессивной симптоматики, учитывая тот факт, что хроническая боль может быть маской депрессии; 2) за счет активации антиноцицептивных серотонинергических и норадренергических систем. Антидепрессанты назначаются в терапевтических (но не в низких) дозах (амитриптилин 50-75 мг/сут., миансерин 30-60 мг/сут. и т. д.), продолжительность их приема должна составлять не менее 4-6 недель. Препараты эффективны в комплексной терапии.
Таким образом, генез абдоминальных болей является полиэтиологическим и полипатогенетическим. Лечение болевого синдрома должно быть направлено на нормализацию структурных и функциональных нарушений пораженного органа, а также на нормализацию функций нервной системы, отвечающих за восприятие болей.
Литература.
1. Вегетативные расстройства. Руководство для врачей. Под ред. проф. А.М. Вейна. М., 1998.
2. Вейн А. М., Данилова А. Б. Кардиалгии и абдоминалгии // РМЖ, 1999. 7, № 9. С. 428-32.
3. Григорьев П. Я., Яковенко А. В. Клиническая гастроэнтерология. М.: Медицинское информационное агентство, 2001. С. 704.
4. Ивашкин В. Т. Синдром раздраженной кишки // Рос. журн. гастроэнтерол., гепатол., колопроктол. 1993, т. 2, № 3. С. 27-31.
5. Яковенко Э. П. Григорьев П. Я. Хронические заболевания внепеченочных желчевыводящих путей. Диагностика и лечение. Метод. пособие для врачей. М.: Медпрактика, 2000. С. 31.
Таблица 1. Этиология абдоминальных болей
Интраабдоминальные причины
Экстраабдоминальные причины
Примечание. Частота заболеваний в рубриках указана в убывающем порядке.