Что такое 3h 2h2o 5o2
Пероксид водорода
| Пероксид водорода | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Пероксид водорода |
| Химическая формула | H2O2 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Отн. молек. масса | 34,01 а. е. м. |
| Молярная масса | 34,01 г/моль |
| Плотность | 1.4 г/см³ |
| Термические свойства | |
| Температура плавления | −0,432 °C |
| Температура кипения | 150,2 °C |
| Энтальпия образования (ст. усл.) | -136.11 кДж/моль |
| Химические свойства | |
| pKa | 11.65 |
| Растворимость в воде | неограниченная |
| Классификация | |
| Рег. номер CAS | 7722-84-1 |
| SMILES | OO |
| Регистрационный номер EC | 231-765-0 |
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2•2H2O.
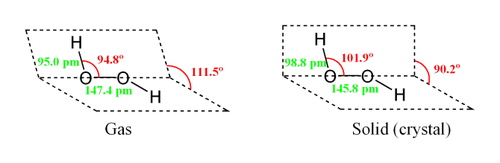
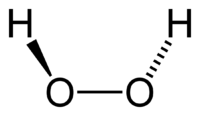
Молекула пероксида водорода имеет следующее строение:
Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7·10 −29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Содержание
Химические свойства
Оба атома кислорода находятся в промежуточной степени окисления −1, что и обуславливает способность пероксидов выступать как в роли окислителей, так и восстановителей. Наиболее характерны для них окислительные свойства:

При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до кислорода:
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже не устойчив и самопроизвольно диспропорционирует на H2O и O2.Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4·10 −12 ), и поэтому диссоциирует по двум ступеням:
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):

Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:
В реакции с нитритом калия соединение служит окислителем:
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5 и пероксидисерная H2S2O8 кислоты.
Окислительно-восстановительные свойства
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например:
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства
Перекись водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако, несколько ферментных систем (ксантиноксидаза, НАД(Ф)H-оксидаза, циклоксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в перекись водорода.
Получение
Пероксид водорода получают в промышленности при реакции с участием органических веществ, в частности, каталитическим окислением изопропилового спирта:
Ценным побочным продуктом этой реакции является ацетон.
В промышленных масштабах пероксид водорода получают электролизом серной кислоты, в ходе которого образуется надсерная кислота, и последующим разложением последней до пероксида и серной кислоты.
В лабораторных условиях для получения пероксида водорода используют реакцию:
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов.
Хотя разбавленные растворы перекиси водорода применяется для небольших поверхностных ран, исследования показали что этот метод обеспечивая антисептический эффект и очищение и удлиняет время заживления. [1] [2] Обладая хорошими очищающими свойствами, перекись водорода на самом деле не ускоряет заживление ран. Достаточно высокие концентрации, обеспечивающие антисептический эффект, могут также удлинять время заживления из-за повреждения прилегающих к ране клеток. [3] Более того, перекись водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи. [4] Однако, в качестве средства для очистки глубоких ран сложного профиля, гнойных затеков, флегмон, и других гнойных ран санация которых затруднена, перикись водорода остается препаратом выбора. Так как она обладает не только антисептическим эффектом, но и продуцирует большое количество пены, при взаимодействии с ферментом пероксидазой. Что в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые буду легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки перекисью водорода, антисептический раствор не сможет удалить данные патологические образования, что приведет значительному увеличению времени заживления раны, и ухудшит состояние больного.
В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
В быту применяется также для выведения пятен MnO2, получившихся при взаимодействии перманганата калия «марганцовки» с предметами (ввиду его окислительных свойств).
Пероксид водорода в аквариумистике
3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме (гидры, планарии, паразиты, водоросли, бактерии и др.)
Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 1-6 %, 30, 38, 50, 60, 85, 90 и 98 %. 30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем.
Опасность применения
Несмотря на то, что пероксид водорода не токсичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен. Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей. Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл. [7]
Пероксид водорода
| Пероксид водорода | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Пероксид водорода |
| Химическая формула | H2O2 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Отн. молек. масса | 34,01 а. е. м. |
| Молярная масса | 34,01 г/моль |
| Плотность | 1.4 г/см³ |
| Термические свойства | |
| Температура плавления | −0,432 °C |
| Температура кипения | 150,2 °C |
| Энтальпия образования (ст. усл.) | -136.11 кДж/моль |
| Химические свойства | |
| pKa | 11.65 |
| Растворимость в воде | неограниченная |
| Классификация | |
| Рег. номер CAS | 7722-84-1 |
| SMILES | OO |
| Регистрационный номер EC | 231-765-0 |
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2•2H2O.
Молекула пероксида водорода имеет следующее строение:
Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7·10 −29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Содержание
Химические свойства
Оба атома кислорода находятся в промежуточной степени окисления −1, что и обуславливает способность пероксидов выступать как в роли окислителей, так и восстановителей. Наиболее характерны для них окислительные свойства:

При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до кислорода:
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже не устойчив и самопроизвольно диспропорционирует на H2O и O2.Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4·10 −12 ), и поэтому диссоциирует по двум ступеням:
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):

Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:
В реакции с нитритом калия соединение служит окислителем:
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5 и пероксидисерная H2S2O8 кислоты.
Окислительно-восстановительные свойства
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например:
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства
Перекись водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако, несколько ферментных систем (ксантиноксидаза, НАД(Ф)H-оксидаза, циклоксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в перекись водорода.
Получение
Пероксид водорода получают в промышленности при реакции с участием органических веществ, в частности, каталитическим окислением изопропилового спирта:
Ценным побочным продуктом этой реакции является ацетон.
В промышленных масштабах пероксид водорода получают электролизом серной кислоты, в ходе которого образуется надсерная кислота, и последующим разложением последней до пероксида и серной кислоты.
В лабораторных условиях для получения пероксида водорода используют реакцию:
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов.
Хотя разбавленные растворы перекиси водорода применяется для небольших поверхностных ран, исследования показали что этот метод обеспечивая антисептический эффект и очищение и удлиняет время заживления. [1] [2] Обладая хорошими очищающими свойствами, перекись водорода на самом деле не ускоряет заживление ран. Достаточно высокие концентрации, обеспечивающие антисептический эффект, могут также удлинять время заживления из-за повреждения прилегающих к ране клеток. [3] Более того, перекись водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи. [4] Однако, в качестве средства для очистки глубоких ран сложного профиля, гнойных затеков, флегмон, и других гнойных ран санация которых затруднена, перикись водорода остается препаратом выбора. Так как она обладает не только антисептическим эффектом, но и продуцирует большое количество пены, при взаимодействии с ферментом пероксидазой. Что в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые буду легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки перекисью водорода, антисептический раствор не сможет удалить данные патологические образования, что приведет значительному увеличению времени заживления раны, и ухудшит состояние больного.
В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
В быту применяется также для выведения пятен MnO2, получившихся при взаимодействии перманганата калия «марганцовки» с предметами (ввиду его окислительных свойств).
Пероксид водорода в аквариумистике
3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме (гидры, планарии, паразиты, водоросли, бактерии и др.)
Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 1-6 %, 30, 38, 50, 60, 85, 90 и 98 %. 30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем.
Опасность применения
Несмотря на то, что пероксид водорода не токсичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен. Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей. Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл. [7]