Что стимулирует образование лимфоцитов
Иммунная система Часть 4 Лимфоциты
Иммунная система Часть 4 Лимфоциты
В-лимфоциты
Развитие В-лимфоцитов происходит в костном мозге, после чего они покидают его и перемещаются в лимфатические узлы.
Зрелый В-лимфоцит выполняет роль антиген-презентирующей клетки и быть источником особых молекулярных веществ для регуляции иммунного ответа. Однако его основная задача вырабатывать антитела.
Для этого необходим контакт с антигеном и несколько дней для превращения В-лимфоцита в плазматическую клетку. В начале образующие антитела представлены иммуноглобулинами класса М IgM. После воздействия особых молекул из Т-лимфoцитов в плазматических клетках синтез антител переключается на классы IgG, IgA или IgE. Помня о встрече с антигеном, В-лимфоциты превращаются в клетки памяти.
При повторной встрече с антигеном, клетки памяти быстро преобразуются в плазматические клетки и сразу секретируют большое количество АТ. А Т-лимфоциты, сохранившие свою память, переключают В-клетки на образование более сильных IgG. Повторная встреча с антигеном нередко протекает незаметно для организма, так быстро и эффективно развивается иммунный ответ.
Т-лимфоциты
Родившись из стволовой клетки костного мозга, предшественники Т-лимфоцитов переходят в тимус, где подвергаются строгому отбору и сортировке. Существует несколько типов Т-лимфоцитов, выполняющих разные функции. Им принадлежит ключевая роль в формировании клеточного или гуморального ответа. Направление иммунитета во многом зависит от особых молекул, которые выделяют антиген-презентирующие клетки.
Тип и подтип Т-лимфоцитов
Способствуют формированию приобретенного иммунитета.
Th1-клетки (Т-хелперы 1 типа)
Активируют фагоцитирующие клетки и клетки-киллеры, выделяют ИФН-гамма, ИЛ-2, ФНО-альфа. Обуславливают приобретенный клеточный иммунный ответ, направленный на внутриклеточные патогены (вирусы), способствуют воспалительной реакции.
Th2-клетки (Т-хелперы 2 типа)
Активно участвуют в выработке антител В-лимфоцитами, выделяют ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10, ИЛ-13. Обуславливают формирование приобретенного гуморального иммунного ответа, участвуют в противопаразитарном и аллергическом иммунном ответе.
Th17-клетки (Т-хелперы 17 типа)
Производят ИЛ-17, ИЛ-21, ИЛ-22, участвуют в аутоиммунных процессах, в борьбе с внеклеточными бактериями и грибами.
Th0-клетки (Нулевые Т-хелперы)
Наивные клетки, которые должны определиться с выбором. Под действием ИЛ-4, ИЛ-2 превращаются в Th2-клетки; Под действием ИЛ-12, ИФН-гамма в Th1-клетки; Под действием ИЛ-6, ТФР-бета в Th17-клетки.
Т- лимфоциты регуляторные супрессорные
Способствуют завершению иммунного ответа благодаря особым молекулам ТФР-бета, ИЛ-10, ИЛ-13 и другим, подавляющим иммунную реакцию.
Т-лимфоциты цитотоксические и Естественные Т-клетки-киллеры
Необходимы для уничтожения внутриклеточных патогенов, в частности, вирусов. Секретируют ИЛ-4 и ИФН-гамма, регулируют иммунный ответ.
Иммунных клеток гораздо больше, чем мы рассмотрели, они все несут разную функцию, их работа тесно переплетена. Многие иммунные клетки способны вырабатывать особые молекулы, которые регулируют острое воспаление и иммунный ответ.
Выберите город
Годовой абонемент
Годовой абонемент входит в состав первого заказа и дает возможность год Вам и членам Вашей семьи сдавать анализы в два раза дешевле. Результаты всех анализов бессрочно будут храниться в личном кабинете. Подробнее
Наивные Т-клетки — ключ к долголетию
Наивные Т-клетки — ключ к долголетию
Автор
Редактор
Статья на конкурс «био/мол/текст»: Наивные Т-лимфоциты могут поведать о том, что вы хотели бы скрыть. Впервые было осуществлено секвенирование профиля Т-клеточных рецепторов периферической крови человека. Успехи в развитии технологий секвенирования нового поколения дают возможность проследить за динамикой колебаний численности и разнообразия наивных Т-клеток по мере старения организма. Вместе с этими знаниями появляется ответ на вопрос, почему женщины живут дольше мужчин, и приходит мысль о том, что увеличить продолжительность жизни можно, используя собственные Т-клетки. «Иммунологические часы» несложно обмануть, пойдя на хитрость.
Обратите внимание!
Эта работа опубликована в номинации «лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Всегда ли можно дать сорокалетнему мужчине его сорок? А пятидесятилетнему? А скольким тридцатилетним женщинам вы бы не дали двадцати? Определять возраст человека по внешней составляющей не самая лёгкая задача. Однако, людям, перешагнувшим определённый порог, различный для мужчин и женщин, когда репродуктивная функция начинает стремительно угасать, становится сложнее скрывать свой возраст.
Для внутренних процессов человеческого организма характерны совершенно иные темпы изменений. «Возрастной порог» нашей иммунной системы расположен гораздо ближе к детству, чем к старости. Уже с первого года жизни в тимусе ребёнка начинают происходить драматические изменения: функциональная ткань органа заменяется на соединительную, уменьшаясь каждый год на 3% до 35–45 лет, а после 45 — на 1% (рис. 1). В 70 лет соединительная ткань занимает 90% тимуса [1]. Наиболее активно тимус функционирует в пренатальный период и до наступления половой зрелости. За это время происходит наработка максимальных возможностей Т-клеточного иммунитета, что будет во многом определять эффективность иммунного ответа человека на протяжении всей его жизни.
Рисунок 1. Сравнение размеров тимуса у новорождённого (а) и взрослого (б). К 50 годам тимус уменьшается в 5-7 раз по сравнению с первоначальным размером. Рисунок с сайта my.bpcc.edu.
Тимус — военная база иммунной системы
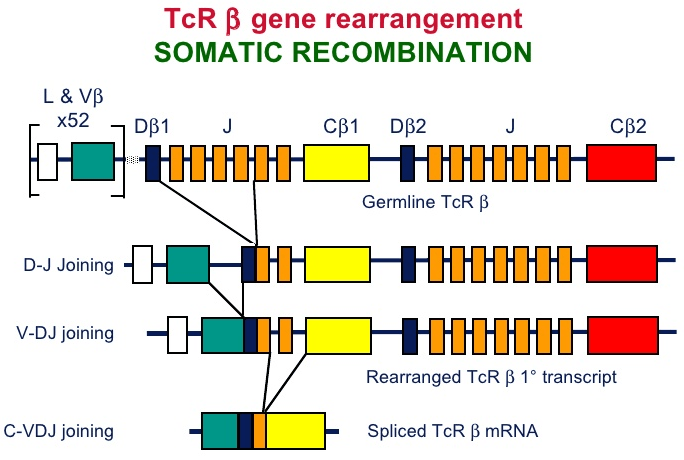
В тимусе иммунная система обучает своих «солдат». Предшественники Т-лимфоцитов размножаются в костном мозге и с кровью попадают в тимус. В нём происходит ключевое событие в жизни Т-клеток, определяющее их специфичность к антигену, с которым они никогда ещё не встречались — соматическая рекомбинация (также V(D)J-рекомбинация, рис. 2). Она заключается в перетасовке участков генов, кодирующих гипервариабельные участки α и β цепей Т-клеточного рецептора (TCR). С помощью TCR Т-клетки распознают «свой» антиген, к которому они специфичны, в составе главного комплекса гистосовместимости (MHC) антиген-презентирующих клеток (рис. 3). Благодаря этому процессу создаётся гигантское разнообразие TCR — около 6 × 10 5 возможных вариантов на каждые 10 6 Т-клеток [2]. В силу такой огромной вариабельности Т-клеточных рецепторов существует высокая вероятность того, что при проникновении в организм какого-либо чужеродного агента найдётся Т-клетка, TCR которой окажется специфичным именно ему. Соматическая рекомбинация происходит в кортикальной части тимуса, из неё клетки мигрируют в медуллярную часть и претерпевают негативный отбор: в экземплярах, реагирующих на собственные антигены, экспрессируемые организмом, запускается апоптоз.
Рисунок 2. Соматическая рекомбинация на примере β цепи TCR. Исходная последовательность в гене, кодирующем β цепь TCR содержит V (variable), D (diversity), J (Joining) и C (constant) сегменты. Сначала один из двух D-сегментов соединятеся с одним из 13 J-сегментов. Получившийся DJ-сегмент присоединяется к одному из 50 V-сегментов. Сегменты выбираются случайным образом, и механизм их сшивки также предполагает случайное варьирование количества пар оснований, это обеспечивает разнообразие TCR. Аналогичный процесс происходит c последовательностью, кодирующей α-цепь только без D-сегмента. Рисунок с сайта Slideshare.
Рисунок 3. Взаимодействие TCR и антиген-презентирующей клетки. а — Т-клетка (фиолетовая) взаимодействует с антиген-презентирующей клеткой (APC, синяя). б — APC презентирует антиген в составе MHC. Гетеродимер TCR состоит из α и β цепей, охватывающих MHC с антигеном. С антигеном главным образом взаимодействуют области CDR3 — это домены, отвечающие за специфичность TCR к данному антигену. Рисунок с сайта Genomemedicine.
После наступления пубертатного периода производство тимусом наивных Т-клеток резко снижается и на протяжении всей взрослой жизни человека активность этого органа остаётся на самом базальном уровне. Чем это грозит? Созданное за такой короткий период огромное разнообразие TCR действительно обеспечивает эффективный иммунный ответ на большинство потенциальных угроз. Но это разнообразие остаётся константным только некоторое время.
Мы теряем наших бойцов!
По результатам последних исследований [2], доля наивных Т-клеток как в CD4 + (Т-хелперы) так и в CD8 + (Т-киллеры) субпопуляциях периферической крови человека линейно уменьшается с возрастом. В детстве она составляет 50–80% от всего Т-клеточного пула и уменьшается на 0,75% каждый год, к 70 годам она составляет одну четверть первоначального изобилия. Авторы исследования [2] создали новый подход к использованию технологии секвенирования нового поколения компании Illumina для получения наиболее точных индивидуальных профилей репертуара TCR у людей различных возрастных групп. Было показано, что разнообразие TCR в периферической крови человека коррелирует с процентным содержанием в ней наивных Т-клеток и почти линейно уменьшается с возрастом — примерно на 5 × 10 3 вариантов TCR в год. Наивные Т-клетки сосуществуют в крови с Т-клетками памяти, клоны которых образуются в результате пролиферации наивных Т-клеток, повстречавших «свой» антиген. Размножившиеся клоны с каждым годом занимают всё большую долю доступного для пролиферации пространства в крови, это отражается на численности наивных Т-клеток, так как общее количество Т-клеток в крови человека относительно стабильно.
* — Но не стоит забывать, что кроме популяций в периферической крови, у человека есть гораздо более мощная локальная армия Т-лимфоцитов «на местах»: «Т-лимфоциты: путешественники и домоседы» [4]. — Ред.
Общее разнообразие TCR определяется количеством редких клонов в пуле Т-клеток, поэтому отсутствие возрастных изменений в разнообразии наиболее многочисленных Т-клеточных клонов указывает на то, что клоны наивных Т-клеток теряются с возрастом. Это связано с тем, что клоны наивных Т-клеток обычно малочисленны, поэтому вероятность того, что ни одна клетка данного клона не сможет поделиться или погибнет в результате каких-то случайных событий гораздо выше, чем для клонов с большим числом клеток.
Старики с высоким разнообразием TCR
Другое объяснение явления увеличения разнообразия TCR после 70 лет заключается в том, что люди этой возрастной группы уже перешагнули определённый возрастной порог, пройдя в некотором смысле проверку на прочность — уникальный набор физиологических параметров, включая особенности иммунной системы, сделал их наиболее приспособленными среди всех особей популяции в данных условиях. Из этого можно заключить, что повышенное содержание наивных Т-клеток в субпопуляции CD4 + периферической крови человека коррелирует с долгожительством. Увеличение доли наивных Т-клеток в пуле CD4+, а значит и увеличение разнообразия TCR обеспечивает лучшую иммунорегуляторную функцию, что снижает общее воспаление, усиливающееся по мере старения организма из-за активации аутоиммунных процессов, увеличивает эффективность распознавания раковых клеток и обеспечивает более сбалансированный иммунный ответ [2].
Долгая, но бездетная жизнь
Рисунок 4. Придворные евнухи в Китае. Некоторые евнухи жили более ста лет. Рисунок с сайта Lacasamundo.
Исследование о придворных евнухах династии Чозунь в Корее 2012 года [6] показало, что продолжительность жизни евнухов составляла на 15–20 лет больше, чем продолжительность жизни мужчин с нормальной репродуктивной функцией, живущих в тех же условиях (рис. 4). Возможно, их продолжительность жизни увеличивалась именно благодаря отсутствию инволюции тимуса под влиянием половых гомонов, а следовательно благодаря большему разнообразию TCR наивных Т-клеток. В пользу этой гипотезы можно привести данные о том, что у женщин производство тимусом наивных Т-клеток происходит более эффективно, чем у мужчин, и уменьшение их содержания в периферической крови у женщин выражено в меньшей степени, чем у мужской части населения [7]. Возможно, лучшая работа иммунной системы у женщин связана с тем, что во время беременности иммунитет женщины необходимо «обуздать», сделав его толерантным к фактически чужеродному телу — плоду, что требует участия сложных регуляторных путей. Высокая точность регуляции иммунного ответа очень важна, так как ошибка приведёт к потере потомства. К этим рассуждениям можно прибавить и тот факт, что у женщин с наступлением менопаузы яичники перестают вырабатывать эстрогены, а у мужчин выработка половых гормонов не прекращается. Это объясняет большую продолжительность жизни у женщин, чем у мужчин, характерную для любых национальностей. В Европе и США женщины живут дольше мужчин на 4,5–5 лет, в России — на 13 [6].
Мальчик, которому сделают орхеэктомию (удаление яичек), может быть, и получит дополнительные 10–15 лет жизни, вместе с тем лишившись возможности иметь детей и получив набор других не совсем приятных последствий. Существуют менее радикальные решения, основанные на приёме определённых препаратов, способствующих восстановлению функции тимуса. Одно из таких веществ — грелин, этот гормон вырабатывается слизистой оболочкой желудка и вызывает чувство голода, действуя на центры гипоталамуса. Оказалось, что грелин участвует в Т-клеточном сигналлинге, способен снижать связанное с возрастными изменениями воспаление, способствует восстановлению структуры тимуса и стимуляции его функций. Ряд цитокинов и факторов роста (интерлейкины 7 и 22, фактор роста кератиноцитов) являются потенциальными кандидатами для решения проблемы восстановления функции тимуса у взрослых людей. Интерлейкины обеспечивают дифференцировку и выживание тимоцитов. Фактор роста кератиноцитов необходим для пролиферации и дифференцировки функциональных тканей тимуса, его использование вызывает пролиферацию тимоцитов и увеличивает размеры органа. Возможно также использование веществ, блокирующих выработку стероидных гормонов, таких как аналоги гонадотропин-релизинг гормона, например, люпрона. Люпрон действует на гипофиз, блокируя рецепторы к гонадотропин-релизинг гормону, из-за чего уменьшается выработка лютеинизирующего и фолликуло-стимулирующего гормонов, что ведёт к снижению продукции эстрогена и тестостерона. И всё же, все вышеперечисленные вещества имеют неоднозначное воздействие на организм, и пока ещё нет данных о долгосрочных последствиях их приёма, поэтому их назначают только в случае восстановления после химиотерапии или при ВИЧ-инфекции, когда стимуляция работы тимуса необходима для реконституции иммунной системы [1].
Хранение наивных Т-клеток — полезная инвестиция в будущее
Есть ли иной способ продлить мужскую жизнь? Авторов статьи [2] посетила смелая идея решения этой проблемы. Кроме того, что редко встречающиеся клоны наивных Т-клеток в результате случайных событий теряются с возрастом, они, как и все клетки организма, могут поделиться лишь ограниченное количество раз (примерно 50 — лимит Хейфлика), что обусловлено укорочением теломерных участков хромосом после каждой репликации ядерной ДНК, а делятся наивные Т-клетки раз в 1–2 года. Значит примерно к 70 годам основная часть Т-клеток выйдет из строя. Решение есть — можно запасать наивные Т-клетки! У молодых людей в возрасте до 15–20 лет, когда процессы формирования основного пула наивных Т-клеток уже заканчиваются, нужно брать образцы крови в таком объёме, чтобы количества наивных Т-клеток в них хватило для полного восстановления их пула уже в пожилом возрасте, и заморозить. Очень важно, чтобы забор произошёл именно в этот промежуток времени. Если брать кровь у более взрослых людей, количества циркулирующих наивных Т-клеток просто не хватит для полной реставрации их пула в будущем. Конечно же, такой подход будет эффективен и для женского пола. Эти образцы крови будут не только средством продления жизни, но ещё и подстраховкой в случае аутоиммунных заболеваний или рака, они помогут восстановить иммунную систему после химиотерапии. Создание подобных банков с замороженными образцами крови стало бы ключевым событием в становлении абсолютно новых подходов к лечению заболеваний иммунной системы. Например, СПИД можно было бы вылечить введением в здоровые размороженные Т-клетки заразившегося СПИДом мутации по гену мембранного рецептора CCR5 (CD195), люди с такой мутацией обладают природной резистентностью к ВИЧ [8], и их пересадкой больному, предварительно прошедшему курс химиотерапии.
Итоги
Как бы молодо не выглядел человек, параметры его иммунной системы будут объективно отражать возраст. Такие параметры как количество наивных Т-клеток и разнообразие TCR практически линейно снижаются по мере старения. Если вы являетесь счастливым обладателем повышенного разнообразия TCR, можете надеяться на несколько бонусных лет жизни. В будущем человечество ожидают новые дерзкие подходы к увеличению продолжительности жизни с использованием собственных наивных Т-лимфоцитов, собранных и замороженных много лет назад.
Т и В лимфоциты ( по материалам статьи R Luz Elena Cano and H. Damaris E. Lopera.)
Лимфоциты Т и В (клетки Т и В) участвуют в приобретенном или антиген-специфическом иммунном ответе, учитывая, что они являются единственными клетками в организме, способными распознавать и реагировать специфически на каждый антигенный эпитоп. Клетки В обладают способностью превращаться в плазматические клетки и отвечают за выработку антител (Abs). Таким образом, гуморальный иммунитет зависит от B-клеток, а клеточный иммунитет зависит от T-клеток. В настоящей заметке процессы онтогенеза суммированы для каждого типа лимфоцитов вместе с их основными характеристиками, различными субпопуляциями, описанными до настоящего времени, механизмами сигнализации, используемыми для их активации, и их основными функциями на основе иммунологического профиля, который они представляют.
Онтогенез
Процесс развития и созревания Т-клеток у млекопитающих начинается с гемопоэтических стволовых клеток (HSC) в печени плода, а затем в костном мозге, где HSC дифференцируются в мультипотентные предшественники. Подмножество мультипотентных предшественников инициирует транскрипцию генов 1 и 2, активирующих рекомбинацию (RAG 1 и RAG2), и становится мультипотентными предшественниками с лимфоидным праймером, а затем общими лимфоидными предшественниками (CLP). Лишь небольшое подмножество плюрипотентных клеток мигрирует в тимус и дифференцируется в ранние предшественники тимуса (ETP). Тимус не содержит самообновляющихся предшественников; и, следовательно, длительный тимопоэз зависит от набора предшественников, оседающих тимусом, на протяжении всей жизни человека. Эти предшественники должны войти в тимус, чтобы постепенно перепрограммироваться в полностью зрелые и функциональные Т-клетки. Различные этапы развития Т-клеток, координируются с миграцией развивающихся тимоцитов к специфическим нишам в тимусе, которые обеспечивают необходимые специфичные для стадии факторы, необходимые для дальнейшей дифференцировки.
CD4+ Т клетки
Если Т-клетка экспрессирует CD4, она превращается в Т-хелперную клетку (Th), которая выполняет двойную функцию: продуцирует цитокины и стимулирует В-клетки для генерации Abs. До недавнего времени были идентифицированы только четыре различных фенотипа: Th1, Th2, Th17 и T-регуляторные клетки (Treg), каждая из которых секретирует свой профиль цитокинов. Однако в последние несколько лет были обнаружены новые подмножества T-хелперов, такие как Th9, Th22 и фолликулярные хелперы (Tfh).
Среди всех подмножеств T-хелперных клеток Tfh экспрессирует TCR с наибольшим сродством к Ag и наибольшему количеству костимулирующих молекул, таких как ICOS и CD40L. Кроме того, они экспрессируют фактор транскрипции BCL-6 и цитокины, такие как IL-21, IL-4 и IL-10, которые индуцируют дифференцировку B-клеток и продукцию Ab.
Клиническая значимость этих клеток показана у пациентов с мутациями гена FOXP3, у которых развивается иммунодефицит, связанный с хромосомой X, которая проявляется плюриландландриальными и кишечными проявлениями, известными как IPEX. Эта аутоиммунная полиорганная болезнь требует трансплантации костного мозга в раннем детстве/
Цитотоксические T-клетки также высвобождают IFN-γ и TNF-α, которые важны для защиты от вирусных инфекций и для контроля пролиферации опухолевых клеток
Первые стадии развития B-клеток происходят в сложных микроокружениях, созданных стромальными клетками костного мозга, известными как «ниши», из которых происходят стимулы и факторы, необходимые для запуска ряда клеточных сигналов. Они, в свою очередь, активируют факторы транскрипции, которые индуцируют или репрессируют экспрессию различных генов-мишеней, которые модулируют выживание, пролиферацию и дифференцировку клеток. IL-7 имеет решающее значение для развития B-клеток и вырабатывается клетками стромы.
Во время дифференцировки В-клеток изначально происходит процесс рекомбинации генов, который кодирует сегменты V ( переменная ), D ( разнообразие ) и J ( соединение ) тяжелой цепи (цепь H) вместе с генами для сегменты V и J легкой цепи (цепь L) мембраносвязанного иммуноглобулина (mIg). Этот процесс рекомбинации инициируется комплексом белков RAG1-RAG2, которые генерируют разрыв двойной цепи ДНК между сегментами генов и специфическими сайтами узнавания, которые также известны как « сигнальные последовательности рекомбинации ». Этот процесс приводит к генерации B-клеток, которые экспрессируют широкий репертуар mIg. Это формирует B-клеточный рецептор (BCR), который способен распознавать более 5 × 1013 разных Аг.
Сигнальные механизмы
Передача сигналов, создаваемая сигналосомой, активирует множество сигнальных каскадов, которые участвуют в других киназах, GTPases и факторах транскрипции, таких как NF-kB, Bcl6, NF-AT, FoxO, Jun и ATF-2 и т. д.
Активация всех этих механизмов приводит к изменениям клеточного метаболизма, экспрессии генов и организации цитоскелета клетки. Результат ответа определяется различными факторами или условиями, такими как: состояние созревания B-клеток, природа Ag, величина и длительность передачи сигналов через BCR и сигналы других рецепторов, таких как CD40, рецептор IL-21 и BAFF-R. Таким образом, многие другие трансмембранные белки, такие как CD45, CD19, CD22, PIR-B и Fc γRIIB1 (CD32), модулируют специфические элементы сигнальной BCR. Во время естественныхпроцессы, B-клетки также активируются APC, которые захватывают и представляют антигенные фракции на своих клеточных поверхностях. Этот тип активации B-клеток такими Ags, ассоциированными с клеточной мембраной, также требует реорганизации цитоскелета B-клеток. Таким образом, следует ожидать, что сложность передачи сигналов, опосредованной BCR, позволяет осуществлять разнообразные биологические эффекты, включая выживание, толерантность или апоптоз клеток, а также пролиферацию и дифференцировку в продуцирующих Ab клетках или B-клетках памяти.
Ко-рецепторы BCR
Костимулирующие молекулы
Другим важным аспектом в активации B-клеток является присутствие молекул, которые положительно или отрицательно регулируют процесс. Вместе они известны как костимулирующие молекулы, и некоторые из них описаны следующим образом.
Молекулы адгезии
Зрелые B-клетки можно разделить на несколько подмножеств в зависимости от их местоположения, фенотипа клеточной поверхности, Ag-специфичности и путей активации.
Фолликулярные B-клетки (FoB) или B-2. Они генерируются непосредственно в костном мозге и достигают фолликулы вторичных лимфоидных органов и кровообращения. Они считаются покоящимися (наивными) клетками и составляют наибольшую субпопуляцию В-клеток. На их дифференциацию влияют самые разные факторы, включая хемокины, передачу сигналов BCR и некоторые Ags. Они участвуют в T-зависимых (TD) иммунных реакциях, поскольку они могут использовать BCR для поглощения Ag, обработки его и представления его специфичным для Ag T-клеткам).
B1 B Клетки. Это первые B-клетки, которые сформировались в печени плода. Они подразделяются на B1a и B1b с первым, экспрессирующим гликопротеин мембраны CD5, который отсутствует во втором. Оба экспрессирующих маркера CD9 и CD45RA участвуют в иммунных реакциях типа TI, обнаруживаются в брюшной и плевральной полостях и являются основным источником циркулирующего Abs. Как и в случае с MZB, B-1 быстро реагирует на специфические для Ag стимулы и трансформируется в плазматические клетки. Наблюдалось увеличение их числа в экспериментальных исследованиях и у людей с аутоиммунными заболеваниями.
Плазматические или Ab-секреторные клетки. Они отличаются от активированной B-клетки, которая в присутствии IL-2 и IL-10 перестает экспрессировать поверхностные молекулы, такие как молекулы CD19, CD20, CD22, HLA класса II и их BCR. Эти клетки также теряют способность делиться. В то же время они претерпевают ряд клеточных модификаций, например, увеличение их цитоплазмы из-за усиленного роста эндоплазматического ретикулума, который необходим для того, чтобы содержать большое количество рибосом для надежной продукции Abs. Они также перестают экспрессировать CXCR5 и CXCR7 и увеличивают CXCR4, что приводит к потере контакта с DC и заставляет клетки T FH мигрировать из GC в медуллярные шнуры ганглиев.
В целом, мы можем сказать, что эти врожденные иммунные клетки могут стимулировать и помогать ответу Abs на процессы как TD, так и TI. Для первых, эти клетки используют вспомогательные сигналы для B-клеток в GC и в центральных лимфоидных участках, таких как костный мозг. Вдобавок к этому ответы типа TTI имеют место на поверхности слизистых оболочек и в краевой зоне селезенки, вызывая быстрый ответ от естественного Abs.
Традиционно, гуморальный иммунный ответ, опосредованный Abs, классифицируется на основании того, получают ли B-клетки помощь от T-клеток, т. е. являются ли они ответами TD или TI тимуса.
Терапия
Учитывая ускоренные темпы новых открытий в биологии В-клеток, лучшее понимание клеточных и молекулярных механизмов, вовлеченных в развитие, дифференцировку и функционирование этих клеток, выявит потенциальные терапевтические мишени и позволит разработать методы лечения анти-В-клеток, которые может разрешить клеточные изменения, ответственные за различные патологии.
Уже известно, что B-клетки играют фундаментальную роль в патогенезе RA путем продуцирования аутоантител и секреции хемокинов / цитокинов, и что они могут служить в качестве Ag-презентирующих клеток. Таким образом, некоторые рецепторы, костимулирующие молекулы, части сигнального каскада и провоспалительные медиаторы B-клеток считаются перспективными молекулами-мишенями для лечения RA, SLE, множественной миеломы и других заболеваний
Литература
Anderson G, Takahama Y. Thymic epithelial cells: working class heroes for T cell development and repertoire selection. Trends Immunol. 2012;33:256–63.
Bhandoola A, Sambandam A. From stem cell to T cell: one route or many? Nat Rev Immunol. 2006;6:117–26
Bousso P. T Cell activation by dendritic cells in the lymph node: lessons from the movies. Nat Rev Immunol. 2008;8:675–84.
Cyster JG. Homing of antibody secreting cells. Immunol Rev. 2003;194:48–60
Lloyd CM, Hessel EM. Functions of T cells in asthma: more than just T(H)2 cells. Nat Rev Immunol. 2010;10:838–48
Kato A, Hulse KE, Tan BK, Schleimer RP. B-lymphocyte lineage cells and the respiratory system. J Allergy Clin Immunol. 2013;131:933–57
. King C. New insights into the differentiation and function of T follicular helper cells. Nat Rev Immunol. 2009;9:757–66.
Kurosaki T. B-lymphocyte biology. Immunol Rev. 2010;237:5–9.
Mauri C, Bosma A. Immune regulatory function of B cells. Annu Rev Immunol. 2012;30:221–41
Pieper K, Grimbacher B, Eibel H. B Cell biology and development. J Allergy Clin Immunol. 2013;131:959–71.
Townsend MJ, Monroe JG, Chan AC. B Cell targeted therapies in human autoimmune diseases: an updated perspective. Im-munol Rev. 2010;237:264–83.
Turner SJ, Doherty PC, McCluskey J, Rossjohn J. Structural determinants of T Cell receptor bias in immunity. Nat Rev Immu-nol. 2006;6:883–94.
von Boehmer H, Melchers F. Checkpoints in lymphocyte development and autoimmune disease. Nat Immunol. 2010;11:14–20.
Cox MA, Kahan SM, Zajac AJ. Anti-viral CD8 T cells and the cytokines that they love. Virology. 2013;435:157–69
Girard JP, Moussion C, Forster R. HEVs, lymphatics and homeostatic immune cell trafficking in lymph nodes. Nat Rev Immunol. 2012;12:762–73.
Vinuesa CG, Chang PP. Innate B cell helpers reveal novel types of antibody responses. Nat Immunol. 2013;14:119–26