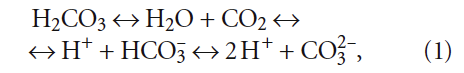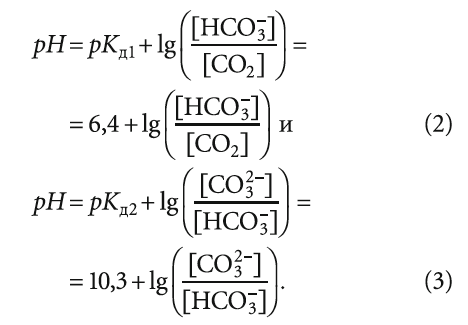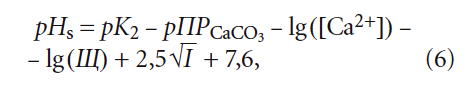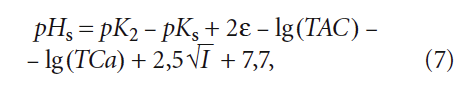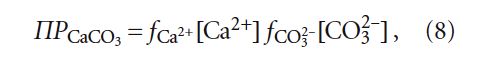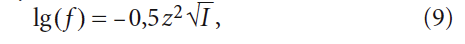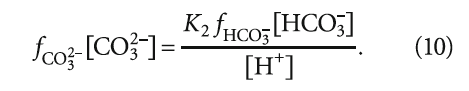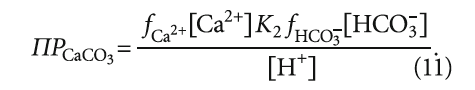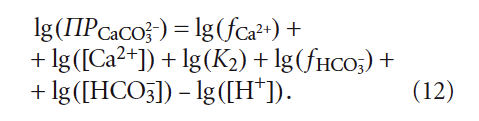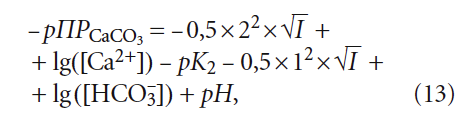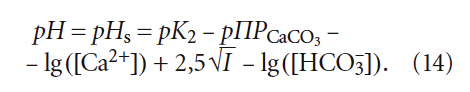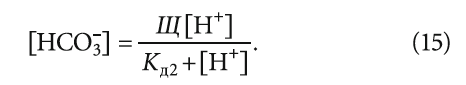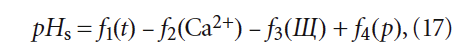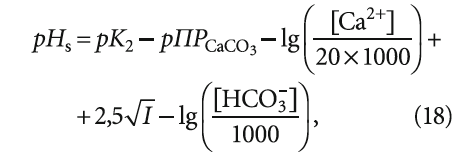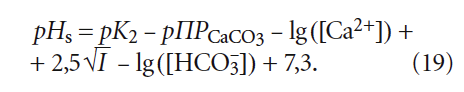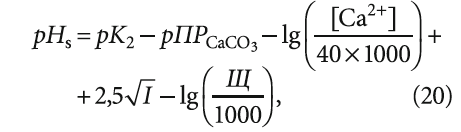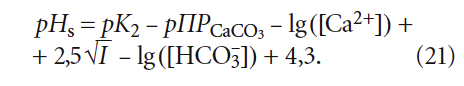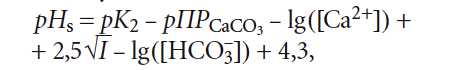Что сначала обезжелезивания или умягчение
Обезжелезивание и умягчение воды
Нужно пить всегда только чистую воду! В результате, для того, чтобы пользоваться качественной водой, ее следует очищать. Для этого сегодня огромное количество возможностей. Приборы очищения воды можно выбрать на любой вкус и цвет. И естественно, в соответствии с требованиями своего бюджета.
Только вот одним умягчением воды часто не обойдешься. Вода, поступающая через нашу устаревшую систему водоснабжения, по пути может контактировать со старыми трубами, где полно ржавчины. В результате процент содержания железистых примесей в воде растет. Но основную часть железистых соединений вода набирает из подземных источников. Проходя через породы с железными рудами, она впитывает в себя эти примеси. И в большинстве случаев, особенно в старых домах обезжелезивание и умягчение воды неразрывно связаны.

Прежде, чем рассмотреть комплексную работу обезжелезивания и умягчения воды, разберемся, каким же образом работают классические обезжелезиватели. Иногда ведь бывает так, что в воде следует устранять только примеси железа, а жесткость воды можно оставить на том же уровне.
Высокая степень содержания железа в воде также негативно влияет на здоровье и на качество стирки, как и излишняя жесткость. Железистые примеси негативно отражаются на вкусе воды, ржавая вода образует отложения внутри труб и другого оборудования, контактирующего с такой грязной водой. Явным признаком высокого содержания железа в воде будет желтоватый цвет, и характерный запах.
При стирке жесткая и железистая вода плохо будет растворять моющие средства. Окрасит в желтый цвет ваши вещи. Но главное, для того, чтобы хоть как-то постирать, придется использовать намного больше и порошка, и воды. Этот факт и вызвал столь высокий интерес к организации обезжелезивания и умягчения воды.
Особенность негативного влияния железистых солей и карбонатных состоит в том, что при работе их в комплексе накипной слой на поверхностях оборудования образовывается гораздо быстрее и что немаловажно, очень плохо устраняется. Почему железистые примеси стимулируют такие отложения?
Три соли работают слаженно, как единая команда. Кальций, магний и железо работают, как строительный раствор и кирпичи. Получается, что образуется накипь без плавного перехода от легкого известкового налета к камню. Смесь карбонатных солей и железистых образует известковый камень сразу. Растворить такой налет очень сложно. Если вы вскроете трубу с таким наростом и попытаетесь отломить хотя бы кусочек нароста накипи, то у вас вряд ли что-либо получится. Без молотка и отвертки точно не обойтись. Потому, при наличии солей железа в воде обезжелезивание и умягчение воды в системе идут неразрывно. Многие очистительные установки имеют внутри два этапа очистки, решая проблему железистости и карбонатной жесткости одним махом.
Минус казалось бы, простого процесса обезжелезивания заключается в том, что примеси железа в воде могут содержаться в самых разных формах. Это могут быть мелкие частицы, это могут быть растворенные соли, это могут быть каллоидные примеси. Задача перед фильтрами для воды стоит нелегкая. Им устранить из воды нужно все, все виды железистых примесей. Потому, так часто в быту система водоподготовки имеет большую многоступенчатую схему.
О том, что в вашей воде содержится железо, вы сможете узнать даже путем простейшего отстаивания. Все, что вам нужно, это подержать воду пару суток в нетронутом состоянии. Если образовался тонкий бурый осадок, то вода точно имеет высокий процент железа. Тут же нужно разбираться в примесях по цвету.
Если осадок имеет желтоватый оттенок, то это окисленное железо, трехвалентное. А вот если цвет бурый, то примеси железа неокисленного. Каллоидное, двувалентное железо встречается в воде изначально. А вот окисленное, образуется в результате работы грязной болотной воды с поверхностями оборудования, тоже далеко не чистыми.
Итак, мы разобрались и выявили, что вода кроме показателя жесткости имеет и другие не менее опасные соединения. Для того, чтобы выявить все эти примеси в воде, нужно провести анализ воды. Он покажет не только вид, и состав примесей, он поможет определить обьемы потребления воды, которые помогут составить правильную систему водоподготовки.
На сегодня существует несколько вариантов приборов обезжелезивания воды. Но выбор конкретного прибора под определенные условия обусловлен определенными требованиями. Это и стоимость, и обьем очищаемой воды, и экологичность, и скорость очистки воды. Со всех сторон, если посмотреть, то прибор, работающий в комплексе обезжелезивания и умягчения воды, выйдет намного экономичнее. К тому же полноценная установка обезжелезивания может занимать много места, что может не подходить для домашних условий.
Одним из вариантов фильтров для воды, которые помогут и с обезжелезиванием и умягчением воды является система гидрофлоу. Ее задача состоит в том, чтобы не дать железистым соединениям образовать известковый слой на поверхностях оборудования. Эта система работает таким образом, что соли жесткости разбиваются на очень мелкие кристаллы, которые не могут реагировать с солями жесткости. Они выпадают в осадок и легко вымываются из системы, без контактов с солями жесткости.
Благодаря таким новым установкам появилась возможность устранять железистые соединения только в определенном виде воды. Если вы поставите обезжелезиватель рядом с системой обратного осмоса, то вода, проходя через эту систему будет получаться качественной и вкусной.
Система обезжелезивания и умягчения воды подразумевает использование двух видов фильтров в одном корпусе. Сперва вода будет избавляться от железа, а потом ее будут умягчать. К недостаткам таких комплексных установок можно отнести тот факт, что при забивании одного фильтра, другой еще не нужно промывать. С этим связаны определенные трудности. Поэтому подобные приборы стараются использовать с одним видом фильтрующих элементов, который бы очищал сразу два вида примесей. Но качество очистки воды от такого комплексного влияния естественно страдает.
Поэтому подобные установки используют в тех случаях, когда вода имеет небольшой переизбыток либо солей жесткости, либо железистых примесей. Но в большинстве случаев более выгодно обезжелезивание и умягчение воды, если обьемы воды большие, использовать отдельно друг за другом. Тогда и качество очищенной воды будет значительно выше.
Что включает в себя обезжелезивание и умягчение в этом случае?
Как правило, если вода содержит железистые примеси, то после такой очистки, может следом идти дезинфекция. Для этого применяют ультрафиолетовые установки, которые включают в себя озонаторы или же просто устанавливают дозаторы, которые добавляют в воду для дезинфекции хлорку. Но присутствие таких примесей не обязательно. Поэтому сразу обезжелезивание и умягчение воды может идти в комплексе. Фильтрам обезжелезивателям абсолютно неважно, какие установки умягчения будут использоваться после них. Их задача состоит в том, чтобы поставить к этому этапу воду, полностью очищенную от железа.
Умягчение может проводиться самыми разными способами. Возможно даже применение тех же дозаторов с добавлением в воду специальных умягчающих веществ. Все зависит от степени жесткости. Если она не высока, то достаточно будет добавить в воду специальные средства и накипь на поверхностях откладываться не будет.
Если показатель жесткости в воде отличается значениями от 6, то тогда в обязательном порядке нужно приобретать специальные фильтры-умягчители воды. В целом, процесс умягчения можно проводить, точно как и обезжелезивание, путем химических реакций или же путем безреагентного воздействия. При этом, безреагентные приборы, такие как АкваЩит, включают в себя электромагниты высокой частоты и печатные платы с монтажом резисторов и транзисторов.
Во втором случае на излишнюю жесткость в воде влияют естественные процессы. Изменение формы солей жесткости происходит под влиянием таких явлений, как магнитное силовое поле, ультразвук или электромагнитные волны.
Приборы для обезжелезивания и умягчения воды
В качестве реагентных приборов можно выделить ионообменное устройство. В процессе непосредственно очистки, химических реакций внутри фильтра не происходит, а вот при восстановлении протекают химическая реакция между смолой и сильно соляным раствором. В этих приборах, где картридж восстанавливают, со временем его все равно придется менять. Та как смола исчерпывает свой ресурс. Для производства питьевой воды установки с восстанавливаемыми картриджами использовать нельзя. Здесь использоваться может только фильтр со сменным картриджем. Яркий представить – фильтр-кувшин. Его очень часто покупают для собственной квартиры или дачи. Но работает он только с той водой, которая в него залита. То есть для связки приборов для обезжелезивание и умягчение воды не применим.

Пока прибор восстанавливают, система ни на секунду не прекращает свою работу. Все продумано так, чтобы очистка грязной воды шла непрерывно. Тоже самое происходит и в фильтрах-обезжелезивателях, если того требует производство. Так, что связка приборов для обезжелезивания и умягчение воды достаточно часто работают в паре.
Еще один вариант умягчителя – электромагнитный умягчитель воды АкваЩит. Это естественный умягчитель. Его очень часто используют на предприятиях теплоэнергетики, а также при создании водоподготовки для паровых котлов частных коттеджей и собственных домов. С таким прибором фильтры-обезжелезиватели используются очень часто. Так, что обезжелезивание и умягчение воды с помощью электромагнитного воздействия очень распространено.
Тем более, что прибор отличается компактностью и большим удобством. Его легко установить, легко снять. Электроэнергии он потребляет совсем немного. А в работе в состоянии очищать воду, сутками напролет. При этом работает бесшумно и довольно быстро. Воздействие состоит в изменении формы кристалла соли. Получив новую форму, кристалл уже не может образовать накипной слой. Зато новыми острыми концами соли жесткости продолжают натирать старую накипь. Постоянного воздействия накипь не выдерживает и начинает постепенно отходить. Такая очистка от налета происходит на молекулярном уровне, следов не оставляет. Эти особенности и обеспечили данному прибору популярность, что в быту, что в котельных.
Из минусов прибора можно отметить, только невозможность работать со стоячей водой. Во всем остальной это идеальный напарник для обезжелезивателя. Можно также в связке обезжелезивание и умягчение воды использовать простой магнитный прибор. Но у него достаточно ограничений. Однако, если в квартире есть только холодная вода. то приобретение подобного фильтра будет вполне оправданным.
С уверенностью можно сказать, что и обезжелезивание и умягчение воды сегодня может спокойно использоваться друг без друга, но реалии увы, заставляют их часто идти рука об руку. Но как говорится, чем больше этапов очистки, тем качественнее и полезнее воду, в результате вы получите.
Обезжелезивание и умягчение воды: основные методы
Телефоны для связи:
+7 (917) 500-33-53,
+7 (926) 567-45-03;
Влияние загрязнений
Обезжелезивание и умягчение воды – наиболее очевидные процедуры, когда дело касается водоподготовки. Такие примеси, как соединения железа и соли кальция и магния чувствуются на вкус и плохо сказываются на организме. Кроме этого они портят бытовые приборы, ухудшают качество пищи и разрушают одежду. Жесткие соли способны за несколько лет вывести из строя водонагревательные приборы. Безусловно, с ними необходимо бороться и устанавливать специальные установки очистки воды.
Возникает вопрос – откуда эти соединения берутся. Если кальций и магний повсеместно расположены под землей, на уровне горизонтов забора артезианских вод, то различные примеси на основе железа попадают прямиком из потихоньку разрушающихся водопроводов. Там, где проложены новые магистрали, такой проблемы, как правило, нет. И умягчение и обезжелезивание это базовые функции комплексных систем водоподготовки. Эта проблема актуальна для большинства населенных пунктов нашей страны.
Методы обезжелезивания и умягчения
Умягчение обычно проводят путем ионного обмена. При нем специальная синтетическая смола при проходе через неё воды заменяет ионы кальция на ионы натрия. В результате, смола требует периодического восстановления (промывка специальным раствором), а в жидкости образуется безвредная сода, от которой несложно избавиться. Установки ионного обмена кроме умягчения решают сразу целый ряд проблем по очистке воды.
Существуют фильтры, обеспечивающие сразу и обезжелезивания и умягчение воды. Их установка проще и дешевле, но и эффективность у них меньше, чем при ступенчатой водоподготовке. Они подходят для отдельных случаев, когда загрязняющие вещества находятся в определенных концентрациях (прежде всего, это касается железа). Если оба показателя зашкаливают, то лучше использовать локальные средства борьбы.
Как правильно выбрать
В продаже можно увидеть множество различных фильтров и других устройств водоподготовки. Они различаются не только изготовителями, но и производительностью, степенью очистки, требованиями к обслуживанию.
Прежде чем что-то покупать, желательно произвести экспертизу имеющейся воды – это недорого и особых хлопот не доставит. Вполне возможно, что какие загрязнения будут незначительными, а какие-то наоборот неожиданно большими. Зная реальное положение дел, уже имеет смысл выбирать систему водоподготовки, в которой будет обезжелезивания и умягчение.
Предпочтение желательно отдавать известным торговым маркам – это даст гарантию качества товара и позволит не беспокоиться за выполнение гарантийных обязательств. Качественные системы водоподготовки прослужат долго, требуя лишь минимального внимания в виде встряхивания модулей, прочистки отдельных блоков и замены картриджей.
Проведя добротное обезжелезивания и умягчение воды, можно будет сразу отметить изменившийся вкус, который станет более приятным.
О возможности умягчения, деминерализации и изменения стабильности воды в процессе обезжелезивания
В процессе безреагентного обезжелезивания с помощью аэрации и фильтрования возможно изменение жёсткости и солесодержания воды. Изменение этих показателей, по всей вероятности, происходит не вследствие ионной сорбции Ca2+ и Mg2+, а в результате изменения индекса стабильности воды, которое можно рассматривать с точки зрения теории буферных растворов.
Другой автор — ведущий инженертехнолог ООО «НПЦ ПромВодОчистка» А. А. Бударагин [2] — в своей рецензии на представленную статью выразил сомнение в возможности умягчения и деминерализации в процессе обезжелезивания, указав, что «достаточно проблематично понять, в результате чего соли жёсткости частично выпадают в осадок».
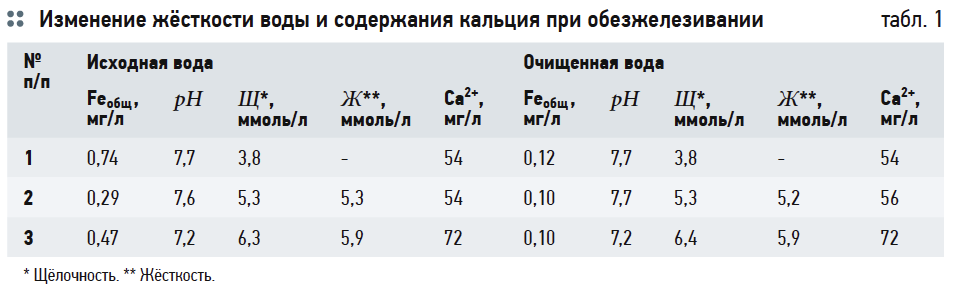
Наблюдения за изменением жёсткости воды и содержанием кальция при обезжелезивании, проведённые нами на станциях водоподготовки в Павлово-Посадском и Дмитровском районах Московской области, скорее подтверждают выводы второго автора (табл. 1).
В ходе работы станций водоподготовки, как видно из табл. 1, определялось не только непосредственно содержание общего железа, но и жёсткость воды, содержание кальция, рН воды, щёлочность, а также иные показатели, не указанные в табл. 1. Рассмотрение большего количества показателей качества воды, чем просто необходимо для решения данной технологической задачи, представляется весьма уместным, так как оно может дать более полную картину происходящего процесса. Ведь, несмотря на общепризнанное мнение, что вода представляет собой целостную систему, на практике преобладает подход, когда при исследованиях обращают внимание только на непосредственно интересующие параметры.
Как видно из данных табл. 1, заметного снижения жёсткости и концентрации кальция Ca 2+ не отмечено. Почти не изменились значения рН и щёлочности. Во всех случаях обезжелезивание проводилось с помощью глубокой аэрации воды компрессорами с последующим фильтрованием на напорных фильтрах, загруженных алюмосиликатным сорбентом «АС». Скорость фильтрации во всех случаях поддерживалась 18–20 м/ч. Следует также иметь в виду, что методика измерения концентрации Ca 2+ в условиях обычных городских лабораторий (даже официально аттестованных) не отличается высокой точностью, и вполне возможна погрешность в несколько миллиграмм на литр как в одну, так и в другую стороны.
Для описания этого процесса разработаны различные изотермы сорбции: Генри, Ленгмюра, Фрейндлиха, БЭТ. Однако даже для молекулярной сорбции, происходящей в динамических условиях при фильтрации в зернистой пористой среде, до сих пор не получено адекватных формул, которые можно было бы использовать в инженерных расчётах.
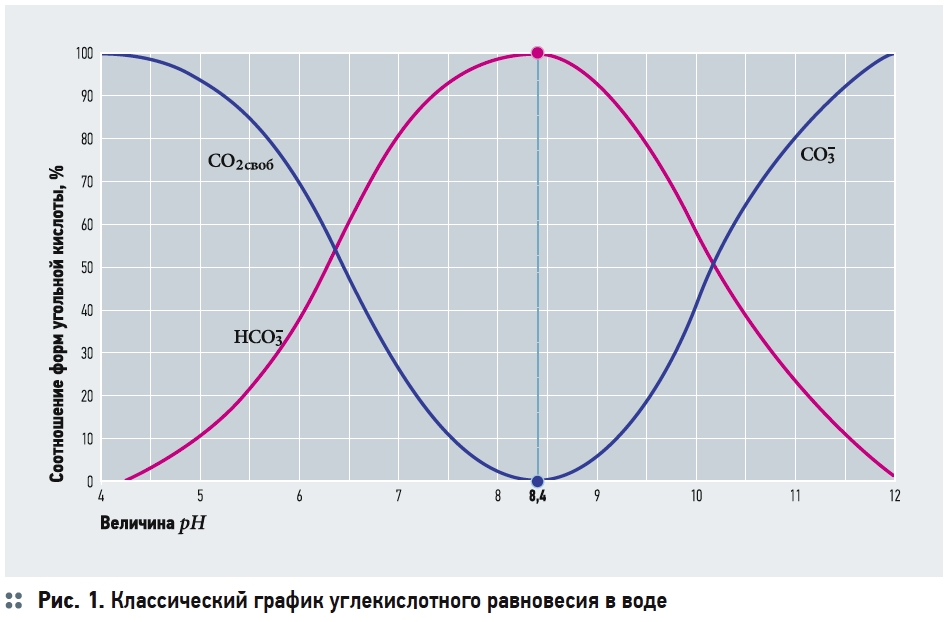
Многочисленные же дифференциальные уравнения и эмпирические формулы, предлагавшиеся разными исследователями для описания фильтрации через слой зернистой загрузки, на практике оказываются непригодными для практического применения. Поэтому процесс ионной сорбции катионов жёсткости изначально исключим из рассмотрения. С другой стороны, известно, что процессы химического умягчения связаны с образованием малорастворимых соединений — CaCO3 и Mg(OH)2, которые затем выделяются из обрабатываемой воды отстаиванием и(или) фильтрованием. Процесс обезжелезивания чаще всего связан с аэрацией исходной воды — упрощённой или глубокой, что предполагает газообмен между атмосферой и водой, которая всегда содержит растворённые газы. Как было подробно рассмотрено в [3, 4], аэрация значительно влияет на углекислотное равновесие в воде, что, в свою очередь, влияет на значение рН. Напомним, что в общем виде все составляющие углекислотного буферного раствора связаны уравнением следующего вида:
а выражение для рН, согласно теории буферных растворов Хендерсона-Хассельбаха, выглядит как:
Справедливости ради нужно сказать, что продолжительность аэрации при промышленном обезжелезивании очень небольшая — максимум всего несколько минут, что, конечно, несопоставимо с лабораторными опытами по многочасовой глубокой аэрации воды с помощью микрокомпрессора. Что, в свою очередь, не отрицает возможности изменения углекислотного равновесия при промышленном обезжелезивании воды на конкретном водоисточнике, на что и указывал Д. Ф. Янченко.
Таким образом, снижение жёсткости при обезжелезивании можно напрямую связать с изменением углекислотного равновесия и вытекающей отсюда возможностью выпадения CaCO3. Данное явление в водоподготовке обычно описывают показателем стабильности воды, выраженном в индексе Ланжелье (известны и другие индексы стабильности воды, но наиболее распространённым у нас является именно индекс Ланжелье). В целом, под стабильностью воды понимают состояние, когда вода не склонна ни к выделению карбоната кальция, ни к его растворению, что приводит к ускоренному разрушению бетонных конструкций. Индекс Ланжелье определяется как разность рН исходной воды и рНs (значение водородного показателя при полном насыщении данной воды карбонатом кальция):
Если получившееся значение J меньше 0, вода считается агрессивной. Наоборот, при J > 0 вода считается склонной к осадкообразованию карбоната кальция. Воды с J от –0,2 до +0,2 считаются относительно стабильными. Далее, чем больше по модулю значение J, тем более вода приобретает агрессивные свойства либо, наоборот, становится склонной к выделению карбоната кальция.
Индекс Ланжелье может быть выражен и с помощью щёлочности:
Здесь, как и в формуле (4), Щs соответствует щёлочности воды после её насыщения CaCO3. Независимо от способа выражения индекса стабильности, отклонение его от равновесия часто объясняют наличием агрессивной углекислоты, низким значением рН, высоким содержанием солей жёсткости и т.п. Отставив из рассмотрения коррозию в агрессивной водной среде металлических элементов и деталей, следует задаться вопросом о корректности некоторых формул и определений, используемых при описании стабильности воды.
Рассмотрим данный вопрос подробнее. рНs может быть рассчитан как по формулам, так и по номограммам, приводимым в специализированной литературой. Одна из часто используемых формул (например, в [5]) для расчёта pHs выглядит таким образом:
где К2 — константа равновесия второй ступени диссоциации угольной кислоты (HCO3 – = H + + CO3 2– ), К2 = 5,6 × 10 –11 при 25 °C (в работе [4] она записывалась как Кд2); ПРCaCO3 — произведение растворимости (произведение концентраций ионов малорастворимого электролита в его насыщенном растворе) карбоната кальция CaCO3; Са 2+ — содержание кальция в воде, мг/л; Щ — общая щёлочность воды, мг-экв/л; I — ионная сила раствора, которая оценивает интенсивность электрического поля, создаваемого ионами в растворе.
Сразу отметим, что под показателем Щ понимается только «общая щёлочность». Показатель так называемой «гидратной щёлочности», как было показано в [3], практически не имеет смысла.
В [6] уравнение (6) записано несколько иначе:
где ε — коэффициент, учитывающий солесодержание; ТАС — общая щёлочность; ТСа — содержание кальция.
Сложное, на первый взгляд, уравнение (6) в действительности происходит из уравнения произведения растворимости воды:
где fCa 2+ и fCO3 2– — коэффициенты активности ионов Са 2+ и CO3 2– ; [CO3 2– ] — концентрация карбонат-ионов, моль/л.
Коэффициент активность ионов (величина, характеризующая взаимодействие ионов в сильно разбавленном растворе электролита) определяется по формуле Дебая-Хюккеля:
Уравнение (8) можно преобразовать, выразив fCO3 2– [CO3 2– ] через концентрации гидрокарбонат-ионов [HCO3 – ] (с учётом коэффициента активности fНСO3 – ) и ионов водорода [H + ] (активность ионов водорода принимается равной единице), то есть имеет место:
Тогда уравнение (8) преобразуется в следующий вид:
Прологарифмировав обе части выражения (11), получим:
В научно-технической практике часто применяют такую замену: – lg(Х) = рХ, где Х — концентрация какого-либо иона, константа и т.п. Тогда (12) с учетом (9) запишется так:
Сразу отметим различие выражений (6) и (14): в одном случае для расчёта рНs фигурирует щёлочность воды Щ, в другом — концентрация гидрокарбонатионов [HCO3 – ]. Это немаловажное различие, так как щёлочность воды определяется не только содержанием гидрокарбонат-ионов [HCO3 – ], но и карбонат-ионов [CO3 2– ]. Среди специалистов по водоподготовке давно укоренилось представление, что общая щёлочность при рН 2– ] в этом случае можно пренебречь), но одновременно накладывает ограничения на использование уравнения (6) только в пределах определённых значений рН, что, конечно, является его недостатком.
Отождествление щёлочности и гидрокарбонатов приводит к путанице при определении показателей качества воды даже в аналитических лабораториях. Например, в ряде лабораторий предлагаются услуги по определению отдельно щёлочности и отдельно гидрокарбонатов, причём анализ на гидрокарбонаты может стоить 200–300 руб. и даже больше (по расценкам начала 2017 года).
В протоколах испытаний воды для хозяйственно-питьевого водоснабжения можно найти такие данные (взяты из документов, размещённых в Интернете):
Из представленных данных видно, что во всех случаях содержание гидрокарбонатов равно щёлочности, умноженной на их эквивалентную массу — 61 г/моль или, точнее, 61 мг/ммоль. Выполнить такой простой расчёт способен мало-мальски грамотный человек и без проведения химического анализа. При этом содержание гидрокарбонатов всегда меньше щёлочности, пусть и на ничтожную величину. Концентрации [HCO3 – ] и [CO3 2– ] при известных рН и щёлочности воды нужно искать по известным формулам углекислотного равновесия, которые подробно рассмотрены в [4], в частности:
При этом сам заказ анализа на гидрокарбонаты представляется излишним.
На обе формулы — (6) и (14) — накладываются ограничения, связанные с показателем ионной силы раствора I. Это связано с несовершенством теории сильно разбавленных сильных электролитов Дебая-Хюккеля, которая не учитывает молекулярной структуры растворителя, размеров ионов и расстояния между ними. Обычно считают, что она применима для концентраций растворов не более 0,015 моль/л. Ионная сила раствора определяется по формуле:
где ci — молярные концентрации ионов, моль/л; zi — заряды ионов.
Для расчётов по формуле (16) необходимо знать полный ионный состав воды, что часто бывает затруднительно, поэтому можно ввести допущение, представив всю минерализацию (сухой остаток) в виде NaCl. Так как молярная масса NaCl составляет примерно 58,5 г/моль, то молярная концентрация 0,015 моль/л соответствует минерализации приблизительно 878 мг/л — условно примем, что расчёты по (6) и (14) могут быть корректными только для пресных вод (до солесодержания 1 г/л).
Рассчитаем для примера ионную силу раствора (исходной природной воды) с сухим остатком 500 мг/л. 500 мг/л соответствует 0,0085 моль/л NaCl. Тогда ионная сила такого раствора составит:
I = 0,5 × (0,0085 × 1 2 + 0,0085 × 1 2 ) = 0,0085.
Другим способом определения рНs, позволяющим проводить расчёты для широкого диапазона минерализаций, является использование специальных номограмм, приведённых в соответствующей литературе по водоподготовке, например, в [5] (рис. 2), а также в [7] (рис. 3).
Согласно номограммам на рис. 2, значение рНs определяется по формуле:
где f1(t), f2(Ca 2+ ), f3(Щ) и f4(p) — функции температуры воды, содержания кальция, щёлочности и солесодержания (минерализации), соответственно.
Интересно, что выражение (17) в некоторых популярных изданиях по водоподготовке, а также в сети Интернет, иногда записывается с ошибками.
По номограммам на рис. 3 рНs оценивается с помощью простейших геометрических построений. Разумеется, точность расчётов по номограммам уступает точности расчёта по математическим формулам, так как при этом всегда присутствует определённая субъективность.
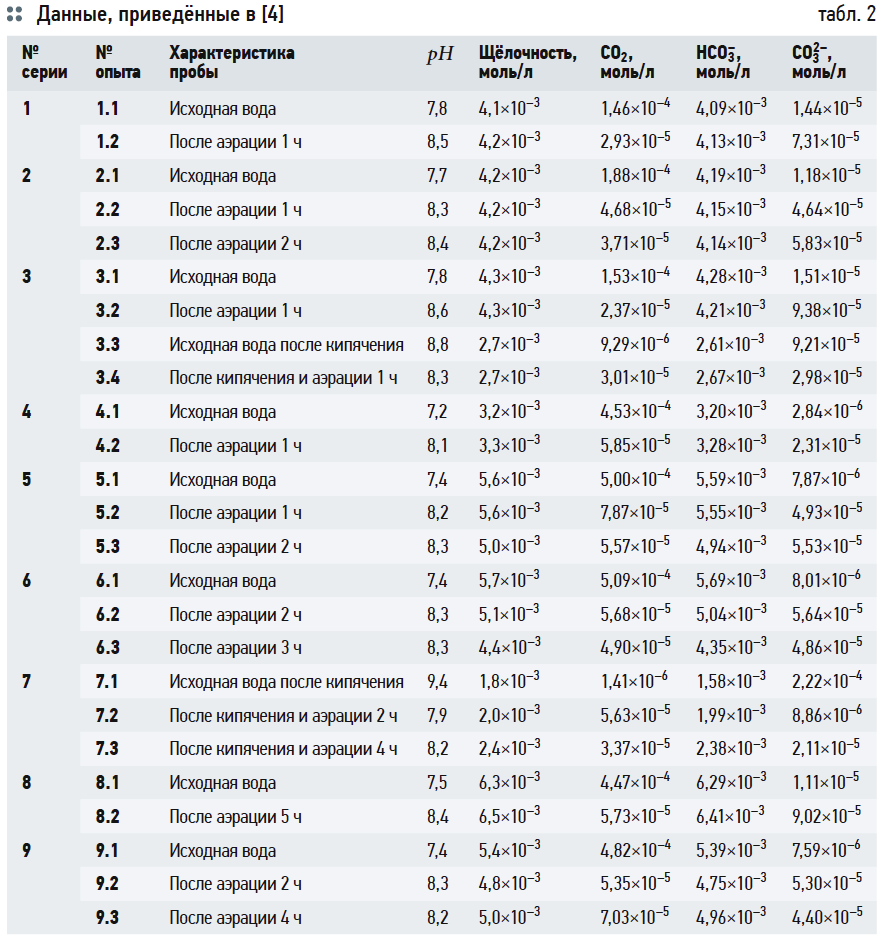
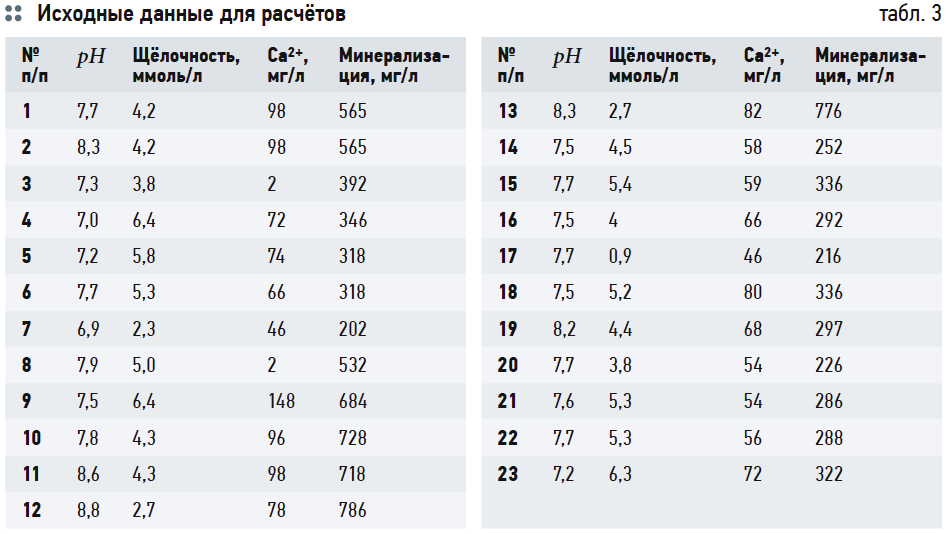
Оценим значения рНs и индекса Ланжелье J по выражениям (6), (14) и номограммам на рис. 2 и 3. Условно обозначим их рНs1, J1; рНs2, J2; рНs3, J3 и рНs4, J4, соответственно. Исходные данные для расчётов взяты из анализов исходной воды из подземных источников (скважин) Московской области, аэрированной и кипячёной воды. Большая часть исходных данных соответствует приведённым в [4] с добавлением необходимых показателей, которые не были рассмотрены в указанной статье. Эти данные были дополнены результатами более поздних исследований. Все они сведены в табл. 3.
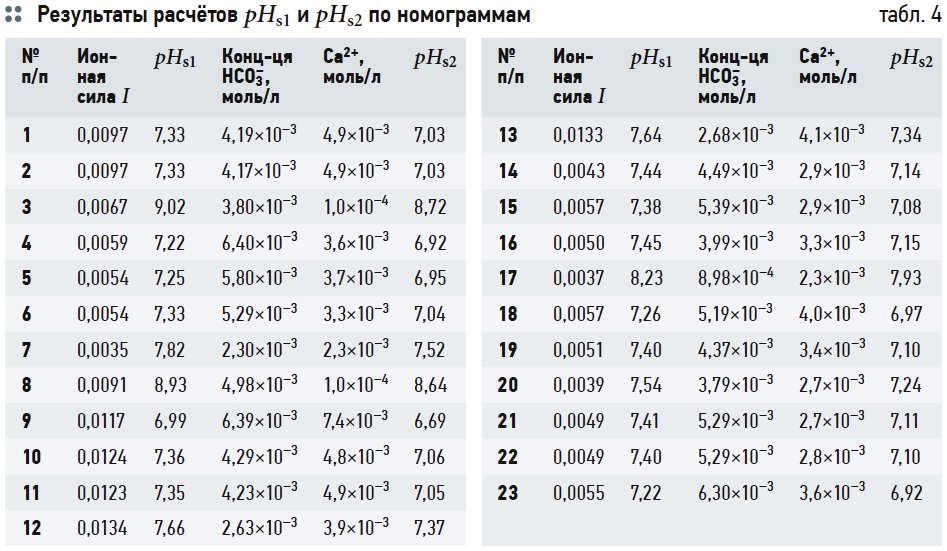
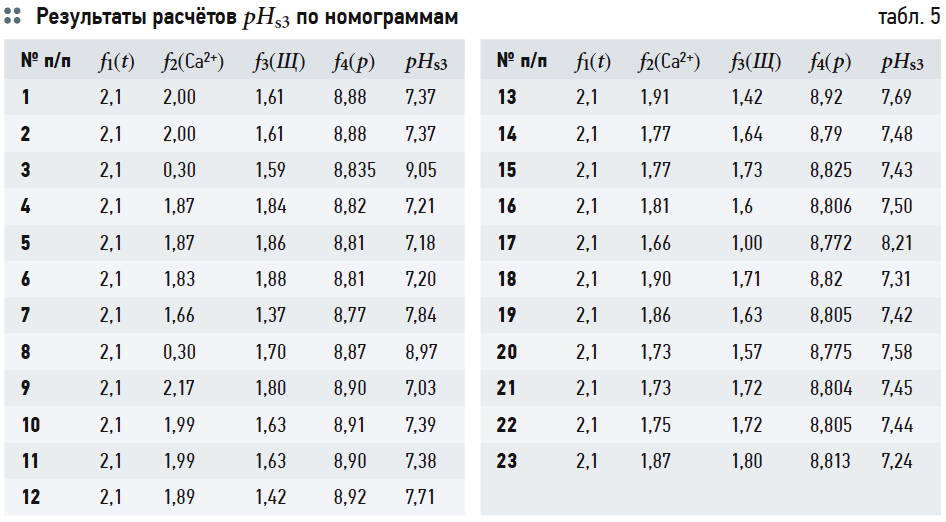
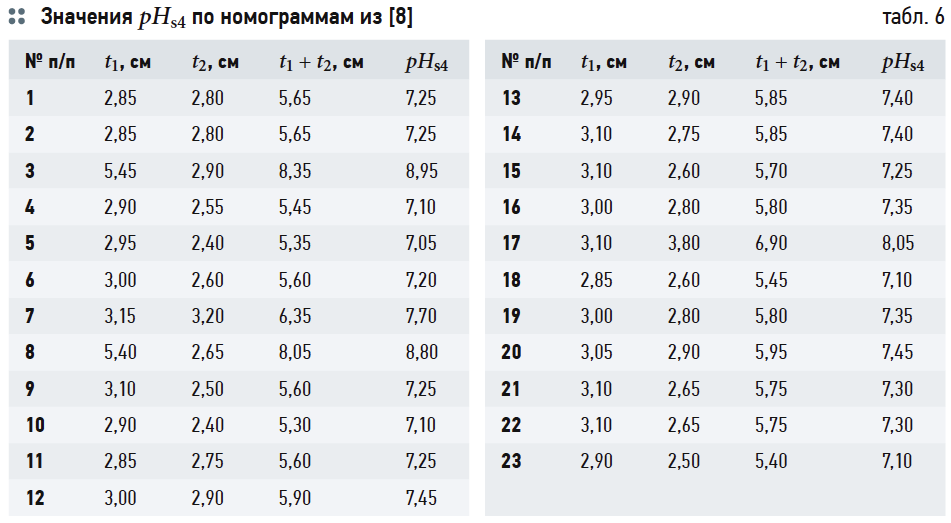
В табл. 4 приведены результаты расчётов значений рНs1 (согласно выражению (6)), рНs2 (согласно выражению (14)) и связанных с ними параметров ионной силы раствора I и содержания гидрокарбонат-ионов [HCO3 – ]. Результаты расчётов рНs3 по номограммам на рис. 2 и по формуле (17) приведены в табл. 5. В табл. 6 показаны значения рНs4, найденные согласно номограммам из [8] (t1, t2, t1 + t2 — результаты геометрических построений, сделанные вручную).
Следует повторить, что все данные в табл. 5 и 6 основаны на графических построениях, которые, разумеется, в той или иной степени субъективны.
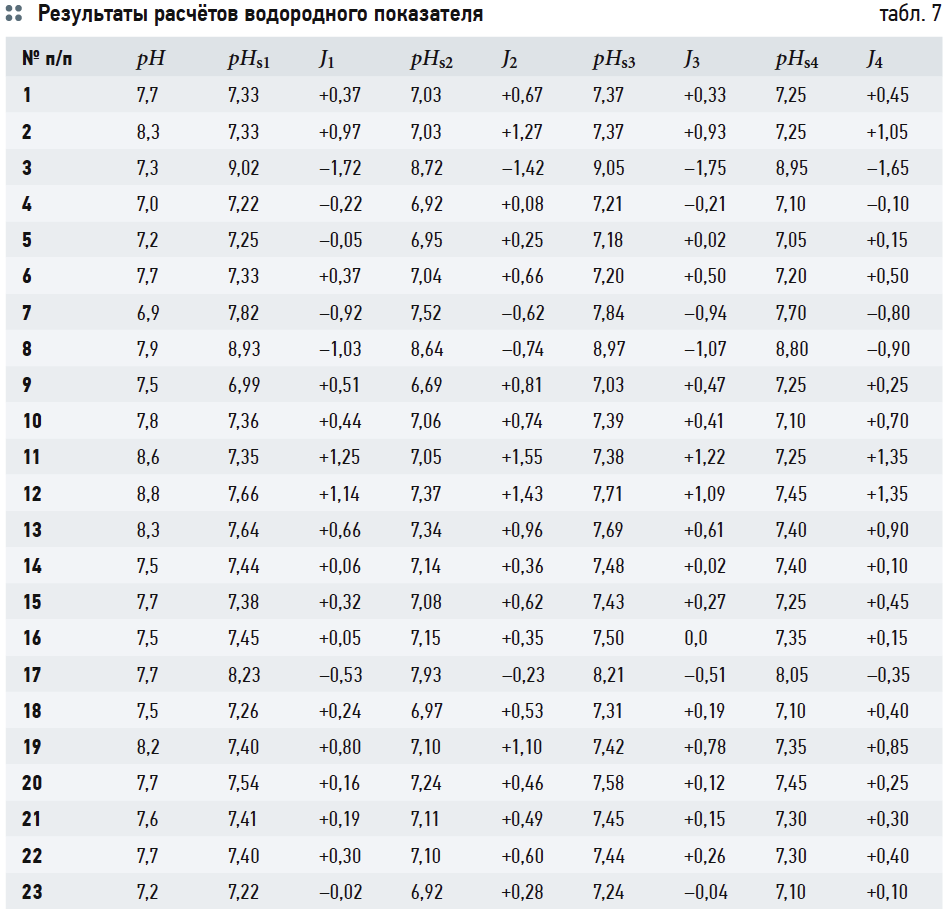
В табл. 7 сведены результаты расчётов водородного показателя при полном насыщении карбонатом кальция CaCO3 по всем использованным формулам и номограммам и значения индексов Ланжелье J1, …, J4. Во втором столбце указаны измеренные значения рН воды.
Данные табл. 7 показывают, что значения J1 и J2 (вычисленные на основе формулы (6) и номограмм на рис. 2) отличаются очень мало. Наоборот, значения J3, рассчитанные на основе (14), почти во всех случаях превышают J1 на 0,3. Это довольно существенное различие: в одном случае одну и ту же воду можно считать стабильной, в другом случае она определяется как склонная к выделению карбоната кальция. Значения J4 занимают своего рода промежуточное положение между J1 и J2, но в основном ближе к J1.
Разницу между J1 и J3, очевидно, следует объяснять размерностями величин, используемых в данных выражениях.
Так, если в (14) концентрации [Ca 2+ ] и [HCO3 – ] выразить не в [моль/л], а в [мг/л] и [мг-экв/л] ([ммоль/л]), соответственно, то эта формула приобретёт вид:
где 20 — эквивалентная масса кальция [г/моль], получаемая делением молярной массы (М = 40 г/моль) на валентность z = 2.
Коэффициент 7,6 в выражении (6), вероятно, был получен из следующей записи этой формулы:
где Щ — щёлочность в [мг-экв/л] (или [ммоль/л]); Са 2+ — содержание в воде кальция в [мг/л]; 40 — молярная масса кальция, г/моль.
Однако, по мнению автора, более правильным в данном случае является использование не молярной, а эквивалентной массы, так как расчёты ведутся для веществ, находящихся в ионной форме.
Учитывая, что обычно концентрация кальция измеряется в [мг/л], а содержание гидрокарбонатов из уравнения (15) получается в [моль/л] (для этого щёлочность Щ также следует подставлять в [моль/л]), то окончательно выражение (14) можно записать в виде:
Следует отметить, что выражение (14) применимо для всех значений рН, так как [HCO3 – ] определяется исходя из уравнения константы диссоциации (химического равновесия) угольной кислоты, основанном на фундаментальном законе действующих масс.
Выводы
1. Умягчение воды (как попутный процесс при её обезжелезивании с помощью аэрации и фильтрования) возможно только при определённом сочетании показателей качества воды. При этом оно не может рассматриваться как технологически значимый метод снижения жёсткости.
2. Не представлено никаких обоснованных данных, указывающих на протекание процесса умягчения при обезжелезивании за счёт явления ионной сорбции. Более вероятной причиной умягчения воды в данном случае следует считать изменение показателя стабильности воды вследствие интенсивной аэрации.
3. Анализ воды на гидрокарбонаты, предлагаемый рядом лабораторий в качестве платной услуги, представляется бессмысленным, так как концентрацию [HCO3 – ] можно легко вычислить согласно известному выражению (15).
4. Расчётные формулы и номограммы для определения рНs и индекса стабильности Ланжелье J, по мнению автора, нуждаются в уточнении. Более адекватным выражением для расчёта рНs представляется следующее:
в котором [Ca 2+ ] имеет размерность [мг/л], [HCO3 – ] — [моль/л].