Что следует понимать под скоростью химической реакции
Скорость химической реакции
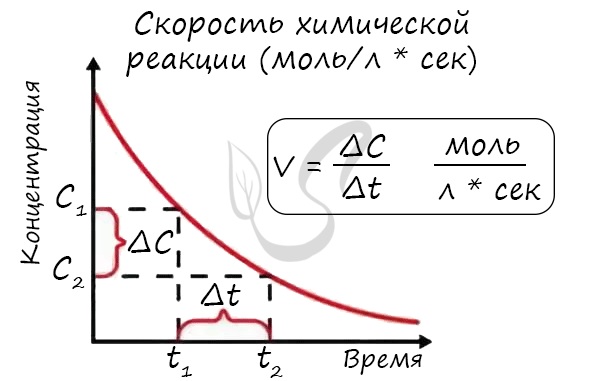
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.
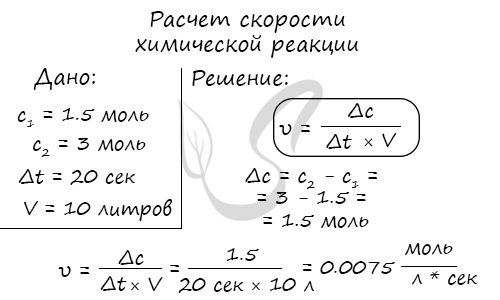
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.
Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Химическая активность также играет важную роль. Например, отвечая на вопрос: какой из металлов Li или K быстрее прореагирует с водой? Мы отдадим предпочтение литию, так как в ряду активности металлов он стоит левее калия, а значит литий активнее калия.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.
Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?
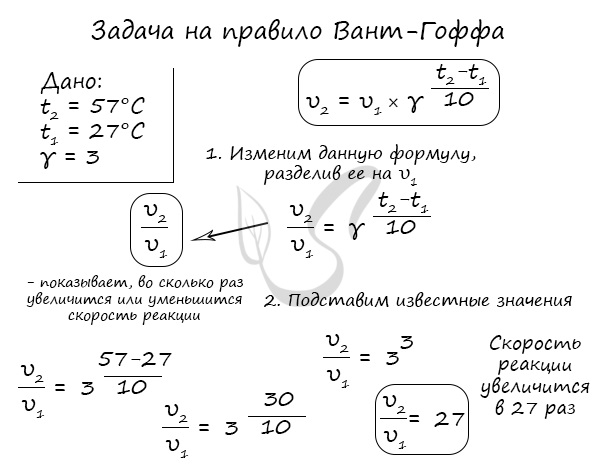
По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?
В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет!»
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: «При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».
Катализаторы и ингибиторы
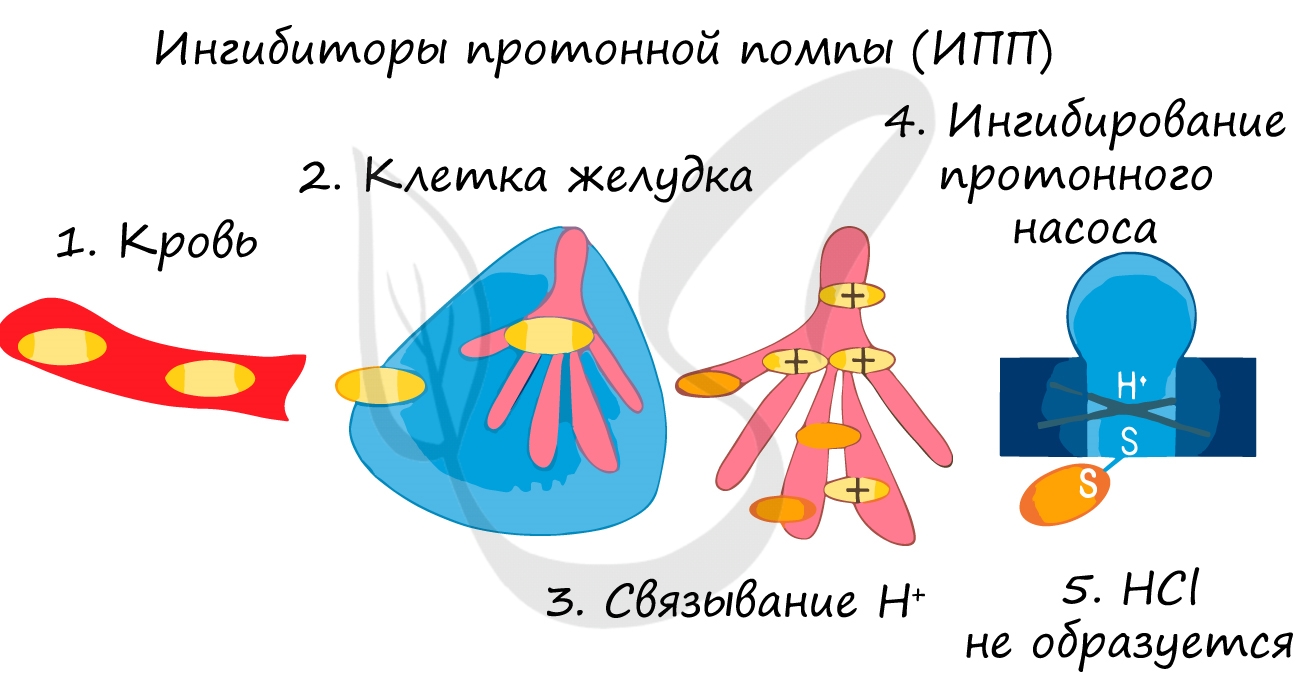
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Скорость химической реакции
Что следует понимать под скоростью химической реакции
Ключевые слова конспекта: Скорость химической реакции. Факторы, влияющие на скорость реакции: природа реагирующих веществ, площадь их соприкосновения, температура, концентрация, катализатор. Катализ. Ферменты. Ингибиторы.
Скорость — это отношение изменения какой-либо величины к промежутку времени, за которое это изменение произошло. Химические реакции протекают с разными скоростями. Одни практически мгновенно, например смесь водорода с кислородом (гремучая смесь) взрывается за доли секунды. Быстро протекает реакция нейтрализации, т. е. взаимодействие растворов кислоты со щёлочью (основанием):
Другие реакции протекают значительно медленнее, например брожение глюкозы или коррозия металлов:
Что же понимается под скоростью химической реакции? Предположим, некоторое взаимодействие протекает по схеме А + В = АВ. В ходе реакции вещества А и В расходуются, превращаясь в новое вещество АВ. Изменение количества веществ, участвующих в химической реакции, характеризует такая величина, как концентрация.
| Концентрация — количество вещества в единице объёма; её измеряют в моль/л. |
В ходе реакции концентрация исходных веществ (реагентов) уменьшается, а концентрация продукта реакции увеличивается. Изменение концентраций во времени и характеризует скорость химической реакции.
| Скорость химической реакции — отношение изменения концентрации реагента ко времени, за которое это изменение произошло. |
Математически эту закономерность можно выразить следующей формулой:
Если в приведённой формуле С1 и С2 — это начальная и конечная концентрации одного из реагентов, то разность С2 – С1 имеет отрицательное значение, ведь С2 0.
Размерность скорости реакции легко определить: концентрация измеряется в моль/л, время — в секундах, следовательно, единицей скорости реакции является 1 моль/(л • с).
Управление скоростью химической реакции имеет большое значение. Увеличение скорости реакции позволяет получить больше продуктов реакций: стали, пластмасс, химических удобрений, лекарств, топлива и др. Замедление скорости реакции позволяет уменьшать потери металла от коррозии, дольше сохранять продукты питания и т. д.
Рассмотрим, какие факторы влияют на скорость химической реакции.
✅ 1. Природа (состав и строение) реагирующих веществ. Реакции между органическими веществами протекают медленнее подобных реакций между неорганическими веществами. По-разному взаимодействуют галогены с водородом: фтор — со взрывом, хлор — со взрывом лишь при нагревании, бром — без взрыва, а реакция водорода с йодом является эндотермической и протекает медленно. Интенсивность взаимодействия щелочных металлов с водой зависит от их восстановительных свойств, которые усиливаются с увеличением радиуса атома.
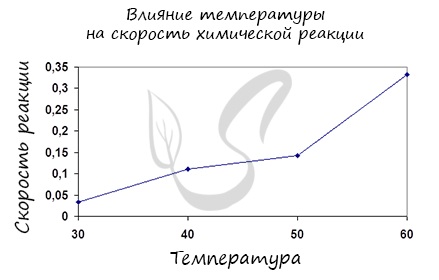
✅ 2. Температура. Зависимость скорости химической реакции от температуры была установлена в конце 1884 г. голландским учёным Якобом Хендриком Вант-Гоффом.
Математическое выражение правила Вант-Гоффа записывают следующим образом:
где υ2 — скорость реакции при температуре t2;
υ1 — скорость реакции при температуре t1;
t2 — конечная температура реакции;
t1 — начальная температура реакции,
γ (греческая буква «гамма») — температурный коэффициент реакции, который соответствует изменению скорости химической реакции (увеличивает или уменьшает её) при изменении температуры на 10 градусов.
Например, температурный коэффициент какой–либо реакции близок к 3. Это означает, что при повышении температуры на 20 °С скорость реакции возрастёт в 9 раз:
✅ 3. Площадь соприкосновения реагирующих веществ. Этот фактор учитывается для гетерогенных реакций. Напомним, что гетерогенными (от греч. heteros — другой) называются реакции, идущие между веществами разного агрегатного состояния, т. е. имеющими поверхность раздела. Например, на поверхности соприкосновения жидкости или газа с твёрдым веществом и т. д.
Понятно, что, чем больше площадь соприкосновения реагирующих веществ, тем выше скорость химической реакции. Чтобы увеличить её, в промышленности используют особый метод, который называется «кипящий слой». Твёрдое вещество измельчают до очень мелких частиц, через которые затем пропускают снизу второй реагент, как правило, в газообразном состоянии. При прохождении этого реагента через слой измельчённого вещества наблюдается эффект, напоминающий кипение. Метод «кипящего слоя» используется при производстве серной кислоты для обжига серного колчедана, при каталитическом крекинге нефтепродуктов.
✅ 4. Концентрация реагирующих веществ. Зависимость была установлена норвежскими учёными Като Максимилианом Гульдбергом и Петером Вааге в 1867 г. и получила название закона действующих масс.
| Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции. |
Математическое выражение закона действующих масс для реакции aА + bВ = dD выглядит так:
где υ — скорость химической реакции, СА и СB — концентрации реагентов А и В, а и b — коэффициенты в уравнении реакции, k — коэффициент пропорциональности — константа скорости реакции, которая показывает скорость химической реакции при концентрации реагирующих веществ, равных 1 моль/л.
Например, для второй стадии производства азотной кислоты, которая описывается уравнением 2NO + O2 = 2NO2↑, закон действующих масс отражает формула υ = k • C 2 (NO) • С(O2)
Если в гетерогенной реакции принимает участие твёрдое вещество, его концентрация не входит в уравнение закона. Например, для реакции между раскалённым оксидом меди(II) и водородом СuО + Н2 = Сu + Н2O справедливо следующее выражение: υ = k • С(Н2)
Это означает, что внесение дополнительного количества твёрдого вещества (оксида меди(II)) не оказывает влияния на скорость реакции.
✅ 5. Катализатор. Напомним, что катализаторами (от греч. katalysis — разрушение) называются вещества, изменяющие скорость химической реакции и не входящие в состав продуктов реакции.
Современную химическую промышленность невозможно представить без использования катализаторов. С их помощью ускоряют химические процессы, чтобы быстрее получить нужные вещества и уничтожить вредные (например, химические отходы). Производство минеральных кислот, аммиака и метанола, уксусной кислоты и полимеров, нефтепереработка и производство лекарственных препаратов — около 90 % всех химических производств основано на применении катализаторов.
С помощью катализаторов удаётся повысить производительность химических процессов и уменьшить себестоимость продукции. Катализаторы также позволяют сделать производство экологически более безопасным, т. е. уменьшить загрязнение окружающей среды вредными выбросами.
Катализаторы вошли в жизнь человека, когда он стал использовать процессы брожения для получения уксуса из виноградного сока, варить сыр и выпекать хлеб. Ведь все эти процессы протекают в присутствии биологических катализаторов, или ферментов (от лат. fermentum — закваска). Их также называют энзимами.
Ферменты содержатся во всех живых клетках. Они направляют, регулируют и многократно ускоряют биологические процессы, играя тем самым важную роль в обмене веществ и энергии.
Область применения биологических катализаторов шире, чем неорганических: ежегодный рост их производства в мире составляет 15%, а неорганических — всего 3%. Ферменты «трудятся» в медицине, сельском хозяйстве, пищевой промышленности, защищают окружающую среду, помогают в быту. Например, использование стирального порошка с ферментами — залог успешной стирки. Зная, что ферменты имеют белковую природу и под действием высокой температуры способны денатурировать, вы понимаете, насколько важно следовать инструкции по применению таких порошков.
Обратное влияние на скорость химической реакции оказывают ингибиторы (от лат. inhibere — сдерживать, останавливать) — вещества, подавляющие или задерживающие течение физиологических и физико-химических (главным образом, ферментативных) процессов. Такие вещества важны, как и катализаторы: ингибиторы коррозии, например, помогают сохранить металлы от разрушения.
Конспект урока по химии «Скорость химических реакций». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Химическая кинетика. Скорость химических реакций
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С.
Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
pV = νRT
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.