Что синтезируется в рибосомах
Рибосомы. Часть 1
Совет автора: перед прочтением статьи повторите, как в общих чертах идет процесс трансляции.
«Жизнь есть способ существования белковых тел. », — дает нам определение жизни известный классик. И действительно, белки выполняют в наших (да и во всех остальных) организмах практически все функции: структурную, каталитическую, транспортную и многие-многие другие. Пожалуй, белки не могут только хранить и передавать наследственную информацию, но даже к этим процессам они все равно «прикладывают руку». Белки, или протеины, — это полимеры, состоящие из мономеров — аминокислот. Белки синтезируются в ходе матричного синтеза, называемого трансляцией, который протекает на рибосомах*. Более подробно о самой трансляции вы узнаете из наших следующих статей, а пока сосредоточимся на главном действующем лице этого процесса — на рибосоме. Рибосомы по своей природе — это немембранные органоиды, состоящие из РНК и белка. Рибосомы есть во всех формах клеточной жизни и даже иногда встречаются у вирусов (!)**. Давайте подробнее поговорим о строении, образовании и разнообразии этих важнейших органоидов.
*Есть еще пептиды, которые синтезируются не в ходе трансляции и без участия рибосом. Такие пептиды называются «нерибосомальные», о некоторых из них мы рассказывали в предыдущей статье.
**«Вирусные» рибосомы — это, на самом деле, рибосомы клетки-хозяина, которые включились в вирусную частицу при ее выходе из клетки. По-видимому, вирусы никак не используют эти рибосомы — они остаются в качестве своеобразного сувенира от бывшего хозяина и в дальнейшем бесполезны (источник).
Сколько рибосом в клетке?
Органоиды, на которых протекает трансляция, — это необходимый компонент любой живой клетки. Чем «активнее» клетка, тем больше ей нужно синтезировать белка, и тем больше в ней рибосом. В клетке кишечной палочки (Escherichia coli) их насчитывают от нескольких тысяч до нескольких десятков тысяч в зависимости от фазы роста клеточной культуры и интенсивности клеточного деления. Если мы посмотрим на микрофотографию бактериальной клетки (рис.1), то увидим, что цитоплазма буквально «набита» рибосомами, из-за них она имеет зернистую структуру.
У млекопитающих количество рибосом еще более впечатляющее — в одной клетке их содержится порядка 10 миллионов!
Внешний вид рибосом
Под микроскопом рибосомы выглядят как компактные частички порядка 20–30 нм в диаметре (рис. 2).
Каждая рибосома состоит из двух частей — большой и малой субъединиц (рис.3). Они контактируют друг с другом определенным образом, и рибосома может работать только в таком «собранном» виде. По-отдельности субъединицы не могут выполнять свои функции в клетке.
Рибосомы прокариот и эукариот отличаются между собой. Первое отличие, которое мы рассмотрим, касается их массы (рис.3).
Прокариотическая рибосома (рис.3) имеет молекулярную массу 2,5 млн Дальтон (4,15х10^(-18) грамм). Исследования методом центрифугирования (рис.4) показали, что у целой рибосомы коэффициент седиментации — 70S (часто прокариотические рибосомы так и называют — 70S рибосомы). S — это Сведберг, единица коэффициента седиментации. Большая субъединица имеет коэффициент седиментации 50S, а малая — 30S.
! Обратите внимание. При соединении 50S субъединицы и 30S субъединицы константа седиментации целой прокариотической рибосомы получается не 80S, как можно было бы подумать, а 70S. Это происходит потому, что седиментация (осаждение) при центрифугировании зависит не только от массы, но и от формы частицы. Поэтому, когда две субъединицы объединяются в целую рибосому, происходит не просто суммирование их масс, но и появление новой формы, которую нельзя рассматривать как сумму составляющих ее частей. То же самое справедливо и для эукариотической рибосомы.
Эукариотическая рибосома (рис.3) имеет молекулярную массу 4,2 миллиона Дальтон (6,97х10^(-18) грамм). Константа седиментации целой рибосомы — 80S, большой субъединицы — 60S, малой субъединицы — 40S.
Как вы могли заметить из предыдущих рисунков, ни целая рибосома, ни её субъединицы не являются по форме шариками, а имеют сложную структуру. Давайте немного подробнее рассмотрим морфологию рибосомальных субъединиц (рис. 5).
Помимо формы и размера большая и малая субъединица отличаются своими функциями. Важнейшая функция большой субъединицы — образование пептидной связи (рис.6). Малая субъединица ответственна за правильное декодирование триплетов иРНК. Ни большая, ни малая субъединица не могут работать по отдельности, для трансляции обязательно требуется их объединение.
3D-моделирование позволило увидеть рибосомы в объёме. На этом сайте вы можете подробнее рассмотреть 3D структуру рибосомы и «поиграть» с ней: покрутить и посмотреть на нее с разных ракурсов, попробовать найти описанные части рибосомальных субъединиц и туннель для иРНК. Осторожно, это очень залипательное занятие! 🙂
Из каких молекул состоит рибосома
Рибосомы по своей природе являются нуклеопротеидами и состоят из РНК и белков.
Сначала рассмотрим рибонуклеиновый компонент рибосом. РНК, которая находится в рибосоме, называется рРНК, на её долю приходится примерно 80% от всей РНК в клетке. Рибосомальная РНК выполняет в рибосоме важнейшие функции, в том числе катализирует образование пептидной связи. Это может показаться очень странным, ведь обычно за катализ химических реакций в клетке отвечают ферменты — белки, а это другой класс соединений. Тот факт, что в рибосоме основную функцию выполняют именно РНК, является одним из аргументов в пользу гипотезы РНК-мира. Возможно, что рибосома изначально вообще состояла только из РНК, а белки присоединились к ней позднее в ходе эволюции (см. статью).
В рибосоме содержится несколько видов молекул рРНК. Молекулы рРНК у эукариот и прокариот гомологичны, то есть схожи между собой, однако имеются и некоторые отличия.
В прокариотической рибосоме есть три вида РНК: 5S, 16S и 23S РНК. Буква S здесь также означает «Сведберг». Иными словами, разные рРНК имеют свои собственные константы седиментации, соответствующие их названиям. 16S рРНК находится в малой субъединице, и одна из её функций — прикрепить иРНК на рибосому, чтобы начать трансляцию. У прокариот в иРНК перед старт-кодоном есть особая последовательность — последовательность Шайна-Дальгарно. Она нужна, чтобы рибосома могла «ухватиться» за иРНК и начать синтезировать белок. В 16S рРНК содержится участок, который комплементарно связывается с последовательностью Шайна-Дальгарно и обеспечивает эту самую связь.
В большой субъединице у прокариот содержатся два вида рРНК — 23S и 5S рРНК. 23S рРНК ответственна за катализ образования пептидной связи. Зачем нужна 5S рРНК, до сих пор непонятно, хотя на этот счет выдвигаются разнообразные гипотезы.
В большой субъединице находятся три молекулы рРНК. 5S рРНК гомологична такой же рРНК у прокариот. 5.8S и 28S РНК гомологичны 23S рРНК прокариот и, по сути, являются двумя отдельными ее кусочками.
Как и все другие РНК (за исключением РНК некоторых вирусов), рРНК синтезируются на матрице ДНК с использованием ферментов РНК-полимераз. У бактерий один и тот же вид РНК-полимеразы транскрибирует все виды РНК. У эукариот РНК-полимераз несколько. РНК-полимераза III синтезирует 5S рРНК, а все другие виды рРНК транскрибируются РНК-полимеразой I. Из-за этого факта некоторые ученые предполагают эволюционное родство 5S рРНК и тРНК, которые синтезируются той же РНК-полимеразой.
Все сказанное о рРНК бактерий и эукариот суммировано в таблице 1.
Рибосомальные РНК имеют очень сложную пространственную структуру. Чтобы убедиться в этом, посмотрите на рисунок 7. В качестве примера здесь показана структура 16S рРНК. Обратите внимание на многочисленные шпильки — самокомплементарные участки РНК, которые обеспечивают ее сворачивание и стабилизируют эту сложную структуру. В линейном виде рРНК не может выполнять свои функции.
Особенностью рРНК также являются химические модификации нуклеотидов. У рРНК модифицированы около 2% всех нуклеотидов, и это необходимо для правильного сворачивания рРНК и выполнения ею своих функций. Модификации рРНК происходят при созревании рибосом. Для осуществления некоторых модификаций необходимы другие виды РНК, например, малая ядрышковая РНК. Примеры химических модификаций нуклеотидов рРНК представлены на рисунке 8.
Второй вид молекул, из которых состоят рибосомы, это белки. Они синтезируются в цитоплазме (с помощью рибосом, как и все другие белки), затем проходят через ядерные поры в ядро. В ядре идёт сборка рибосом, и рибосомальные белки, уже в составе рибосомы, снова возвращаются в цитоплазму. Вот такой сложный у них жизненный путь.
Некоторые из рибосомальных белков очень консервативны. Термин «консервативный» означает, что эти белки мало изменялись в ходе эволюции и очень схожи во всех доменах жизни. Помимо таких «всеобщих» белков в рибосомах также имеются и специфические. Они характерны либо только для эукариот, либо только для архей, либо только для бактерий. У эукариот рибосомальных белков больше, они составляют примерно половину массы рибосомы. У прокариот доля белков в рибосоме меньше — около 40%, а 60% приходится на рРНК. Белки и рРНК тесно взаимодействуют в рибосоме, формируя сложную пространственную структуру. Белковый и рибонуклеиновый состав рибосом бактерий и эукариот показан на рисунке 9.
Внутреннее строение рибосом
Внутри рибосома имеет сложное строение, где как раз и происходит «все самое интересное». Её можно сравнить с пещерой, в которой много полостей, ниш и ходов. Своды этой «пещеры» образованы рРНК и белками, причем ученые до сих пор спорят, как именно они там расположены и как друг с другом взаимодействуют.
Внутри рибосомы выделяют следующие важные части (рис.10):
— сайт связывания иРНК;
— туннель для выхода белка.
Термин «сайт» в данном случае означает «место». О функциях этих сайтов могут рассказать расшифровки названий. А-сайт назван так потому, что сюда приходит аминоцил-тРНК — транспортная РНК, несущая аминокислоту. В Р-сайте находится пептидил-тРНК (peptidyl) — это «предыдущая» тРНК, её аминокислота уже образовала пептидную связь с растущей белковой цепочкой, но все еще связана с принесшей ее тРНК. Е-сайт (от слова “exit” — «выход») нужен для выхода тРНК, которая уже выполнила свою функцию и отдала аминокислоту растущему белку. Поверхности этих сайтов составлены в основном из рРНК, что опять же указывает на их главную роль в функционировании рибосомы.
Для того, чтобы растущий пептид мог выходить из рибосомы, в большой субъединице образован специальный выходной туннель. Стенки этого туннеля сформированы таким образом, чтобы белок не мог там «залипнуть» и быстро проскальзывал наружу.
Образование пептидной связи происходит между аминоацил-тРНК, находящейся в А-сайте и пептидом в Р-сайте. За катализ образования пептидной связи отвечает пептидилтрансфераза (рис.11). По своей природе пептидилтрансфераза — это участок 23S рРНК у прокариот или 28S у эукариот, то есть она является рибозимом. Это место — «святая святых» рибосомы, именно здесь осуществляется одна из ключевых реакций жизни — образование пептидной связи.
В строении рибосомы можно выделить еще и другие важные области — это места связывания с факторами трансляции. Факторы трансляции — это особые белки, которые необходимы для инициации, элонгации и терминации трансляции, без них рибосома функционировать не может. Подробнее о роли этих факторов мы расскажем в статье, посвященной трансляции.
Итак, мы с вами разобрали «морфологию» и «анатомию» рибосомы — как она выглядит внешне и как устроена внутри. Во второй части нашего рассказа вы узнаете, откуда рибосомы берутся в клетке, какими они бывают и как ученые придумали их использовать для установления родства организмов. Ну а в заключительной части мы расскажем о функционировании рибосом и подробнее разберем механизм трансляции.
Источники
1) Farber FE, Rawls WE. Isolation of ribosome-like structures from Pichinde virus. J Gen Virol. 1975 Jan;26(1):21-31. doi: 10.1099/0022-1317-26-1-21. PMID: 1168240.
3) Г.М. Гонгадзе Г.М. 5S рРНК И РИБОСОМА // Успехи биологической химии, Т. 51, 2011, С. 165–192.
4) Рибозимы — катализаторы древнего мира / Доклады Академии наук, Т. 42, №3., 2005, портал «Элементы».
Чего вы не знаете о рибосоме.
Чего вы не знаете о рибосоме.
Рибосомы обладают избирательностью
Автор
Редактор
Статья на конкурс «био/мол/текст»: Еще со школьной скамьи мы знакомы с рибосомой — внутриклеточным органоидом, производящим белки. Роль рибосомы давно перестала быть тайной для человечества. Тут все просто и понятно: используя матричную РНК в качестве «инструкции по сборке»: рибосома последовательно соединяет аминокислоты в длинную белковую цепь. Казалось бы, назначение этого органоида в клетке — разгаданная загадка, и интерес к рибосоме должен вот-вот угаснуть. Но в последние десятилетия в области изучения рибосом совершается колоссальный переворот. И мы можем наблюдать его своими глазами!
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2018.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Белки принимают участие в самых разных клеточных процессах. Например, они могут быть строительными блоками для образования клеточных структур, могут катализировать протекание химических реакций в клетке, осуществлять транспорт молекул из клетки и обратно, а также выполнять некоторые другие важные функции. Понятно, что для нормального роста и развития любой клетке необходимо синтезировать белки. А для их производства, как известно, необходимы рибосомы, ведь именно они отвечают за этот процесс.
Об экспериментах ученых над субъединицами рибосом читайте в статье «Биомолекулы» «Две рибосомные субъединицы объединили в функциональный гибрид» [1].
У «Биомолекулы» есть интересная статья-рассуждение о том, как именно мог сложиться этот «кодовый» язык»: «У истоков генетического кода: родственные души» [3]. Интересно, что генетический код может эволюционировать — «Биомолекула» приоткрывала завесу этой тайны в статье «Эволюция генетического кода» [4].
О том, как ученые исследовали это процесс, «Биомолекула» рассказывала в статье «Рибосома за работой» [5].
Еще несколько увлекательных статей «Биомолекулы» о генетическом коде (и не только) для самых любознательных читателей: «Самые нестандартные генетические коды» [6] и «Таинственный код нашего генома» [7].
Количество рибосом в клетке достаточно велико — более 15 тысяч на одну клетку. Одна рибосома синтезирует белок со скоростью 15–20 аминокислот в секунду. При этом ошибается она достаточно редко — одна ошибка случается на 3000 аминокислот. Если принять, что белки в среднем состоят из 400 аминокислотных остатков, то получается, что рибосома совершает всего 1 ошибку на 7 белков! Таким образом, работа рибосомы — высокоточный процесс, в котором задействовано множество дополнительных молекул. Известный американский биохимик Брюс Альбертс даже сравнил рибосому с «молекулярной машиной», подчеркнув этим слаженность и элегантность работы этого сложного молекулярного комплекса [8].
Рибосома была открыта в 1955 году [9], в то самое время, когда ученые ломали голову над тем, как именно генетическая информация перекодируется из ДНК в белки. Интересно, что уже тогда исследователи обратили внимание на неодинаковость рибосом в клетке (Джордж Паладе заметил, что размеры и формы клеточных рибосом немного различаются [10]). Предполагалось, что эта неодинаковость вызвана их различным составом. Фрэнсис Крик, являясь сторонником данного предположения, даже выдвинул гипотезу, суть которой можно выразить фразой «один ген — один белок — одна рибосома» [11]. Он полагал, что существует некий РНК-посредник (в то время о существовании мРНК еще не было достоверно известно), который после синтеза на ДНК встраивается в рибосому, а она, используя «код» этой РНК, производит белок. Предполагалось, что в клетке должны присутствовать тысячи различных рибосом, каждая из которых «сделана под заказ» для производства одного-единственного белка с использованием одного-единственного РНК-посредника. Но через некоторое время эту гипотезу признали ошибочной. Поскольку главные вопросы молекулярной биологии того времени относились к реализации генетической информации, изучение феномена неодинаковости рибосом отошло на второй план.
Новые вехи в истории рибосомы
Новая волна интереса к рибосомам поднялась в начале 90-х годов прошлого столетия. Возможно, толчком к этому послужили две примечательные работы, посвященные исследованию рибосом на разных стадиях жизни эукариотических организмов — малярийного плазмодия и клеточного слизевика.
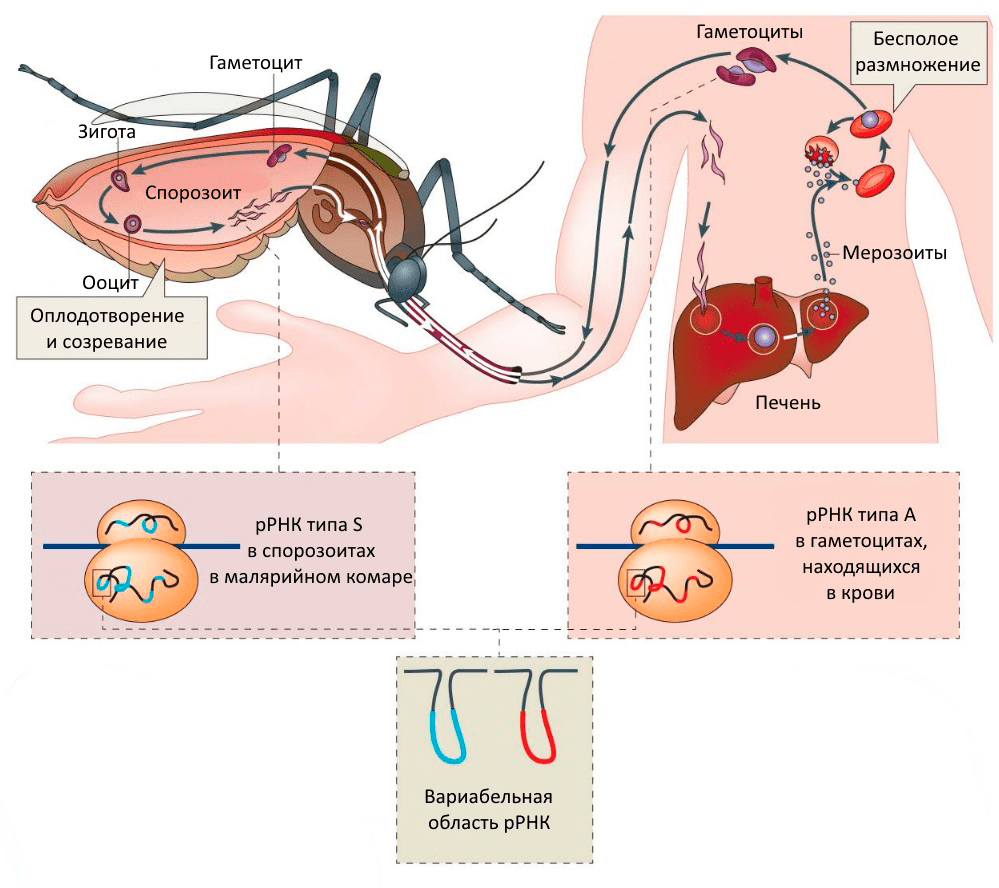
Малярийный плазмодий вызывает у человека тяжелое заболевание — малярию. Заражение происходит после укуса малярийного комара, в слюне которого находится возбудитель болезни. Отличительной особенностью плазмодия является то, что его жизненный цикл состоит из двух частей (рис. 1). Одна часть протекает в теле комара, другая — в теле человека [12].
Рисунок 1. Жизненный цикл малярийного плазмодия
[12], рисунок с изменениями
После укуса спорозоиты плазмодия — мелкие червеобразные подвижные клетки — попадают в кровоток. По кровотоку они достигают печени, где размножаются бесполым путем, превращаясь в одноядерные клетки, называемые мерозоитами. Голодные мерозоиты атакуют клетки крови — эритроциты — и проникают в них. Питаясь гемоглобином, мерозоиты продолжают бесполое размножение. Через некоторое время они разрушают эритроциты и снова выходят в кровь, где набрасываются на новые эритроциты. Это происходит циклично через каждые 48 часов. При разрушении эритроцитов в кровоток попадают и токсичные продукты жизнедеятельности мерозоитов, так что у человека через равные промежутки времени наблюдаются приступы лихорадки с ознобом и высокой температурой.
На стадии выхода из эритроцитов часть мерозоитов приобретает признаки половых клеток (мужских и женских) — образуются гаметоциты. Когда это происходит, плазмодий вступает во вторую стадию жизненного цикла, которая протекает в теле комара. Если комар выпивает кровь больного малярией человека, то в его организме гаметоциты окончательно созревают и превращаются в гаметы. Именно в теле комара гаметы сливаются, образуя оплодотворенную яйцеклетку. Для дальнейшего развития яйцеклетке необходимо попасть в кишечник комара, где она, проходя несколько стадий, образует спорозоиты. Малярийный плазмодий возвращается в то состояние, когда для дальнейшего развития ему снова необходимо попасть в тело человека. Как только комар кусает свою жертву, спорозоиты попадают в кровь, и цикл повторяется.
Так вот, изучая рибосомы малярийного плазмодия, ученые выяснили, что рРНК малой субъединицы рибосомы кодируется двумя генами [13]. Оказалось, что в клетках плазмодия, живущего в москитах, образуется продукт одного рРНК-гена, а в клетках, попавших в млекопитающее или человека, — продукт другого гена рРНК. Выходило, что, во-первых, состав рибосомы может меняться, а, во-вторых, что эти изменения зависят от состояния внешней среды и от фазы жизненного цикла организма.
Похожие результаты, но уже в отношении других компонентов рибосомы — рибосомных белков — несколькими годами позже получили другие ученые.
Dictyostelium discoideum — слизевик, обитающий в верхних слоях почвы, — является излюбленным модельным организмом молекулярных биологов.
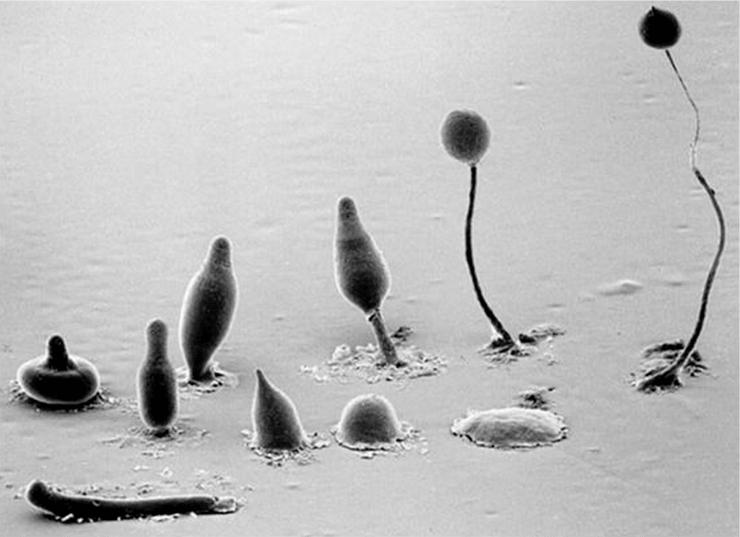
Бóльшую часть жизненного цикла диктиостелиум проводит в виде одноклеточных амёбоподобных форм (миксамёб), питающихся бактериями и дрожжами. При благоприятных условиях (достаточная влажность, нужная температура, наличие питательных веществ) миксамёбы питаются и свободно размножаются делением надвое. Можно сказать, что миксамёбы — индивидуалисты, предпочитающие избегать контактов с сородичами, но когда их численность возрастает и пищевые ресурсы заканчиваются, начинают происходить удивительные вещи. Одна или несколько голодающих клеток принимаются выделять молекулы циклического аденозинмонофосфата (цАМФ) — сигнала «клеточного голода», который одновременно является хемоаттрактантом, привлекающим к источнику сигнала соседних миксамёб. Во время миграции ползущие миксамёбы выделяют и собственное небольшое количество цАМФ, привлекая все больше и больше новых клеток. В результате происходит быстрое объединение огромного количества миксамёб в единый холмообразный агрегат, насчитывающий до нескольких тысяч особей. Так возникает псевдоплазмодий — большое скопление амёбоидных клеток. От обычного плазмодия он отличается тем, что образующие его клетки не сливаются воедино полностью, а, находясь в тесном контакте с соседними клетками, все же сохраняют обособленность и индивидуальность. После агрегации, клетки, находящиеся на вершине «холма», все еще выделяют сигнальные молекулы, и за счет этого продолжают выталкиваться кверху клетками, находящимися у «подножия». Плазмодий вытягивается вверх, а затем заваливается на бок. С этого момента он переходит в стадию «слизня». Мигрируя по направлению к свету и более высокой температуре, слизень достигает поверхности почвы, где в результате перегруппировки и дифференцировки составляющих его клеток формируется плодовое тело. Оно состоит из вытянутого стебелька и находящейся на его вершине споровой коробочки. Споры после созревания рассеиваются ветром, и на новых местах при благоприятных условиях из них выходят миксамёбы, а жизненный цикл слизевика начинается заново (рис. 2) [14].
Рисунок 2. Этапы жизненного цикла слизевика Dictyostelium discoideum
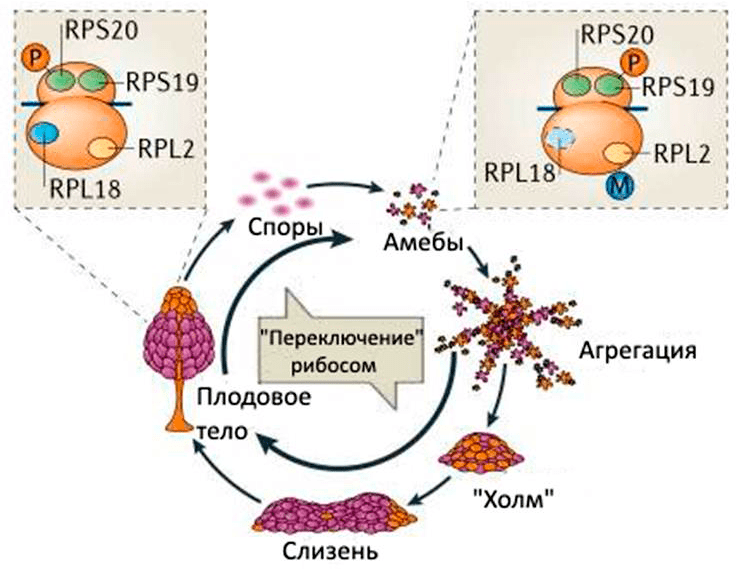
Именно этот необычный жизненный цикл диктиостелиума заинтересовал ученых из Института молекулярной биологии в Нью-Джерси [15]. Они исследовали рибосомы клеток, находящихся на разных жизненных этапах: на стадии одноклеточной миксамёбы (назовем их рибосомы «старыми») и на стадии споры (назовем их рибосомы «новыми»). Из клеток обеих стадий выделили рибосомные белки и количественно сравнили. Результаты были неожиданными. Как оказалось, между стадиями жизненного цикла происходит некое «переключение» состава рибосом, когда «старые» рибосомы утилизируются и на их место приходят «новые», состав которых отличен от первоначального (рис. 3)! В чем состояло отличие? Оказалось, что «новые» рибосомы содержат иные количества некоторых рибосомных белков по сравнению со «старыми». Опять, как и в случае с плазмодием, получалось, что состав рибосом меняется в зависимости от стадии клеточного цикла, но изменениям в данном случае подвергается уже не рРНК, а другой компонент рибосомы — белки.
Рисунок 3. Изменение клеточного состава рибосом слизевика Dictyostelium discoideum в течение жизненного цикла
[12], рисунок с изменениями
Как можно объяснить полученные в ходе этих двух экспериментов данные, фиксирующие изменения в составе рибосом, которые зависят от стадии жизни организма и от условий внешней среды? Знакомясь с научными статьями, посвященными этому вопросу, можно встретить разные рассуждения. Например, такое. Оно опирается на наше знание того, что на разных стадиях жизненного цикла производимый клеткой набор белков примерно схож. Но для каждой стадии существуют и свои характерные белки. По-видимому, для производства таких белков на каждой конкретной стадии необходимы «специальные» рибосомы. При переходе на другую стадию, где требуются иные характерные белки, образуются иные «специальные» рибосомы. Но как рибосома узнает, какие именно белки ей производить? Можно предположить, что для производства «нужных» белков она должна «выбрать» соответствующие им мРНК из всех мРНК, присутствующих в клетке. Как и какие мРНК ей выбрать для трансляции? Опять же можно предположить, что в рибосоме существует некий участок (это могут быть области рРНК, рибосомных белков или те и другие одновременно), взаимодействующий с молекулами мРНК и каким-то образом производящий «селекцию» тех молекул мРНК, которые будут использованы для трансляции. Иными словами, те или иные молекулы, входящие в рибосому, могут напрямую влиять на то, какие мРНК она «выберет» для трансляции и, следовательно, на то, какие белки будут образовываться в клетке [16]. Эти рассуждения приводят к вероятности существования взаимозависимости между набором белков и составом рибосом.
Встречаются и другие рассуждения. Вот еще одно из них. Обновление молекул, включая и те, что входят в рибосому, — это главнейший процесс во время роста и развития клетки. Поэтому можно рассматривать синтез «новых» рибосом как механизм поддержания стабильности этих органелл и их функциональной целостности для обеспечения выживаемости организма [17]. Например, в случае со слизевиком ученые обнаружили, что малая (40S) субъединица рибосом у спор более устойчива к воздействию температуры, чем малая субъединица рибосом миксамёб. Возможно, именно «новые» рибосомные белки обеспечивали эту стабильность. Эти рассуждения могут приводить к мысли о том, что рибосомы способны играть роль в поддержании гомеостаза для повышения выживаемости организма.
Во времена описываемых опытов образование зрелой 80S рибосомы из двух субъединиц являлось загадкой, но третий вариант рассуждений [16] был приближен к современному и опирался на то, что для соединения двух субъединиц в одну зрелую крайне важно взаимодействие рРНК и рибосомных белков. Однако было непонятно, какую именно роль играют рРНК и рибосомные белки в образовании ее функциональных областей. Предполагалось, что рРНК крайне важна для производства белковой цепи, и ее «правильная» структура необходима для протекания разных этапов этого процесса. А вот рибосомные белки нужны именно для создания такой структуры. Они являются каркасом для правильного расположения рРНК в зрелой рибосоме. Таким образом, назначение «переключения» белкового состава рибосом — регулировать пространственную структуру рибосомы, обеспечивая доступ к ее участкам, необходимым для трансляции белков именно на данном этапе жизненного цикла.
Проведенные опыты позволили ввести понятие гетерогенной популяции рибосом — то есть такой популяции, в которой один или несколько структурных компонентов (рибосомные белки или рибосомные РНК) зрелой органеллы подвергались изменениям (качественным или количественным) в течение жизненного цикла клетки.
Возникало множество вопросов. Например, какое из приведенных выше суждений справедливо, какая теория верна? Какую все-таки роль играют рибосомные белки и рРНК в функционировании рибосомы? Влияют ли они на синтез специфических молекул, характерных для клеток определенных стадий и тканей? Каков механизм «переключения» состава рибосомы? Существуют ли гомогенные популяции рибосом, то есть такие, состав которых не меняется? А также возникали многие другие вопросы, ответов на которые в то время не было.
Рибосома — молекулярный фильтр?
В данной статье невозможно описать все эксперименты, проведенные исследователями во время поиска ответов на эти вопросы, хотя многие из них были крайне смелыми и новаторскими и, несомненно, увлекли бы читателя. Но мы ограничимся наиболее значительными, а также опишем ключевые научные идеи, лежащие в основе современного взгляда на рибосому.
В самом начале нового тысячелетия возникла гипотеза рибосомного фильтра [18]. Заслуга авторов этой гипотезы, Винсента Мауро и Геральда Эдельмана, в том, что они, проанализировав и обобщив накопившиеся к тому времени данные, предложили совершенно новый взгляд на рибосому и на принцип ее функционирования. Если раньше рибосома рассматривалась как пассивная структура, с машинной точностью воспроизводящая генетическую информацию, то новый взгляд, предложенный авторами, возводил рибосому в новый ранг, и теперь ей приписывалась неожиданная роль в управлении фундаментальными клеточными процессами. Она приобретала звание «фильтра», который из общего потока клеточных мРНК отсеивает некоторую часть с заданными свойствами и на их основе производит белок. Остальные же мРНК она для трансляции не использует. Авторы предложили и механизм «отсеивания».
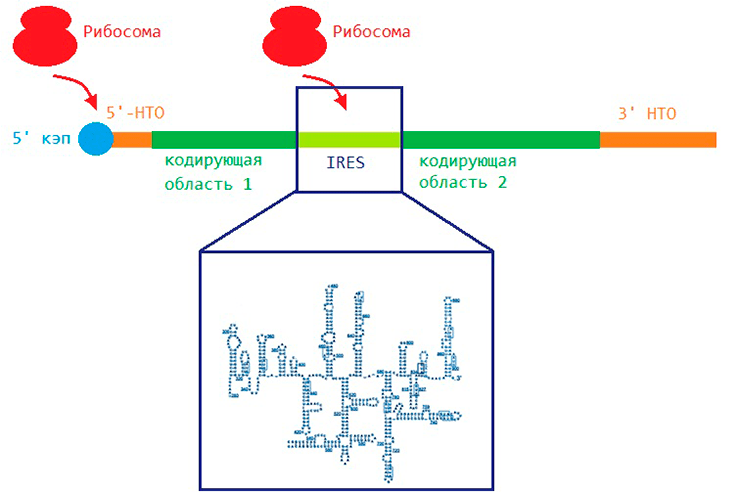
Дело в том, что в мРНК есть не только области, кодирующие аминокислотную последовательность белка, но и области, имеющие чисто регуляторное назначение (рис. 4). С их помощью начинать синтезировать белок рибосома может по двум разным механизмам.
Рисунок 4. Белки могут образовываться двумя разными способами. Слева изображен кэп-зависимый механизм начала трансляции. Рибосома садится на кэп, который располагается на одном из концов мРНК, в так называемой нетранслируемой области (НТО), так как она не «переводится» в белок, а является чисто регуляторной. Справа — кэп-независимый механизм. Рибосома садится на IRES, который, благодаря своей сложной пространственной структуре (в рамке), направляет ее к старт-кодону.
рисунок автора статьи
Первый носит название кэп-зависимого, или сканирующего. На одном из концов молекулы мРНК имеется специальная структура — кэп (молекула 7-метилгуанозина), на который перед началом синтеза садится рибосома. Сев, она движется вдоль молекулы мРНК, сканируя ее на предмет старт-кодона, кодирующего первую аминокислоту белка. Найдя старт-кодон, рибосома начинает синтез.
При втором механизме, кэп-независимом, характерном в основном для вирусов, рибосома садится на специальную область, называемую IRES (Internal Ribosomal Entry Site; в переводе с англ. — «сайт внутренней посадки рибосомы»), которая и направляет ее к старт-кодону.
Так вот, гипотеза рибосомного фильтра предполагала, что «фильтрование» происходит за счет специфического взаимодействия рибосомных белков и рРНК с определенными областями мРНК, которые могут запускать синтез белка по схожему с IRES принципу. Такие взаимодействия должны носить конкурирующий характер. Это значит, что мРНК, обладающие одинаковыми или схожими областями, будут соперничать за связывание с рибосомой, и эффективность их трансляции будет различна.
Способность клетки менять состав рибосом также имеет огромное значение для работы «фильтра». Добавление или утрата некоторых компонентов может приводить к пространственной недоступности областей рибосомы, взаимодействующих с мРНК, а значит, будет блокировать и синтез некоторых белков. Именно так, по мнению авторов гипотезы, могла меняться специфичность «фильтра».
Гипотеза рибосомного фильтра породила другую гипотезу — о специализации рибосом [19]. Специализация — следствие гетерогенности, то есть избирательность рибосом в отношении мРНК, которая приводит к синтезу только каких-то определенных белков, закодированных в «избранных» рибосомой молекулах мРНК. К сожалению, ввиду отсутствия приборов и методов, с помощью которых можно было бы экспериментально проверить описанные идеи, эти гипотезы так и оставались гипотезами некоторое время.
Гипотезы приобретают подтверждение
Несомненно, двадцать первый век — век высоких технологий, позволяющих человеку совершать то, что раньше казалось выдумкой ученых-фантастов. И молекулярные биологи активно пользуются результатами научно-технического прогресса в своих научных изысканиях. Благодаря интенсивному развитию техники, несколько лет назад сразу обе гипотезы нашли свое экспериментальное подтверждение [20]. С помощью самых современных технологий установили, что рибосомы модельного объекта — стволовой клетки эмбриона мыши, не обладающей таким сложным жизненным циклом, как клетки диктиостелиума или малярийного плазмодия, также гетерогенны, то есть отличаются друг от друга составом входящих в них белков. Получается, что и клетки млекопитающих содержат неодинаковые по составу рибосомы!
Дальше — больше. Оказалось, что в одной и той же клетке присутствует не одна гетерогенная популяция рибосом, как полагали ранее, а сразу несколько таких популяций! Они не сменяют друг друга, а сосуществуют одновременно. Было экспериментально доказано, что каждая из популяций преимущественно осуществляет трансляцию только определенного набора мРНК. Это означает, что рибосомы не универсальны, то есть не способны транслировать абсолютно любую молекулу мРНК, как считалось ранее. Отдельные группы рибосом взаимодействуют только с некоторыми мРНК и, следовательно, «отвечают» за синтез лишь части клеточных белков. Было доказано, что избирательность рибосом вызвана именно присутствием определенных рибосомных белков, которые, предположительно, связываются с некими регуляторными областями в мРНК. Но точный механизм этого процесса требует дальнейших исследований.
Итак, получается, что функции рибосомных белков более обширны, чем мы были склонны думать ранее! Благодаря изменениям состава рибосомы клетка может регулировать, какие гены будут «превращены» в белки, а какие нет, в соответствии с ее нуждами.
Что же дальше?
Пока рано говорить о том, куда приведут нас исследования гетерогенности рибосом. Несомненно, они позволят человечеству лучше понимать механизмы многих заболеваний, в том числе онкологических.
Например, уже выявлены заболевания, именуемые рибосомопатиями, причиной которых являются генетические мутации компонентов рибосом [21].
Анемия Даймонда—Блэкфана — типичный пример рибосомопатии, выявляется в течение первого года жизни ребенка. Это заболевание названо в честь врачей, впервые его описавших и классифицировавших в 30-е годы двадцатого века. Оно относится к числу редких, встречается в пяти случаях из миллиона, с одинаковой вероятностью и у мальчиков, и у девочек. Первичным симптомом болезни является повышенная бледность кожи ребенка, описаны случаи рождения детей с «заячьей губой». К возрасту шести месяцев могут появиться такие симптомы как увеличение размеров печени и селезенки, нарушения работы сердечно-сосудистой системы. Также происходит процесс торможения выработки эритроцитов в костном мозге, из-за чего наблюдаются бледность, вялость, быстрая утомляемость. При отсутствии лечения заболевание приводит к тяжелой сердечной недостаточности и смерти. Как оказалось, причиной, вызывающей анемию Даймона—Блэкфана, являются мутации в генах, кодирующих некоторые рибосомные белки, что приводит к неправильной работе рибосом, снижению их количества в клетках и, как следствие, негативным последствиям.
В заключение
История рибосомы, начавшаяся более шестидесяти лет назад, — яркий пример процесса научного поиска, который привел к изменению нашего взгляда на работу и функции рибосомы. Сейчас мы не можем сказать, чем закончится эта история, к каким результатам и открытиям она приведет.
В науке не бывает незначительных результатов. Мы, обыватели, привыкли, что ее достижения влияют на нашу жизнь, а, следовательно, должны быть масштабными и иметь непосредственное практическое применение. Например, открытие пенициллина — первого антибиотика — позволило спасти миллионы жизней и дало виток новому направлению исследований, до сих пор не утратившему актуальности. Масштаб и польза налицо. Однако нам следует помнить, что в области познания не бывает «больших» и «малых» достижений. Любой научный результат — это всегда движение вперед, это всегда большая победа, созданная огромным кропотливым трудом целой плеяды ученых. Так же и исследования рибосомы. Возможно, они станут еще одним штрихом, добавленным учеными к нашей картине мира, а возможно, приведут к колоссальному прорыву, например, в лечении онкологических заболеваний.