Что сильнее трамадол или тапентадол
Что сильнее трамадол или тапентадол
Интенсивность боли определяет больной, а не его родственники.
Для оценки эффективности лечения рекомендуется ведение дневника боли с фиксированием даты, времени приема, дозы, пути введения, продолжительности действия и побочных эффектов.
Ступень 1. Лечение слабой боли начинают с нестероидных противовоспалительных средств, которые продаются в любой аптеке без рецепта врача. Препараты подбираются с учетом противопоказаний и индивидуальной переносимости больного. Чем эффективнее лекарство снимает боль, тем вреднее оно для желудка, поэтому при высоком риске гастропатии одновременно рекомендуется омепразол или нольпаза.
Ступень 2. Лечение боли умеренной интенсивности.
На этом этапе к максимальной дозе нестероидного противовоспалительного препарата добавляется минимально эффективная доза трамадола в таблетках. Постепенно доза трамадола увеличивается до 400 мг в сутки (по 50 мг до 8 раз в день или по 100 мг 3-4 раза в день), а таблетки меняются на внутримышечные инъекции по 100 мг 4 раза в сутки каждые 6 часов. Обезболивающее действие наступает через 30-40 минут после приема таблетки или через 5-10 минут после внутримышечной инъекции. Длительность действия от 4 до 6 часов.
Побочные действия. Трамадол часто вызывает тошноту с рвотой, запоры и сонливость. При тошноте и рвоте таблетки можно заменить на инъекции.
Медикаментозная коррекция побочных эффектов такая же, как и при обезболивании на 3 ступени (см. ниже).
Взаимодействие с другими препаратами:
Транквилизаторы, седативные средства взаимно потенцируют эффекты.
Осторожность необходима при одновременном назначении с нейролептиком, антидепрессантом, карбамазепином. Нельзя вводить в одном шприце с диклофенаком, реланиумом.
Комбинации снижают болевой синдром меньшей дозой трамадола и позволяют как можно дольше задержаться на 2 ступени обезболивающей лестницы. При грамотном обезболивании потребность в наркотических анальгетиках можно значительно отсрочить.
При умеренной боли вместо трамадола врач может назначить пластырь дюрагезик 12,5 мкг/час или таргин в таблетках в дозе 2,5 мг/5 мг
Лечение слабой, умеренной и сильной боли у паллиативных пациентов
Что такое боль?
Прежде чем мы будем говорить про особенности лечения болевого синдрома разной степени выраженности и использования для этого наркотических и не наркотических средств, в зависимости от потребностей пациентов, нам нужно ответить на вопрос: что такое боль?
Боль – это неприятное физическое ощущение, эмоциональное переживание, связанное с реальным и потенциальным повреждением тканей. Уточним, что боль – это не только физическое страдание тела, но и эмоции, которые испытывает человек, страдающий от нее.
Иногда врач не может найти источник боли, например, пораженный орган, но пациент жалуется на боль, и в таких случаях пациенту надо верить.
У паллиативных пациентов часто возникает хронический болевой синдром из-за различных опухолей. При развитии опухолевого процесса выделяется много биологически активных веществ: это и внеклеточные ионы водорода, и факторы некроза опухоли, они воздействуют на периферическую нервную систему и усиливают сигнал, который поднимается вверх и раздражает головной мозг. В результате формируется патологический очаг, который делает невозможной нормальную жизнь человека.
Вот как это происходит. Раздражение болевых рецепторов формирует болевой импульс, потом на уровне спинного мозга появляется ощущение боли, каскадная реакция запускает переживание боли, переживание боли происходит на уровне центральной нервной системы в гипоталамо-гипофизарной области и в коре головного мозга. Эта каскадная реакция, как круги по воде, расходясь, формирует болевое поведение. Оно выражается в том, с чем приходит к нам пациент, как он себя ведет, в какой позе находится, как переживает эту боль, как критично он к ней относится, как все, что связано с болью, нарушает его жизнь.
Как лечить хронический болевой синдром?
Идеально использовать неинвазивные формы введения лекарств для лечения хронического болевого синдрома. Если пациент не может глотать, то, чаще всего используем трансдермальные (наружные, в виде пластырей) терапевтические системы по часам.
Мы не дожидаемся, когда у пациента разовьется боль, а подбираем схему обезболивающей терапии таким образом, чтобы боль не возникала, не усиливалась.
Детали требуют очень внимательного отношения. Назначая обезболивающую терапию, особенно если мы используем сильные опиоиды, мы всегда должны понимать: назначив наркотическое средство, сразу же нужно начинать профилактику побочных эффектов.
Напомню о трехступенчатой лестнице обезболивания ВОЗ. Болевой синдром оценивается по шкале от ноля до десяти, где ноль – нет боли, а 10 – нестерпимая боль.
На первой ступени (уровень боли от 1 до 3) мы используем парацетомол или препараты НПВС (нестероидные противовоспалительные препараты).
На второй ступени (при умеренной боли, если болевой синдром от 4 до 6) мы используем либо слабые опиоиды, либо малые дозы сильных опиоидов.
Обратите внимание, что на второй и третей ступенях возможно использование препаратов первой ступени и обязательна адьювантная (вспомогательная) терапия.
Вне зависимости от степени выраженности болевого синдрома, если пациенту показаны адьюванты (например, при нейропатическом характере боли), они должны применяется обязательно! Потому что, даже используя базовое наркотическое средство при нейропатической боли, без адьювантной терапии мы никогда не добьемся обезболивающего эффекта.
Как лучше вводить препараты?
Лучше всего вводить препараты через рот и через кожу с использованием трансдермальной терапевтической системы. Эти формы очень удобны и легко применимы при использовании на дому – как для пациента, так и для родственников. Они удобны и для использования в стационаре. А теперь поговорим о других путях.
Подкожно
Внутримышечно, внутривенно или ректально
Лучше не использовать внутримышечные инъекции, потому что препараты местно вызывают раздражение, пациентам некомфортно. Лучше вводить препарат подкожно.
Photo: Creators Collective / Unsplash
Ректальный путь используется крайне редко, при невозможности применения таблетированных или инъекционных форм.
Использование препаратов в зависимости от значений шкалы боли
В наше время разработана шкала боли, на основании шкал из трехступенчатой лестницы обезболивания. Ей удобно пользоваться. Она показывает, какие препараты должны использоваться при той или иной выраженности болевого синдрома, позволяет оценить степень боли. Обратите внимание, в этой шкале не названы препараты, которые используются инъекционно. Почему? Потому что мы делаем акцент на том, что при лечении хронического болевого синдрома нужно использовать неинвазивные формы, менее травматичные для пациентов.
Лечение слабой боли
Остановимся на лечении слабой боли. Это первая ступень лестницы обезболивания: придя к нам, пациент с таким уровнем боли будет оценивать ее по шкале от одного до трех. На вопрос «Как у Вас болит?» он может ответить: «Если брать шкалу от 0 до 10, где 0 – не болит совсем, а 10 – боль нестерпимая, то у меня – где-то 1-2». В этой ситуации мы используем препараты из группы НПВС или парацетамол.
Препараты этой группы при необходимости можно сочетать со слабыми и сильными опиоидами, поскольку НПВС потенциируют (усиливают) действие опиоидов.
Теперь поговорим о конкретных препаратах из группы НПВС.
Парацетамол
Что касается побочных эффектов, то парацетамол, в первую очередь, гепато-, и нефротоксичен. Даже 4 грамма парацетамола могут вызвать развитие острой печеночной недостаточности, а дозировка 10-12 граммов вызывает острую печеночную недостаточность, и это ситуация, несовместимая с жизнью практически у всех пациентов. Поэтому необходимо очень аккуратно назначать парацетамол, несмотря на то, что это препарат выбора у пациентов с деменцией.
Еще нужно помнить, что максимальная продолжительность приема парацетамола при использовании максимальных суточных доз не должна превышать 5-7 дней.
Местные анестетики
Теперь поговорим о местных анестетиках.
Например, у вас есть пациент с большим опухолевым распадом, с обширной раной или пролежнем. Такого человека нужно обезболить, и, как вы понимаете, в этой ситуации уже не работают препараты из группы НПВС и слабые опиоиды. Даже сильные опиоиды не дают достаточного эффекта, и при перевязках пациент испытывает боль.
В этом случае добавьте местный анестетик за 30-40 минут до перевязки. В результате у пациента снизится патологическая пульсация, которая возникает при раздражении ноцицептивных рецепторов и перераздражает кору головного мозга. Местные анестетики, которые вы добавили прервут или уменьшать поток болевых импульсов от ноцицептивных рецепторов к задним рогам спинного мозга, благодаря анестетикам, они будут осознаваться корой головного мозга как менее выраженная боль.
Опиоиды
Опиоиды работают на уровне задних рогов спинного мозга и центральной нервной системы, но важно помнить, что часто к опиоидам нужно обязательно добавлять адъюванты. Например, при нейропатической боли, при большом опухолевом распаде, больших пролежнях и незаживающих язвах. Скажем, у пациента есть опухоль, которая сдавливает нервные стволы или большое количество окружающих тканей.
В этом случае добавьте местные анестетики, добавьте антиконвульсанты или препараты этой группы, и вы облегчите состояние больного. Адъюванты работают очень хорошо, их нужно использовать при нейропатической боли и боли, вызванной поражением костей.
Когда у пациента большой опухолевый распад или массивная рана, пульсация с периферии значительно усиливает боль, в этом случае нужно использовать адъюванты: антидепрессанты, антиконвульсанты, глюкокортикостероиды, миорелаксанты.
Из антидепрессантов чаще всего используется амитриптилин – неоднозначный препарат. Это препарат, который требует накопления, его дозу нужно наращивать постепенно: сначала назначаем по полтаблетки на ночь, потом, в зависимости от реакции пациента, добавляем второй прием и оцениваем эффект.
Дексаметазон
Дексаметазон – это отличный препарат, который используется в паллиативной помощи и в лечении болевого синдрома. В него входит множество компонентов, которые помогают купировать боль. Он незаменим в ситуации, когда нужен противоотечный эффект, например, при отеке головного мозга, метастазах или первичной опухоли.
При заболеваниях гортани, глотки, когда сильная опухоль сдавливает нервные стволы, этот препарат помогает уменьшить отек и слегка уменьшить объем опухоли. В результате боль станет существенно меньше.
Дексаметазон помогает и в сложных ситуациях: если есть метастазы в позвоночник с разрушением позвонков, со сдавливанием нервных стволов, на периферии.
Конечно, этот препарат тоже токсичен, но в таких ситуациях, если у пациента в анамнезе нет активного язвенного процесса, его можно назначать.
Теперь я напомню базовые вещи при применении препаратов перорально. Их нужно давать после приема пищи.
Миорелаксанты
Лечение умеренной (средней) боли
Для пациентов с умеренной болью есть два препарата: Трамал (трамадол) и Палексия (тапентадол). Если слабые опиоиды неэффективны или, допустим, есть противопоказания, то мы начинаем использовать низкие дозы сильных опиоидов, и не надо этого бояться. Особенно если речь о пожилых людях.
Достоинство трамадола – в его минимальном наркогенном эффекте: физическая и психическая зависимости при его приеме практически не развиваются. У препарата есть активизирующее действие, то есть на фоне приема трамадола человек может быть несколько возбуждённым, тревожным, у него может развиваться бессонница, появляться тахикардия, тремор, повышаться давление. Поэтому нужно правильно подбирать минимальную дозу и помнить, что увеличение суточной дозы трамадола свыше 400 мг не приведёт к усилению эффекта, в связи с чем не надо доводить дозу до 600 мг.
Также нужно помнить, что качество этого препарата очень сильно зависит от производителя: есть производители, чей препарат обладает, к сожалению, сильно выраженными побочными действиями, поэтому некоторые пациенты плохо переносят трамадол.
Для пациентов старше 65 лет есть ограничения: суточная доза трамадола не должна превышать 300 мг. Пациентам с когнитивными нарушениями, с почечной и печёночной недостаточностью трамадол не назначается.
Также этот препарат не рекомендуется использовать вместе с трициклическими антидепрессантами (амитриптилином), потому что при их сочетании у пациента может развиться серотониновый криз: он станет тревожным, беспокойным, появится тремор. Такое состояние серьезно снижает качество жизни человека.
Трамадол не сочетается также с сильными опиоидами: если пациента перевели с трамадола, например, на трансдермальную терапевтическую систему, при прорывах боли не надо одновременно назначать трамадол и фентаниловый пластырь! Это убийственная схема, потому что в этой ситуации будет работать только трамадол, фентанил – работать не будет, он тут совершенно бесполезен. В результате пациент будет испытывать боль и до бесконечности наращивать дозу трансдермальной терапевтической системы.
Палексия
Это хороший относительно новый на фармацевтическом рынке препарат, выпускается в дозировках 50 и 100 мг, планируется ввоз в РФ в дозировке 150мг и в более высоких дозировках (200мг, 250мг).
Какие у него достоинства? Это препарат выбора для пациентов 65+, для пациентов с когнитивными нарушениями, он в меньшей степени вызывает запоры и эффективен для больных с суставными болями. Кроме того, он пролонгированный, анальгезия – до 12 часов, то есть в сутки используется всего две таблетки.
Если говорить о недостатках препарата, на российском фармацевтическом рынке нет коротких форм Палексии, поэтому титровать его неудобно. В некоторых регионах этот препарат не включен в социальную льготу, при этом он довольно дорогой для пожилых пациентов: в среднем упаковка стоит от 800 рублей.
Когда переходить на сильные опиоиды?
Если слабые опиоиды не работают, нужно переходить на низкие дозы сильных опиоидов. Используйте любой из сильных опиоидов, не бойтесь активно их применять.
Что здесь еще важно? В ситуации, когда мы переводим пациента с трамадола на сильные опиоиды, очень сложно объяснить родственникам и самим пациентам, что это необходимо. Поэтому предлагаем очень простой алгоритм действий.
Лечение сильной боли
Photo: Franck V. / Unsplash
Если мы планируем перевести пациента на пролонгированные морфины, у нас есть прекрасный спектр дозировок этого препарата: 10, 30, 60 и 100 мг.
Инъекционный морфин – это хороший препарат, который мы можем титровать, подбирать дозу. Он начинает действовать через 30-40 минут. С его помощью можно легко купировать любой прорыв боли. Этот препарат также используется у пациентов в терминальной стадии и при длительной инфузии.
Промедол
Не используйте этот препарат!
Достоинства пролонгированных форм
При использовании таблетированных пролонгированных форм концентрация препарата снижается медленно, и пациент до приема следующей дозы не чувствует боли, а риск передозировки препарата сведен к минимуму.
Photo: pina messina / Unsplash
Таргин и Бупраксон за счет наличия в их составе налоксона совершенно не интересен наркоманам, потому что это антидот, антагонист опиоидных рецепторов, и если растворить таблетку препарата и ввести его внутривенно, вместо предвкушаемого удовольствия наркоман получит абстиненцию.
Таргин
Достоинства: удобно использовать за счет различных дозировок, меньше приводит к запорам.
Бупраксон
У этого препарата соотношение бупренорфина с налоксоном практически один к одному. Бупраксон это – препарат выбора при почечной недостаточности, потому что, в отличие от других наркотических средств, он выводится через желудочно-кишечный тракт. Он был разработан для использования при диагностических манипуляциях, при ожогах, для лечения в хирургической практике, но очень хорошо работает при нейропатической боли. Мы используем его перед перевязками и у больных с почечной недостаточностью. Как базовый препарат назначаем по 1-2 таблетки под язык каждые 6-8 часов, эффект наступает через 30 минут, максимальное действие 2-3 часа.
Использование трансдермальных терапевтических систем (ТТС)
При использовании ТТС важно учитывать, что они дают более пологую кривую концентрации в крови, которая практически не меняется.
Напротив, наркогенный потенциал инъекций растет, и пациенту нужно увеличение дозы или кратности приема препарата.
Из-за неплотного прилегания ТТС у пациентов с сухой кожей, гипергидрозом, с температурой, с кахексией нет возможности первоначального накопления препарата в «депо», поэтому у таких пациентов ТТС нельзя использовать.
У ТТС есть три поколения.
Первое – это препарат Дюрогезик. В его резервуаре было чистое действующее вещество и тонкая мембрана. После наклеивания пластыря на кожу существовал высокий риск разрыва мембраны и высвобождения большого количества фентанила, что приводило к токсическому воздействию на организм большой дозы препарата. Поэтому, например, пластыри нельзя апплицировать на свежевыбритую кожу (острые бритые волоски могут разорвать мембрану) или на кожу с оволосением (не будет полного прилегания).
Второе поколение ТТС – Дюрогезик Матрикс. Опасность передозировки у препарата существенно ниже, потому что действующее вещество находится в матрице, как в губке, и высвобождение идет медленнее, за 10-12 часов.
Третье, современное поколение, ТТС – Дюрогезик Матрикс с мембраной.
Достоинства ТТС
Препарат нельзя использовать у больных без подкожно-жировой клетчатки (кахексичных), с температурой, гипергидрозом, желтухой, сухими или поврежденными кожными покровами, заболеваниями кожи.
В области применения возможен контактный дерматит.
Нельзя применять вместе ТТС и трамадол!
Нужно помнить, что пластырь с ТТС не наклеивают на больное место – так он местно не действует, он имеет системный эффект.
При аппликации пластыря важно обеспечить его плотный контакт с кожей. Поэтому нельзя клеить его на волосы, на бритую, сухую, поврежденную или влажную кожу.
ТТС наклеивается в места с подкожно-жировой клетчаткой: предплечье, грудная стенка, лопатка, внутренняя поверхность бедра. Однако в последнем случае возникают сложности со сменой памперса.
Каждые 72 часа меняется место локализации ТТС. В течение этого времени нельзя принимать ванну или душ, чтобы пластырь не отклеился, но можно обтирать пациента влажными полотенцами. Ванну или душ можно принять в момент смены пластыря.
Если пациент утратил возможность принимать препараты перорально и трансдермальная терапевтическая система тоже нельзя применять (кахексия), нужно переходить на суббукальные и сублингвальные формы: Просидол, Бупраксон.
Заключение: основные рекомендации по обезболиванию паллиативных пациентов
Главные рекомендации по обезболиванию паллиативных пациентов следующие:
Ниже публикуем таблицу оформления рецептурных бланков на обезболивающие препараты, облегчающую врачам процедуру выписки рецептов.
Материал подготовлен с использованием гранта Президента Российской Федерации на развитие гражданского общества, предоставленного Фондом президентских грантов.
Что сильнее трамадол или тапентадол
Научно-исследовательский институт ревматологии им. В.А. Насоновой, Москва, Россия
Введение
Остеоартрит (ОА) – одна из наиболее частых причин хронического болевого синдрома наряду с болью в нижней части спины и головной болью. Число пациентов, страдающих ОА, постоянно увеличивается в связи со старением населения и нарастанием распространенности ожирения. Боль, обусловленная тяжестью ОА, приводит не только к инвалидизации пациента, ухудшению качества жизни, но и к уменьшает ее продолжительности, являясь значимым предиктором риска смерти [1].
Пациенты с ОА используют различные обезболивающие средства и методы, среди которых несомненным лидером остаются нестероидные противовоспалительные препараты (НПВП). Однако, несмотря на проводимое лечение, от 27 до 61% больных продолжают испытывать хроническую боль (ХБ) и не удовлетворены терапией [2].
Особенности болевого синдрома при остеоартрозе
Основной причиной болевого синдрома при ОА считаются воспалительные и дегенеративные изменения в суставе и околосуставных тканях. Однако обследование и наблюдение за пациентами с ОА в ряде случаев свидетельствуют, что интенсивность боли не всегда коррелирует с деструктивными изменениями [3] и оперативное лечение зачастую не избавляет пациента от болевого синдрома. До 44% пациентов после адекватно выполненного эндопротезирования коленного сустава и до 27% – тазобедренного продолжают испытывать боль [4].
Эти факты можно объяснить тем, что болевой синдром при ОА может иметь смешанный характер, включая признаки ноцицептивной боли и боли при центральной сенситизации (ЦС) [5].
ЦС определяют как усиление нервных сигналов в центральной нервной системе, что обеспечивает гиперчувствительность к боли – иными словами, это гипервозбудимость центральных ноцицепторов, в результате которой снижается их порог возбуждения и они сами начинают генерировать болевые импульсы, становясь источником боли [6, 7]. Впервые ЦС при формировании ХБ была описана C. Woolf в 1983 г. [8]. Длительно существующее в суставе воспаление приводит к гиперчувствительности периферических афферентных нейронов, т.е. формируется периферическая сенситизация [9]. При продолжающейся периферической сенситизации в центральной нервной системе происходят нейропластические изменения и возникает ЦС – главный механизм патогенеза хронического болевого синдрома [3, 10].
ЦС сопровождают следующие феномены: прогрессивное нарастание активности нейронов (феномен взвинчивания – wind-up), при котором нейроны становятся более восприимчивыми к повторяющимся стимулам; повышенная чувствительность к боли в интактных тканях, располагающихся далеко от зоны повреждения (вторичная гипералгезия); возрастание амплитуды и продолжительности нейронного ответа; уменьшение порога возбуждения, когда неболевые в норме стимулы активируют ноцицепторы (аллодиния) [11, 12].
Классическим примером ЦС служит фибромиалгия – заболевание, при котором нет ни воспаления, ни поражения суставов [13], а причиной является дисфункция болевой системы. Согласно данным последних исследований, явления ЦС могут встречаться не только при фибромиалгиях, но и при мигрени, боли в шее, тазовой боли, синдроме хронической усталости и др., а также при ревматических заболеваниях [14–17].
В результате хронического воспаления в суставе и его деструкции возбуждаются периферические болевые рецепторы и болевые импульсы по периферическим нервам передаются в задние рога спинного мозга. Они находятся под контролем противоболевых (антиноцицептивных) систем, деятельность которых направлена на модуляцию боли. При условии продолжающегося возбуждения, в данном случае воспаления в суставе, и слабости антиноцицептивных систем возникает ЦС.
По сравнению с ноцицептивной ХБ пациенты с ЦС сообщают о более интенсивном болевом синдроме, большем его влиянии на качество жизни, более выраженном нарушении функциональной активности, депрессии и тревоге [18].
Причины возникновения ЦС до сих пор не установлены, но можно обсуждать генетические и внешние средовые факторы. Если у пациента есть ЦС, то в клинической картине может наблюдаться быстрый переход в ХБ и недостаточный ответ на лечение [19, 20].
ЦС в спинальных и супраспинальных болевых нейронах изменяет клинические характеристики болевого синдрома. Появляются нейропатические симптомы (жжение, покалывание, онемение, прострелы током и др.), которые в отличие от собственно нейропатической боли локализуются в анатомически нелогичных зонах, т.е. топически не соответствуют какому-либо поражению соматосенсорной нервной системы. При ОА ЦС по опроснику Pain DETECT встречается у 28–30% пациентов [21–24], нейропатические характеристики боли при описании своих жалоб используют до 34% больных [25].
Наличие ЦС у пациентов с ОА подтверждается значительно более низким порогом боли на давление по сравнению со здоровой контрольной группой.
В исследовании M. Imamura et al. [26] для определения состояния нервной системы у 62 женщин с ОА коленного сустава оценивались пороги боли на давление в мышцах, связках, сухожилиях и коже нижней конечности. Было показано, что у всех больных ОА отмечались достоверно более низкие пороги боли на давление. Такое снижение коррелировало с высокой интенсивностью боли, низким качеством жизни, низкой функциональной активностью и нетрудоспособностью.
В другой работе L. Arendt-Nielsen et al. [27] производили оценку ЦС при помощи измерения порогов боли на давление (в области сустава и в отдаленной точке) у 48 женщин с ОА коленного сустава и у 24 здоровых женщин. Были выявлены достоверно более низкие пороги боли на давление у больных ОА как в области сустава, так и в отдаленной точке. Была показана обратная корреляция между значениями интенсивности боли и средними показателями порогов боли на давление в отдаленной точке.
Патогенетическая терапия наиболее эффективна при лечении ХБ. Оказывая противовоспалительное действие в области пораженного сустава, НПВП способны уменьшать ноцицептивную импульсацию. Однако их прием сопряжен с высоким риском развития нежелательных явлений со стороны как желудочно-кишечного тракта, так и сердечно-сосудистой системы. Таким образом, пациентам с тяжелой сопутствующей патологией необходим подбор противоболевой терапии с учетом их анамнеза. Ноцицептивные импульсы с периферии играют важную роль в клинической картине ХБ, однако фармакологические средства периферического действия не способны уменьшать ЦС. Только препараты центрального действия могут воздействовать на процессы, вовлеченные в ЦС, поэтому наряду с традиционной терапией пациентам с признаками ЦС следует назначать комплексное лечение, включающее также препараты центрального действия.
Опиоидный анальгетик тапентадол PR
Новый сильнодействующий анальгетик центрального действия тапентадол PR, обладающий двойным механизмом действия, связывается с мю-опиоидными рецепторами, а также ингибирует обратный захват норадреналина (НА) [28].
Мю-рецепторы, самый изученный тип опиоидных рецепторов, локализуются в нервной системе, а также в желудочно-кишечном тракте и других тканях. Среди регулируемых ими функций следует отметить ноцицепцию, дыхание, память, обучение, секрецию нейрогормонов, сократительную активность кишечника и др. При активации опиоидных рецепторов закрываются потенциал-зависимые ионные кальциевые каналы в пресинаптических нейронах и снижается выброс возбуждающих медиаторов, например глутамата, а активация калиевых каналов в постсинаптических нейронах приводит к гиперполяризации мембран, что уменьшает чувствительность нейронов к возбуждающим нейромедиаторам и таким образом уменьшается передача болевых импульсов [29].
НА является ключевым нейротрансмиттером в нисходящих антиноцицептивных путях. Путем ингибирования обратного захвата НА после его высвобождения в синапсах тапентадол увеличивает уровень этого нейротрансмиттера, активируя рецепторы α2. Эта повышенная активация рецепторов приводит к подавлению передачи боли через нейроны второго порядка. Ингибирование обратного захвата НА служит дополнением к воздействию тапентадола на мю-опиоидные рецепторы и усиливает его анальгетическую эффективность [30, 31].
Тапентадол назначают пациентам с сильной и очень сильной болью. Доза подбирается индивидуально в соответствии с выраженностью болевого синдрома, ранее проводимой терапией (отсутствие эффекта от НПВП) и возможностью наблюдения за пациентом. Тапентадол PR (пролонгированного действия) следует принимать дважды в сутки независимо от приема пищи. Таблетку необходимо принимать внутрь с достаточным количеством жидкости не разжевывая, не разламывая и не растворяя. Пациенты, не принимавшие ранее наркотических анальгетиков, начинают терапию с дозы 50 мг 2 раза в сутки с последующим титрованием при необходимости. Имеющийся опыт свидетельствует, что режим подбора дозы тапентадола с увеличением на 100 мг в сутки каждые 3 дня большинству пациентов оказывается достаточным для достижения адекватного контроля боли [34].
Эффективность тапентадола была исследована на пациентах с болевой формой диабетической полинейропатии [35]. В исследовании приняли участие 588 пациентов с полинейропатией, не удовлетворенных ранее проведенной противоболевой терапией опиоидными или неопиодными анальгетиками в течение 3 месяцев, с сохраняющейся интенсивностью боли минимум 5 баллов по 11-балльной числовой школе оценки боли NRS (Numeric rating Scale for pain). Все больные в течение 3 недель получали тапентадол с титрацией оптимальной индивидуальной дозы до 100–250 мг в сутки. Те пациенты, у которых отмечалось уменьшение интенсивности боли хотя бы на 1 балл (n=395), были далее разделены на две группы. Одна группа пациентов получала плацебо, вторая – оптимальную фиксированную дозу тапентадола в течение 12 недель.
Эффективность тапентадола также изучалась при лечении нейропатического компонента боли у пациентов с ХБ в спине в комбинации с антиконвульсантом прегабалином. Монотерапия тапентадолом в дозе 500 мг/сут (n=152) сравнивалась с комплексной терапией прегабалином 300 мг/сут и тапентадолом 300 мг/сут (n=136). В обеих группах наблюдали выраженное уменьшение показателей нейропатической боли. Вторичная оценка эффективности лечения по шкалам SF-12 и EQ-5D выявила сходную положительную динамику как при монотерапии тапентадолом, так и при комбинированной терапии тапентадолом/прегабалином. Однако случаи тошноты и сонливости отмечались значительно чаще у пациентов на комбинированной терапии [36].
Применение тапентадола PR при остеоартрозе
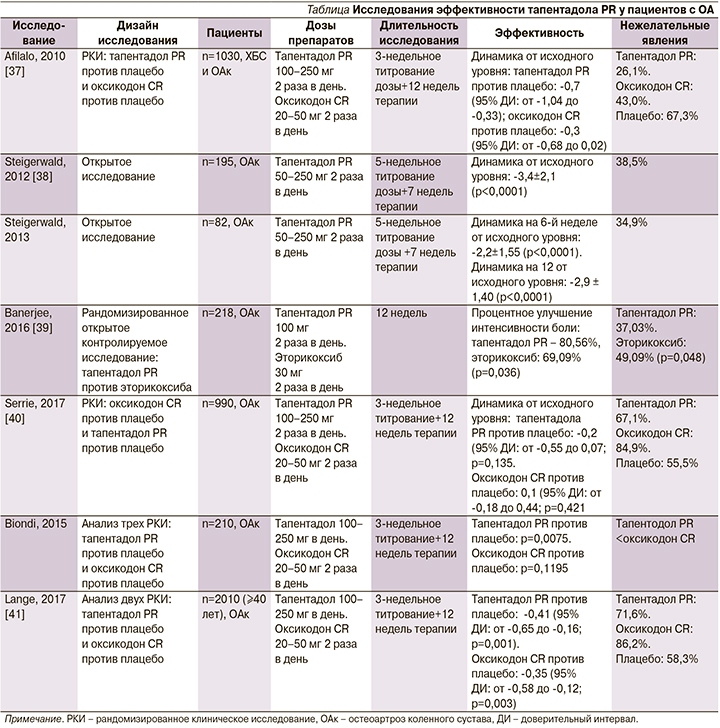
Эффективность тапентадола PR в лечении пациентов с ОА была оценена в нескольких исследованиях (см. таблицу).
В рандомизированном двойном слепом плацебо-контролируемом многоцентровом исследовании M. Afilalo et al. [37] оценивали сравнительную эффективность тапентадола PR, оксикодона и плацебо для пациентов с ОА в течение 3-недельного периода титрования с последующим 12-недельным периодом терапии и наблюдения. 1030 пациентов с ХБ в колене, обусловленной ОА, были рандомизированы для получения тапентадола 100–250 мг 2 раза в день, оксикодона 20–50 мг 2 раза в день или плацебо. В группе тапентадола отмечен значительно более высокий процент пациентов, достигших уменьшения интенсивности боли на ≥50% (32,0% [110/344]), по сравнению с плацебо (24,3% [82/337]; р=0.027), в то время как в группе оксикодона этот процент был существенно ниже (17,3% [59/342]; р=0,023). Нежелательные побочные явления со стороны желудочно-кишечного тракта отмечены у 26,1% пациентов в группе плацебо, 43,0% – на фоне терапии тапентадолом и у 67,3% больных, получавших оксикодон.
Важным аспектом выбора опиоидного анальгетика является не только выраженность обезболивающего действия, но и его переносимость. Известно, что при использовании препаратов данной группы нередко возникают нежелательные явления из-за воздействия на мю-опиоидные рецепторы, широко представленные в различных органах и тканях. Среди них выделяют желудочно-кишечные (тошнота, запоры), кардиоваскулярные (артериальная гипертензия), легочные (угнетение дыхания), эндокринные (снижение потенции) и психические эффекты, нежелательное влияние на вождение автомобиля, а также риск злоупотребления. Двойной механизм действия тапентадола в значительной степени снижает риск развития нежелательных явлений, т.к. воздействие препарата на мю-опиоидные рецепты на 40% ниже, чем у остальных опиоидов. Таким образом, выраженное обезболивающее действие и хорошая переносимость – важные преимущества препарата среди других опиоидных анальгетиков.
Риск возникновения лекарственной зависимости – также существенный фактор, ограничивающий использование опиоидных анальгетиков пациентами с хроническим болевым синдромом. В 2012 г. была исследована частота возникновения злоупотребления при лечении пациентов тапентадолом PR, оксикодоном, гидрокодоном и трамадолом, показавшая наиболее редкое развитие зависимости при применении первого из них [44, 45].
Заключение
ОА является широко распространенным заболеванием среди лиц пожилого возраста. Эффективный контроль боли имеет решающее значение в улучшении качества жизни пациентов. Выбор эффективной терапии болевого синдрома при ОА должен определяться как интенсивностью боли, так и ее патогенезом, т.е. лекарственный препарат должен воздействовать как на ноцицептивный механизм, так и на ЦС.
Механизм двойного действия тапентадола позволяет использовать его в качестве патогенетической терапии выраженной боли у пациентов с ОА. Хорошая переносимость и высокая эффективность позволяют рекомендовать тапентадол PR пациентам пожилого возраста для консервативного лечения ОА при наличии противопоказаний или недостаточной эффективности НПВП, а также в качестве терапии постоперационной боли больным, перенесшим эндопротезирование сустава, и в рамках реабилитации.
Литература
1. Roy S., Meachim G. Chondrocyte ultrastructure in adult human articular cartilage. Ann Rheum Dis. 1968;27:544–58.
2. Breivik H., Collett B., Ventafridda V., et al. Survey of chronic pain in Europe: prevalence, impact on daily life, and treatment. Eur J Pain. 2006;10: 287–333. Doi. 10.1016/j.ejpain.2005.06.009.
3. Kidd B.L. Osteoarthritis and joint pain. Pain 2006;123(1–2):9. Doi: 10.1016/j.pain.2006.04.009.
4. Wylde V., Hewlett S., Learmonth I.D., Dieppe P. Persistant pain after joint replacement: Prevalence, sensory qualities, and postoperative determinants. Pain. 2011;152:566–72. Doi: 10.1016/j.pain.2010.11.023.
5. Филатова Е.С., Туровская Е.Ф., Алексеева Л.И. Исследование эффективности прегабалина в терапии хронической боли у пациентов с остеоартрозом коленных суставов. Терапевтический архив. 2017;89(12):81–5. Doi: 10.17116/terarkh2017891281-85.
6. Staud R., Craggs J.G., Robinson M.E., et al. Brain activity related to temporal summation of C-fiber evoked pain. Pain. 2007;129:130–42.
7. Woolf C.J. Central sensitization: Implications for the diagnosis and treatment of pain. Pain 2011;152:S2–S15. Doi: 10.1016/j.pain.2010.09.030.
8. Woolf C.J. Evidence for a central component of post-injury pain hypersensitivity Nature. 1983;306:686–88.
9. Waxman S.G., Cummins T.R., Dib-Hajj S., et al. Sodium channels, excitability of primary sensory neurons, and the molecular basis of pain. Muscle Nerve. 1999;22:1177–87.
10. Dickenson A.H., Sullivan A.F. Evidence for the role of the NMDA receptor in the frequency dependent potentiation of deep rat dorsal horn nociceptive neurons following Cfibre stimulation. Neuropharmacology. 1987;26:1235–38.
11. Данилов А.Б., Давыдов О.С. Нейропатическая боль. М.: Боргес, 2007. 198 c.
12. Алексеев В.В., Амелин А.В., Давыдов О.С. и др. Методические рекомендации по диагностики и лечению невропатической боли –Невропатическая боль: клинические наблюдения. Под ред. Н.Н. Яхно и соавт. М.: Издательство РАМН, 2009. C. 6–31.
13. Clauw D.J. Fibromyalgia. JAMA. 2014;311(15):1547–55. Doi:10.1001/jama.2014.3266.
14. Desmeules J.A., Cedraschi C., Rapiti E., et al. Neurophysiologic evidence for a central sensitization in patients with fibromyalgia. Arthritis Rheumatism. 2003;48:1420–29.
15. Arendt-Nielsen L., Nie H., Laursen M.B., et al. Sensitization in patients with painful knee osteoarthritis. Pain 2010;149:573–81. Doi: 10.1016/j.pain.2010.04.003.
16. Lluch Girbes E., Nijs J., Torres Cueco R., et al. Pain treatment for patients with osteoarthritis and central sensitization. Phys Ther. 2013;93:842–51. Doi: 10.2522/ptj.20120253.
18. Smart K.M., Blake C., Staines A., Doody C. Self-reported pain severity, quality of life, disability, anxiety and depression in patients classified with “nociceptive”, “peripheral neuropathic” and “central sensitisation” pain. The discriminant validity of mechanisms-based classifications of low back (±leg) pain. Manual Ther. 2012;17:119–25.
19. Jull G., Sterling M., Kenardy J., Beller E. Does the presence of sensory hypersensitivity influence outcomes of physical rehabilitation for chronic whiplash? A preliminary RCT. Pain. 2007;129:28–34.
20. Coombes B.K., Bisset L., Vicenzino B. Thermal hyperalgesia distinguishes those with severe pain and disability in unilateral lateral epicondylalgia. Clin J Pain. 2012;28:595–601. Doi: 10.1097/AJP.0b013e31823dd333.
21. Hochman J.P., Gagliese L., Davis A.M. Neuropathic pain symptoms in a community knee OA cohort. Osteoarthritis and Cartilage. 2011;19:647–54. Doi: 10.1016/j.joca.2011.03.007.
22. Dimitroulas T., Duate R.V., Behura A., et al. Neuropathic pain in osteoarthritis: a review of pathophysiological mechanisms and implications for treatment. Semin Arthritis Rheumatol. 2014;44:145–54. Doi: 10.1016/j.semarthrit.2014.05.011.
23. Thakur M., Dickenson A.H., Baron R. Osteoarthritic pain: nociceptive or neuropathic? Nat Rev Rheumatol. 2014;10:374–80. Doi: 10.1038/nrrheum.2014.47.
24. Филатова Е.С., Туровская Е.Ф., Алексеева Л.И. и др. Анализ патогенетических механизмов хронической суставной боли у больных ревматоидным артритом и остеоартрозом коленных суставов. Научно-практическая ревматология. 2014;52(6):631–35. Doi: 10.14412/1995-4484-2014-631–35.
25. Hochman J.R., French M.R., Bermingham S.L. The nerve of Osteoarthritis Pain. Arthritis Care Res (Hoboken). 2010;62(7):1019–23. Doi: 10.1002/acr.20142.
26. Imamura M., Imamura S.T, Kaziyama H.H.S. Impact of nervous system hyperalgesia on pain, disability, and quality of life in patients with knee osteoarthritis: A controlled Analysis. Arthritis Rheumatism. 2008;59(10):1424–31. Doi: 10.1002/art.24120.
27. Arendt-Nielsen L., Hongling Nie, Laursen M.B. Sensitisation in patient with knee osteoarthritis. Pain. 2010;149: 573–81. Doi: 10.1016/j.pain.2010.04.003.
28. Schröder W., Tzchentke T., Terlinden R., et al. Synergistic Interaction between the Two Mechanisms of Action of Tapentadol in Analgesia. JPET. 2011;337:312–20. Doi: 10.1124/jpet.110.175042.
29. Li J.G., Chen C., Yin J., et al. ASP147 in the third transmembrane helix of the rat mu opioid receptor forms ion-pairing with morphine and naltrexone. Life Sci. 1999;65(2):175–85.
30. Tzschentke T., Jahnel U., Kögel B., et. al. Tapentadol hydrochloride: a next-generation, centrally acting analgesic with two mechanisms of action in a single molecule. Drugs Today. 2009;45:483–96. Doi: 10.1358/dot.2009.45.7.1395291.
31. Schröder W., Tzchentke T., Terlinden R., et al. Synergistic Interaction between the Two Mechanisms of Action of Tapentadol in Analgesia. JPET. 2011;337:312–20. Doi: 10.1124/jpet.110.175042.
32. Tzschentke T.M., Christoph T., Kögel B., et al. (-)-1R,2R)-3-(3-Dimethylamino-1-ethyl-2-methyl-propyl)-phenol Hydrochloride (Tapentadol HCl): a Novel mu-Opioid Receptor Agonist/Norepinephrine Reuptake Inhibitor with Broad-Spectrum Analgesic Properties. J Pharmacol Exp Ther. 2007;323:265–76.
33. Schröder W., Tzschentke T.M., Terlinden R., et al. Synergistic Interaction between the Two Mechanisms of Action of Tapentadol in Analgesia. JPET. 2011;337:312–20. Doi: 10.1124/jpet.110.175042.
34. Регистр лекарственных средств России® РЛС®. 2000–2019.
35. Schwartz S., Etropolski M., Shapiro D.Y., et al. Safety and efficacy of tapentadol ER in patients with painful diabetic peripheral neuropathy: results of a randomized-withdrawal, placebo-controlled trial. Curr Med Res Opin. 2011;27(1):151–62. Doi: 10.1185/03007995.2010.537589.
36. Baron R., Martin-Mola E., Muller M., et al. Effectiveness and Safety of Tapentadol Prolonged Release (PR) Versus a Combination of Tapentadol PR and Pregabalin for the Management of Severe, Chronic Low Back Pain With a Neuropathic Component: A Randomized, Double-blind, Phase 3b Study. Pain Pract. 2015;15(5):455–70. Doi: 10.1111/papr.12200.
37. Afilalo M., Etropolski M., Kuperwasser B., et al. Efficacy and Safety of Tapentadol Extended Release Compared with Oxycodone Controlled Release for the Management of Moderate to Severe Chronic Pain Related to Osteoarthritis of the Knee: Results of a Randomized, Double-blind, Placebo- and Active-controlled Phase 3 Study. Clin Drug Invest. 2010;30:489–505.
38. Steigerwald I., Müller M, Kujawa J., et al. Effectiveness and safety of tapentadol prolonged release with tapentadol immediate release on-demand for the management of severe, chronic osteoarthritis-related knee pain: results of an open-label, phase 3b study. J Pain Res. 2012;5:121–38. Doi:10.2147/JPR.S30540.
39. Banerjee M., Mondal S., Sarkar R., et al. Comparative study of efficacy and safety of tapentadol versus etoricoxib in mild to moderate grades of chronic osteorthritis of knee. Indian J Rheumatol. 2016;11(1):21–5. Doi:10.1016/j.injr.2015.12.001
40. Serrie A., Lange B., Steup A. Tapentadol prolonged-release for moderate-to-severe chronic osteoarthritis knee pain: a double-blind, randomized, placebo- and oxycodone controlled release-controlled study. Curr Med Res Opin. 2017;33(8):1423–32. Doi:10.1080/03007995.2017.133518.
41. Lange B., von Zabern D., Elling C., Dubois C. Efficacy and safety of tapentadol prolonged release for moderate-to-severe chronic osteoarthritis knee pain: a pooled analysis of two double-blind, randomized, placebo- and oxycodone controlled release-controlled studies. Curr Med Res Opin. 2017;33(8):1413–22. Doi:10.1080/03007995.2017.1335188.