Чем поддерживается вторичная структура белка
Вторичная структура белка
Рентгеноструктурная кристаллография решает две главные проблемы белковой химии: закономерности чередования последовательности аминокислотных остатков в полипептидной цепи и закономерности конфигурации белковой молекулы.
Первые рентгенограммы белков, полученные еще в 30-х годах У. Астбю-ри, а затем Л. Полингом и Р. Кори, позволили установить наличие в белках наряду с линейной полипептидной цепью участков, определенным образом скрученных.
Под вторичной структурой белка подразумевают конфигурацию полипептидной цепи, т. е. способ свертывания, скручивания (складывание, упаковка) полипептидной цепи в спиральную или какую-либо другую конформацию. Процесс этот протекает не хаотично, а в соответствии с программой, заложенной в первичной структуре. Подробно изучены две основные конфигурации полипептидных цепей, отвечающих структурным требованиям и экспериментальным данным: α-спирали и β-структуры.
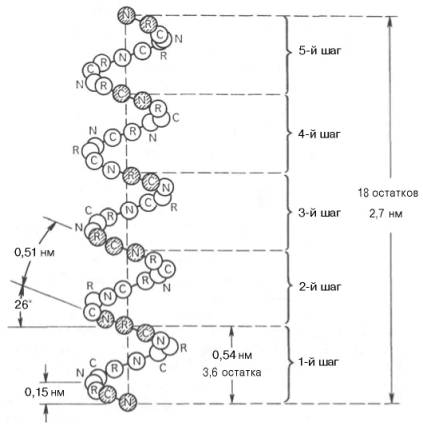
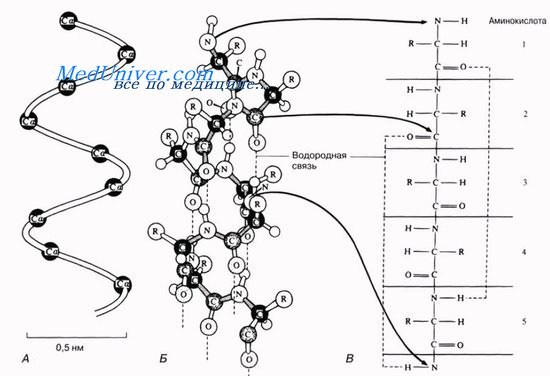
Благодаря исследованиям Л. Полинга наиболее вероятным типом строения глобулярных белков принято считать α-спираль (рис. 1.17). Закручивание полипептидной цепи происходит по часовой стрелке (правый ход спирали), что обусловлено L-аминокислотным составом природных белков. Движущей силой в возникновении α-спиралей (так же как и β-структур) является способность аминокислот к образованию водородных связей. В структуре α-спиралей открыт ряд закономерностей. На каждый виток (шаг) спирали приходится 3,6 аминокислотных остатка. Шаг спирали (расстояние вдоль оси) равен 0,54 нм на виток, а на один аминокислотный остаток приходится 0,15 нм. Угол подъема спирали 26°, через 5 витков спирали (18 аминокислотных остатков) структурная конфигурация полипептидной цепи повторяется. Это означает, что период повторяемости (или идентичности) α-спиральной структуры составляет 2,7 нм.
Для каждого белка характерна определенная степень спирализации его полипептидной цепи. Степень спирализации устанавливают путем измерения удельного вращения плоскости поляризованного света. Изменение последнего находится в прямой зависимости от степени спирализации белковой молекулы. Не все глобулярные белки спирализованы на всем протяжении полипептидной цепи. В молекуле белка α-спиральные участки чередуются с линейными. В частности, если α- и β-цепи гемоглобина спирализованы, например, на 75%, то лизоцима – на 42%, а пепсина – всего на 30%.
Рис. 1.17. Структура и параметры α-спирали.
Таким образом, стабильность вторичной структуры обеспечивается в основном водородными связями (определенный вклад вносят и главно-валентные связи – пептидные и дисульфидные).
Водородная связь представляет собой слабое электростатическое притяжение (взаимодействие, связь) между одним электроотрицательным атомом (например, кислородом или азотом) и водородным атомом, кова-лентно связанным со вторым электроотрицательным атомом. Типы водородных связей представлены далее.
По современным представлениям, водородная связь включает не только электростатические силы притяжения между полярными группами (взаимодействие атомов водорода с электроотрицательными элементами: кислородом, азотом, хлором), но и электронные связи такого же типа, как в ряде комплексных соединений. Водородные связи, являясь нековалентными, отличаются малой прочностью. Так, если для разрыва химических межатомных связей необходимо затратить от 84 до 8400 кДж, то для разрыва одной водородной связи требуется затратить всего лишь 6,3 кДж на 1 моль. Поскольку в белковой молекуле число водородных связей очень велико (в образование водородных связей вовлечены все пептидные группы), они в сумме обеспечивают скручивание полипептидной цепи в спиральную структуру, сообщая ей компактность и стабильность.
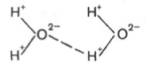
Механизм возникновения водородных связей в элементарной форме может быть представлен на примере взаимодействия двух молекул воды (диполи). В диполе воды, как известно, избыток положительных зарядов приходится на атомы водорода, а избыток отрицательных – на атомы кислорода.
Благодаря особенностям строения атома водорода при достаточном сближении двух молекул воды возникает электростатическое взаимодействие между атомом кислорода одной молекулы и атомом водорода второй молекулы воды. Следствием этого является ослабление связи между атомами водорода и кислорода в каждой молекуле воды и соответственно возникновение новой, непрочной связи (отмечена пунктиром) между атомом водорода первой молекулы и атомом кислорода второй молекулы воды. Эту непрочную связь принято обозначать водородной связью.
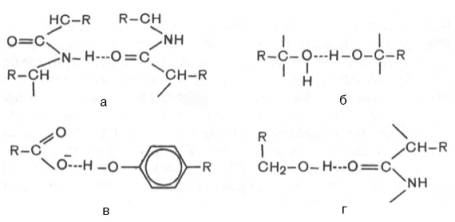
В белковой молекуле наиболее важные водородные связи образуются между ковалентно связанным атомом водорода, несущим частичный положительный заряд, и отрицательно заряженным ковалентно связанным атомом кислорода. Ниже представлены примеры водородных связей в белковой молекуле: а) между пептидными цепями; б) между двумя гидрок-сильными группами; в) между ионизированной СООН-группой и ОН-груп-пой тирозина; г) между ОН-группой серина и пептидной связью.
В зависимости от химической природы атома-акцептора водородные связи отличаются друг от друга степенью прочности. О количестве водородных связей в белковой молекуле судят по данным изотопного метода, в частности по времени обмена атомов водорода, участвующих в образовании водородной связи, на дейтерий (при обработке белка тяжелой водой D2O, в которой вместо обычного водорода содержится его тяжелый изотоп дейтерий).
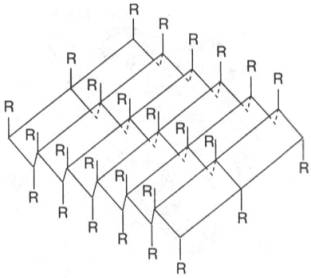
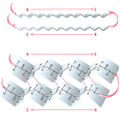
Другой тип конфигурации полипептидных цепей, обнаруженный в белках волос, шелка, мышц и в других фибриллярных белках, получил название β-структуры. В этом случае две или более линейные полипептидные цепи, расположенные параллельно или, чаще, антипараллельно, прочно связываются межцепочечными водородными связями между NH-и СО-группами соседних цепей, образуя структуру типа складчатого слоя (рис. 1.18).
Рис. 1.18. β-Структура полипептидных цепей.
В природе существуют белки, строение которых, однако, не соответствует ни β-, ни α-структуре. Типичным примером таких белков является коллаген – фибриллярный белок, составляющий основную массу соединительной ткани в организме человека и животных (см. главу 21).
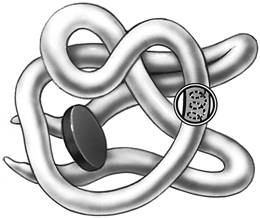
Методами рентгеноструктурного анализа в настоящее время доказано существование еще двух уровней структурной организации белковой молекулы, оказавшихся промежуточными между вторичной и третичной структурами. Это так называемые надвторичные структуры и структурные домены.
Надвторичные структуры представляют собой агрегаты полипептидных цепей, обладающих собственной вторичной структурой и образующихся в некоторых белках в результате их термодинамической или кинетической стабильности. Так, в глобулярных белках открыты (βхβ)-элементы (представлены двумя параллельными β-цепями, связанными сегментом х), βαβαβ-элементы (представлены двумя сегментами α-спирали, вставленными между тремя параллельными β-цепями) и др. В больших глобулярных белках иногда содержатся неодинаковые структурные домены, выполняющие разные функции, как и однотипные домены в пределах одного мономерного белка, образующиеся, вероятнее всего, как результат влияния генов в первом случае или дупликации генов – во втором. Домены создаются объединением и чередованием α-спиралей и β-слоев, между которыми открываются более рыхлые структуры (рис. 1.19).
Домен – это компактная глобулярная структурная единица внутри полипептидной цепи. Домены могут выполнять разные функции и подвергаться складыванию (свертыванию) в независимые компактные глобулярные структурные единицы, соединенные между собой гибкими участками внутри белковой молекулы. Открыто много белков (например, иммуноглобулины), состоящих из разных по структуре и функциям доменов, кодируемых разными генами.
Чем поддерживается вторичная структура белка
Для всякого белка характерна, помимо первичной, еще и определенная вторичная структура. Обычно белковая молекула напоминает растянутую пружину.
Это так называемая а-спираль, стабилизируемая множеством водородных связей, возникающих между находящимися поблизости друг от друга СО- и NH-группами. Атом водорода NH-группы одной аминокислоты образует такую связь с атомом кислорода СО-группы другой аминокислоты, отстоящей от первой на четыре аминокислотных остатка.
Таким образом аминокислота 1 оказывается связанной с аминокислотой 5, аминокислота 2 — с аминокислотой 6 и т. д. Рентгеноструктурный анализ показывает, что на один виток спирали приходится 3,6 аминокислотного остатка.
Полностью а-спиральную конформацию и, следовательно, фибриллярную структуру имеет белок кератин. Это структурный белок волос, шерсти, ногтей, клюва, перьев и рогов, входящий также в состав кожи позвоночных.
Твердость и растяжимость кератина варьируют в зависимости от числа дисульфидных мостиков между соседними полипептидными цепями (от степени сшивки цепей).
Теоретически все СО- и NH-группы могут участвовать в образовании водородных связей, так что а-спираль — это очень устойчивая, а потому и весьма распространенная конформация. Участки а-спирали в молекуле напоминают жесткие стержни. Тем не менее большинство белков существует в глобулярной форме, в которой также имеются участки (3-слоя (см. ниже) и участки с нерегулярной структурой.
Объясняется это тем, что образованию водородных связей препятствует ряд факторов: наличие некоторых аминокислотных остатков в полипептидной цепи, наличие дисульфидных мостиков между различными участками одной и той же цепи и, наконец, тот факт, что аминокислота пролин вообще неспособна образовывать водородные связи.
Бета-Слой, или складчатый слой — это другой тип вторичной структуры. Белок шелка фиброин, выделяемый шелкоотделительными железами гусениц шелкопряда при завивке коконов, представлен целиком именно этой формой. Фиброин состоит из ряда полипептидных цепей, вытянутых сильнее, чем цепи с конформацией альфа-спирали.
Эти цепи уложены параллельно, но соседние цепи по своему направлению противоположны одна другой (антипараллельны). Они соединены друг с другом при помощи водородных связей, возникающих между С=0- и NH-группами соседних цепей. В этом случае в образовании водородных связей также принимают участие все NH- и С=0-группы, т. е. структура тоже весьма стабильна.
Такая конформация полипептидных цепей называется бета-конформацией, а структура в целом — складчатым слоем. Фиброин обладает высокой прочностью на разрыв и не поддается растяжению, но подобная организация полипептидных цепей делает шелк очень гибким. В глобулярных белках полипептидная цепь может складываться на себя, и тогда в этих точках глобулы возникают участки, имеющие структуру складчатого слоя.
Еще один способ организации полипептидных цепей мы находим у фибриллярного белка коллагена. Это тоже структурный белок, обладающий подобно кератину и фиброину высокой прочностью на разрыв. У коллагена три полипептидные цепи свиты вместе, как пряди в канате, образуя тройную спираль. В каждой полипептидной цепи этой сложной спирали, называемой тропоколлагеном, содержится около 1000 аминокислотных остатков. Отдельная полипептидная цепь представляет собой свободно свернутую спираль (но не а-спираль;).
Три цепи удерживаются вместе водородными связями. Из многих тройных спиралей, располагающихся параллельно друг другу и удерживаемых вместе ковалентными связями между соседними цепями, образуются фибриллы. Они в свою очередь объединяются в волокна. Структура коллагена формируется, таким образом, поэтапно — на нескольких уровнях — подобно структуре целлюлозы. Коллаген также невозможно растянуть, и это его свойство существенно для той функции, которую он выполняет, например, в сухожилиях, костях и других видах соединительной ткани.
Белки, существующие только в полностью спирализованной форме, подобно кератину и коллагену, представляют собой исключение среди прочих белков.
Вторичная структура белка
Содержание
Вторичная структура белка [ править | править код ]
Вторичную структуру белка определяют водородные связи между атомами, образующими пептидную связь. Третичная структура белков обусловлена связями между радикалами аминокислот.
β-Цепь и β-слой [ править | править код ]
По своей структуре полипептидная цепь может быть организована как β-цепь. Когда несколько таких β-цепей связываются друг с другом, они формируют параллельный или антипараллельный β-слой.
Рис. 7.1. Антипараллельный β-слой. Полипептидная цепь существует в виде зигзагообразной β-цепи. β-Цепи могут связываться друг с другом водородными связями, образуя β-слой. Если соседние β-цепи в β-слое ориентированы противоположно, эта структура называется «антипараллельный β-слой»
Рис. 7.2. Параллельный β-слой. Три β-цепи связываются водородными связями, формируя р-складчатый слой. Поскольку β-цепи ориентированы в одном направлении, β-слой называется параллельным
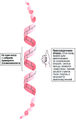
α-Спираль [ править | править код ]
Полипептидные цепи стабилизируются водородными связями с образованием правозакрученной а-спирали (рис. 7.3).
При изменениях первичной структуры белка меняется и его вторичная структура: так, делеция одной аминокислоты вызывает муковисцидоз
Первичной структурой белка называют последовательность аминокислот в пептидной цепи. Всего лишь одна неправильная аминокислота в цепи из 1480 аминокислот может изменить функции белка. Именно это происходит при муковисцидозе. Это врожденное заболевание, при котором нарушена структура гена CFRT (cystic fibrosis transmembrane conductance regulator — трансмембранный регулятор проводимости при муковисцидозе). Продукт этого гена — трансмембранный белок, который в норме выполняет функцию транспортера для ионов хлорида; однако в случае муковисцидоза его функции нарушаются. Самая распространенная причина муковисцидоза, которая наблюдается у 70% больных, — делеция трех пар оснований в гене CFRT, из-за чего мутантный белок CFRT не содержит фенилаланина в положении 508 (рис. 7.4). Эта мутация называется ДР508-мутацией (А — делеция, F — фенилаланин, 508 — положение фенилаланина в первичной структуре белка). После синтеза дефектный CFTR-белок сворачивается в неправильную вторичную структуру и удерживается в эндоплазматическом ретикулуме. Из-за отсутствия транспортера для ионов хлора клетки секретируют густую вязкую слизь, которая накапливается в дыхательных путях и нарушает функционирование легких. Кроме того, нарушается экзокринная функция поджелудочной железы, что проявляется в синдроме мальабсорбции.
Перестройка вторичной структуры приона вызывает губчатую энцефалопатию (болезнь Крейтцфельда-Якоба, «коровье бешенство»)
Рис. 7.3. Правозакрученная α-спираль
Рис. 7.4. Мутация AF508 вызывает муковисцидоз. Из-за делеции трех оснований — СТТ — в белке CFRT отсутствует фенилаланин в позиции 508. Функции такого белка нарушены, и вследствие этого развивается муковисцидоз. Примечание: делеция основания не влияет на изолейцин в позиции 507, так как и АТС, и ATT кодируют изолейцин
Рис. 7.5. Белки прионы. В норме белок прион (РrР с ) растворим и состоит в основном из а-спиралей. Но в мутантной форме приона, которая вызывает почесуху (РrР sc ), часть а-спиралей переходит в р-складчатую конформацию, и белок становится нерастворимым. Мутантная форма РrР sc «инфекционна», так как в ее присутствии а-спирали трансформируются в β-конформацию
Строение и функции белков
Белки (протеины) составляют 50% от сухой массы живых организмов.
Белки состоят из аминокислот. У каждой аминокислоты есть аминогруппа и кислотная (карбоксильная) группа, при взаимодействии которых получается пептидная связь, поэтому белки еще называют полипептидами.
Структуры белка
Первичная – цепочка из аминокислот, связанных пептидной связью (сильной, ковалентной). Чередуя 20 аминокислот в разном порядке, можно получать миллионы разных белков. Если поменять в цепочке хотя бы одну аминокислоту, строение и функции белка изменятся, поэтому первичная структура считается самой главной в белке.
Вторичная – спираль. Удерживается водородными связями (слабыми).
Третичная – глобула (шарик). Четыре типа связей: дисульфидная (серный мостик) сильная, остальные три (ионные, гидрофобные, водородные) – слабые. Форма глобулы у каждого белка своя, от нее зависят функции. При денатурации форма глобулы меняется, и это сказывается на работе белка.
Четвертичная – имеется не у всех белков. Состоит из нескольких глобул, соединенных между собой теми же связями, что и в третичной структуре. (Например, гемоглобин.)
Денатурация
Это изменение формы глобулы белка, вызванное внешними воздействиями (температура, кислотность, соленость, присоединение других веществ и т.п.)
Функции белков
Их очень много, например:
Еще можно почитать
Задания части 1
Выберите один, наиболее правильный вариант. Водородные связи между СО- и NН-группами в молекуле белка придают ей форму спирали, характерную для структуры
1) первичной
2) вторичной
3) третичной
4) четвертичной
Выберите один, наиболее правильный вариант. Четвертичная структура молекулы белка образуется в результате взаимодействия
1) участков одной белковой молекулы по типу связей S-S
2) нескольких полипептидных нитей, образующих клубок
3) участков одной белковой молекулы за счет водородных связей
4) белковой глобулы с мембраной клетки
Выберите один, наиболее правильный вариант. Последовательность и число аминокислот в полипептидной цепи – это
1) первичная структура ДНК
2) первичная структура белка
3) вторичная структура ДНК
4) вторичная структура белка
Выберите один, наиболее правильный вариант. Первичная структура белка образована связью
1) водородной
2) макроэргической
3) пептидной
4) ионной
Выберите один, наиболее правильный вариант. В основе образования пептидных связей между аминокислотами в молекуле белка лежит
1) принцип комплементарности
2) нерастворимость аминокислот в воде
3) растворимость аминокислот в воде
4) наличие в них карбоксильной и аминной групп
БЕЛКИ
1. Выберите три варианта. Белки в организме человека и животных
1) составляют бо́льшую часть организма по массе
2) начинают расщепляться в ротовой полости
3) не содержат фосфора в составе молекулы
4) могут откладываться в запас
5) в качестве ферментов ускоряют химические реакции
6) служат основным строительным материалом
2. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Выберите только особенности строения белковой молекулы.
1) содержит атомы фосфора
2) состоит из аминокислот
3) мономеры удерживаются пептидными связями
4) состоит из одинаковых по строению мономеров
5) изменяет форму под действием температуры
6) четвертичная структура состоит из нескольких молекул
3. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Какие из перечисленных ниже признаков относятся к характеристикам молекул белков?
1) состоят из нуклеотидов
2) выполняют только структурную и двигательную функции
3) могут иметь форму глобулы
4) содержат в составе азот и серу
5) всегда нерастворимы в воде
6) являются нерегулярными полимерами
Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Какие из перечисленных ниже веществ относятся к белкам?
1) крахмал
2) коллаген
3) фибриноген
4) тестостерон
5) гемоглобин
6) сахароза
БЕЛКИ КРОМЕ
1. Все перечисленные признаки, кроме двух, можно использовать при описании яичного белка альбумина. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) состоит из аминокислот
2) пищеварительный фермент
3) денатурирует обратимо при варке яйца вкрутую
4) мономеры связаны пептидными связями
5) молекула образует первичную, вторичную и третичную структуры
2. Все перечисленные ниже признаки, кроме двух, можно использовать для описания молекулы белка. Определите два признака, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
1) состоит из нуклеотидов
2) может иметь форму глобулы
3) имеет третичную и четвертичную структуры
4) образуется в ядре
5) бывают глобулярные и фибриллярные
БЕЛКИ КРОМЕ РИС
1. Перечисленные ниже признаки, кроме двух, используются для описания строения, функций изображенного органического вещества. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) имеет структурные уровни организации молекулы
2) входит в состав клеточных стенок
3) является биополимером
4) служит матрицей при трансляции
5) состоит из аминокислот

2. Все перечисленные ниже признаки, кроме двух, используются для описания изображённой на рисунке структуры. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) вторичная структура молекулы белка
2) удерживается только пептидными связями
3) определяется методом рентгеноструктурного анализа
4) представляет собой глобулу
5) может выполнять ферментативные функции

3. Все перечисленные ниже характеристики, кроме двух, используют для описания изображенной на рисунке молекулы органического вещества клетки. Определите две характеристики, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) денатурация
2) репликация
3) транскрипция
4) аминокислоты
5) водородные связи
СТРУКТУРЫ БЕЛКА
Установите соответствие между характеристикой и структурой белка: 1) первичная, 2) третичная. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) молекула в форме глобулы или фибриллы
Б) строгая последовательность аминокислотных остатков
В) аминокислотные остатки соединены только пептидными связями
Г) имеет дисульфидные мостики между радикалами аминокислот
Д) при ее разрушении наступает необратимая денатурация
Е) пространственная конфигурация полипептидной цепи
ФЕРМЕНТАТИВНАЯ
1. Все приведенные ниже признаки, кроме двух, можно использовать для описания ферментов. Определите два признака, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
1) входят в состав клеточных мембран и органоидов клетки
2) играют роль биологических катализаторов
3) имеют активный центр
4) оказывают влияние на обмен веществ, регулируя различные процессы
5) специфические белки
2. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Ферменты – это вещества, которые
1) вырабатываются в железах внутренней секреции
2) являются белками
3) поступают в организм, как правило, вместе с пищей
4) являются в организме источником энергии
5) ускоряют протекание химических реакций
6) у человека выполняют свои функции при температуре около 36 градусов
ФУНКЦИИ БЕЛКОВ
Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Функциями белков в организме человека являются
1) строительная
2) передача наследственных признаков
3) защитная
4) запасающая
5) ферментативно-каталитическая
6) хранение генетической информации
ФУНКЦИИ БЕЛКОВ КРОМЕ
Все перечисленные характеристики используют для описания функций белков. Определите две характеристики, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) регуляторная
2) двигательная
3) рецепторная
4) образуют клеточные стенки
5) служат коферментами

Рассмотрите рисунок с изображением полипептида и укажите (А) уровень его организации, (Б) форму молекулы и (В) вид взаимодействия, поддерживающий эту структуру. Для каждой буквы выберите соответствующий термин или соответствующее понятие из предложенного списка.
1) первичная структура
2) вторичная структура
3) третичная структура
4) взаимодействия между нуклеотидами
5) металлическая связь
6) гидрофобные взаимодействия
7) фибриллярная
8) глобулярная

Рассмотрите схему химического вещества. Укажите (А) название класса органических веществ, (Б) уровень организации полимерной молекулы и (В) название мономеров, из которых состоит данная молекула. Для каждой буквы выберите соответствующий термин из предложенного списка.
1) ДНК
2) белок
3) альфа-спираль
4) вторичная структура
5) третичная структура
6) аминокислоты
7) нуклеотиды
8) рибоза

Рассмотрите рисунок с изображением полипептида. Укажите (А) уровень его организации, (Б) мономеры, которые его образуют, и (В) вид химических связей между ними. Для каждой буквы выберите соответствующий термин или соответствующее понятие из предложенного списка.
1) первичная структура
2) водородные связи
3) двойная спираль
4) вторичная структура
5) аминокислота
6) альфа-спираль
7) нуклеотид
8) пептидные связи

Проанализируйте таблицу «Уровни организации белка». Для каждой ячейки, обозначенной буквой, выберите соответствующий термин из предложенного списка.
1) глобула
2) двойная спираль
3) эфирные
4) гидрофильные
5) пептидные
6) нитчатая
7) вторичная
8) четвертичная
Известно, что белки – нерегулярные полимеры, имеющие высокую молекулярную массу, строго специфичны для каждого вида организма. Выберите из приведенного ниже текста три утверждения, по смыслу относящиеся к описанию этих признаков, и запишите цифры, под которыми они указаны. (1) В состав белков входит 20 различных аминокислот, соединенных пептидными связями. (2) Белки имеют различное количество аминокислот и порядок их чередования в молекуле. (3) Низкомолекулярные органические вещества имеют молекулярную массу от 100 до 1000. (4) Они являются промежуточными соединениями или структурными звеньями – мономерами. (5) Многие белки характеризуются молекулярной массой от нескольких тысяч до миллиона и выше, в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры белка. (6) Каждый вид живых организмов имеет особый, только ему присущий набор белков, отличающий его от других организмов.