Чем питаются раковые клетки
Раковые клетки не любят
Крупная американская клиника имени Джона Хопкинса наконец рассказала правду о раке.
1.Каждый человек имеет раковые клетки в организме. Эти раковые клетки не обнаруживаются в стандартных тестах, пока они не размножились до нескольких миллиардов. Когда врачи говорят больным раком, что нет больше раковые клетки в их телах после лечения, это просто означает, что тесты не в состоянии обнаружить раковые клетки, потому что они еще не достигли определенной численности.
2.Раковые клетки возникают от 6 до 10 и более раз в течение жизни человека.
3.Когда иммунная система человека сильна, раковые клетки будут уничтожены и предотвращается размножение и формирование опухолей.
4.Когда у человека есть рак, это означает, что человек испытывает дефицит ряда питательных веществ. Это может быть связано с генетическими, экологическими, пищевыми факторами или образом жизни.
5.Чтобы преодолеть нехватку в питании, необходимо изменение диеты, включая добавки, которые укрепят иммунную систему.
6.Химиотерапия приводит к отравлению быстро растущих раковых клеток, она также разрушает быстро растущие здоровые клетки в костном мозге, желудочно-кишечного тракте и т.д., и может привести к повреждению органов, таких как печень, почки, сердце, легкие и т.д.
7.Радиация, разрушая раковые клетки, также вызывает ожоги, шрамы и повреждает здоровые клетки, ткани и органы.
8.Первоначальное лечение химиотерапией и радиацией часто уменьшает размер опухоли. Однако длительное применение химиотерапии и радиации не приводят к дополнительному уничтожению опухоли.
9.Когда тело обременено многочисленными токсинами из-за химиотерапии и радиации, иммунная система оказывается либо скомпрометированной, либо уничтоженной, поэтому человек может поддаться атакам различных видов инфекций и получить осложнения.
10. Химиотерапия и радиация может заставить раковые клетки мутировать и стать устойчивыми, а также не поддающимися к уничтожению. Хирургическая операция также может вызвать распространение раковых клеток в другие места.
11.Эффективный способ борьбы с раком – заставить раковые клетки голодать, не кормить их продуктами питания, необходимыми для существования.
Чем же раковые клетки питаются?
1.Сахар является главной пищей раковых клеток. Отключив сахар, отсекается важнейший путь поставки питания раковым клеткам.
Примечание: Заменители сахара, такие как NutraSweet, Equal, и т.д. сделанные на основе аспартама, также вредны. Лучшей естественной заменой был бы мед Манука или патока, но только в очень небольших количествах. Поваренная соль имеет химические добавки, которые придают ей белый цвет. Лучшей альтернативой являются аминокислоты Брэгга или морская соль.
2.Молоко заставляет организм производить слизи, особенно в желудочно-кишечном тракте. Рак питается слизью. Отрезав молоко, и употребляя несладкое соевое молоко, вы обрекаете раковые клетки на голод.
3.Раковые клетки процветают в кислой среде. Мясная диета является кислой, и поэтому лучше всего есть рыбу, и немного курицы, а не говядину или свинину. Мясо скота также содержит антибиотики, гормоны роста и паразитов, что очень вредно, особенно для людей, больных раком.
4. Диета, состоящая из 80% свежих овощей и соков, цельного зерна, семян, орехов и небольшого количества фруктов помогают телу воссоздать щелочную среду. Около 20% пищи может быть приготовленной, в том числе, это могут быть бобы. Свежие овощные соки обеспечивают организм живыми ферментами, которые легко усваиваются и достигают клеточного уровня в течение 15 минут, это питает и укрепляет рост здоровых клеток.
Для получения живых ферментов, необходимых для построения здоровых клеток, нужно пить свежий овощной сок и есть некоторые сырые овощи 2 или 3 раза в день.
Расследования в поджелудочной: чем питаются раковые клетки
Расследования в поджелудочной: чем питаются раковые клетки
Главное правило медицинской статистики — не говорить о статистике. 14,1 млн новых случаев онкологических заболеваний в мире регистрируется каждый год. 32,6 млн больных раком живут в нашем мире в настоящий момент. По прогнозам врачей, в ближайшие 20 лет количество случаев онкологических заболеваний увеличится на 70%. Неудивительно, что борьба с этой болезнью становится одной из основных задач медицины 21 века. На фото — клетки меланомы на коллагеновом матриксе кожи.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Ученые выяснили, почему рак поджелудочной железы устойчив к действию химиотерапевтических препаратов. Панкреатические опухоли способны отгораживаться защитным изолирующим слоем, который не пропускает к метастазам достаточного количества сосудов. «Питание» онкологических новообразований происходит за счет энергии аминокислот, поставляемых соседними звездчатыми клетками.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Смертельный диагноз?
Что такое химиотерапия?
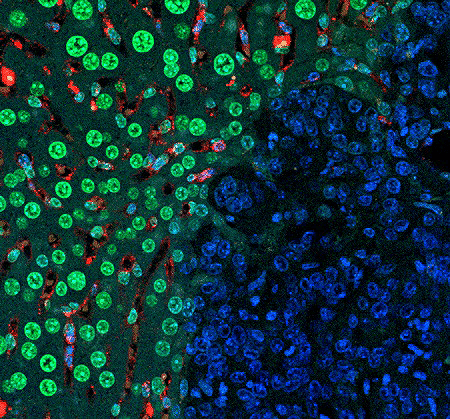
Рисунок 1. Микрофотография метастаза в поджелудочной железе. Сосуды (красного цвета) не проникают к очагу воспаления — раковым клеткам (окрашены синим цветом). Введенный в печень химиотерапевтический агент доксорубицин (зеленый цвет) нормально внедряется в здоровую ткань, но не способен пройти внутрь метастаза.
В научных журналах регулярно появляются новые сообщения об успешном применении химиотерапевтических средств. По какому принципу они работают? Больному вводится ядовитый препарат, который губительно действует абсолютно на все клетки организма. Однако усиленное кровоснабжение раковых клеток, а также их повышенные потребности в питательных веществах способствуют тому, что именно опухоль поглощает бóльшую часть яда. Патологический процесс разрастания очага заболевания приостанавливается. Конечно, нормальные клетки организма тоже страдают от яда, но частью из них можно пожертвовать. Поэтому важно подбирать такие дозы химического агента, которые смогут «отравить» опухоль и не погубить при этом большое количество здоровых тканей.
Излечимо — неизлечимо?
Но метод химиотерапии действует не всегда. И это может означать практически безнадежный случай. Один из них — аденокарцинома поджелудочной железы [4]. Таково научное название злокачественной опухоли, которая развивается в железистом эпителии. Рак поджелудочной железы занимает шестое место в мире по распространенности среди всех онкозаболеваний. Средняя продолжительность жизни больных после постановки диагноза — 6 месяцев. Причина в том, что к моменту обнаружения заболевания опухоль успевает не только значительно повредить железу, но и запустить метастазы в другие органы. Сегодня эта «неизлечимая» болезнь и механизмы ее развития являются объектом пристального медицинского наблюдения.
Почему карцинома не лечится химией?
Еще в 2012 году исследователи из Кембриджского института благотворительной организации Cancer Research UK (Cancer Research UK Cambridge Institute) [5] установили, что панкреатическая опухоль опасна из-за своей способности образовывать защитную капсулу, которая ограничивает количество кровеносных сосудов (рис. 1). Этот процесс называется десмоплазией и обеспечивается за счет звездчатых клеток, окружающих опухоль. В результате опухоль оказывается упакованной в некий защитный футляр, практически не пропускающий кровеносные сосуды. После воздействия химиотерапевтических агентов яды разносятся по всему телу с током крови. Однако аденокарцинома поджелудочной остается неуязвимым для ядов местом: нет кровеносных сосудов — нет и ядов, доставляемых по сосудам. При этом организм больного страдает, ведь рост опухоли не тормозится, а иммунная система ослабляется с каждым новым введением химии.
Дружелюбные соседи
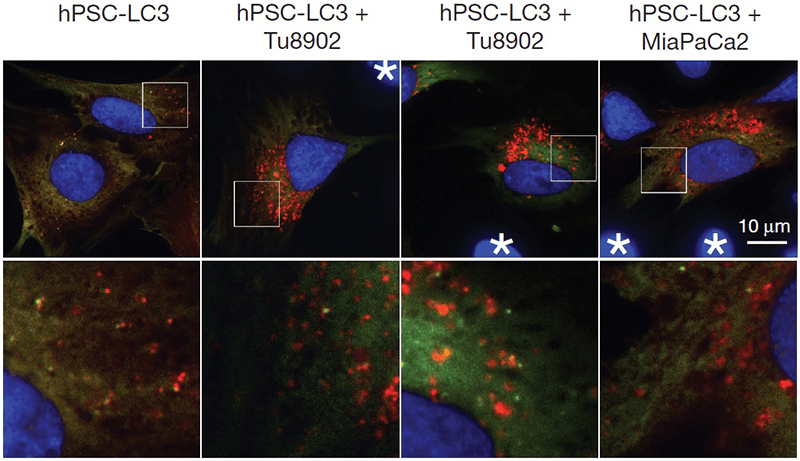
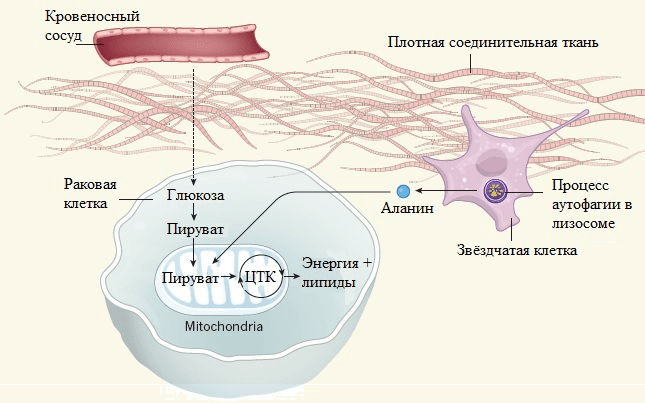
Как опухоли удается разрастаться в отсутствие кровеносных сосудов, «питающих» ее кислородом, глюкозой и остальными необходимыми веществами? В попытке раскрыть причину такой «стойкости» раковых клеток команда ученых из Гарвардской медицинской школы (Harvard Medical School) изучала ткани опухоли поджелудочной железы и их микроокружение [6]. Исследователь Криштован Соуза (Cristovão M. Sousa) проводил с коллегами эксперимент на панкреатических клетках человека и мышей. Они обнаружили, что опухоль стимулирует аутофагию [7], [8] соседних звездчатых клеток, в результате чего в них происходит «переваривание» собственных белков и разложение их на аминокислоты (рис. 2). Особо важна аминокислота аланин, которая активно поглощается опухолевыми клетками и поставляет им энергию.
Рисунок 2. Конфокальные изображения тканей опухоли и ее микроокружения. Ассоциации раковых клеток обозначены звездочками. Красным цветом обозначены лизосомы, в которых происходит процесс аутофагии. Оранжевым цветом обозначены пищеварительные вакуоли звездчатых клеток.
Аминокислота = энергия
Исследователям удалось проследить метаболический путь аланина, меченного углеродом 13 C, который поступает к клеткам опухоли [6], [9]. В них эта аминокислота транспортируется сначала в цитозоль — полужидкую внутреннюю среду, а затем в митохондрии — «энергетические станции» клетки. Здесь аланин в результате трансаминирования (переноса аминогруппы) превращается в пируват (рис. 3). Это вещество вовлекается в цикл трикарбоновых кислот, который поставляет клетке энергию и ряд важных метаболитов. Таким образом, пируват, получаемый из аланина, играет важную роль, снижая потребность раковых клеток в глюкозе и компенсируя поставки питательных соединений из тока крови. В результате глюкоза может быть использована для других функций — например, для производства аминокислоты серина, необходимой для биосинтеза нуклеиновых кислот, а значит, для поддержания процессов клеточного роста и деления.
Рисунок 3. Аланин из звездчатых клеток перемещается в митохондрии раковых клеток, где превращается в пируват. Пируват — надежный поставщик энергии и молекул липидов. Процесс переноса аминогруппы от аланина и превращение его в пируват можгут происходить и в цитозоле, однако пока неясно, почему аланин направляется именно в митохондрии. Возможно, это связано с тем, что молекула, принимающая аминогруппу от аланина (альфа-кетоглутарат) более доступна в митоходриях, а не во внутриклеточной среде. За счет этого обеспечивается быстрый и эффективный синтез пирувата. ЦТК — цикл трикарбоновых кислот.
Что нам дает исследование звездчатых клеток?
Процесс аутофагии зависит от лизосом — «переваривающих» блоков клетки, где белки подвергаются разложению. В работе исследователей из Гарвардской медицинской школы было продемонстрировано, что раковые клетки поджелудочной железы в момент нехватки энергии отправляют сигналы к соседним звездчатыми клеткам [6]. Те в ответ разлагают собственные белки, чтобы «прокормить» прожорливых соседей. Возможно, дальнейшее исследование сигналов, генерируемых опухолевыми клетками, позволит открыть способ «выключения» этих сигналов, а значит, поможет в борьбе с этим пока что неизлечимым заболеванием.
Новые перспективы: взгляд в будущее
Британские ученые из Имперского колледжа Лондона (Imperial College London) также изучали звездчатые клетки и то, как они влияют на прогрессирование рака поджелудочной железы [10]. Так, в здоровой поджелудочной железе звездчатые клетки не активны; при этом они способны запасать витамин А. Но в случае возникновения и развития онкологического заболевания эти самые клетки выходят из состояния покоя, теряя ретинол. Это является сигналом для звездчатых клеток, которые начинают работать не на себя, а на своих соседей — клетки опухоли. Получается, что витамин А выступает в роли своеобразного защитного агента, поддерживающего стабильность панкреатических клеток. В эксперименте было показано, что добавление в культуру активного метаболита витамина А восстанавливает внутреннюю среду звездчатых клеток и возвращает их в состоянии покоя. Исследователи сообщают, что пока еще рано говорить о глобальной роли ретинола в лечении карциномы поджелудочной железы. Однако новое знание о данном заболевании позволяет надеяться на то, что когда-нибудь врачи смогут справиться с этим сложным диагнозом.
В центре внимания раковые стволовые клетки
История онкологии началась с незапамятных времён. Первые систематические попытки лечения опухолей предпринимались ещё в Древнем мире. С тех пор прошло несколько тысячелетий, но и сейчас в подавляющем большинстве случаев полное излечение злокачественных новообразований недостижимо. Однако теперь мы хотя бы знаем, что за преграда не даёт нам достигнуть заветной цели. Раковые стволовые клетки, практически никому не известные ещё каких-нибудь пятнадцать лет назад, сегодня оказались в центре внимания учёных. Выяснилось, что буквально все клинические проблемы, от устойчивости онкологических заболеваний к различным препаратам до фатальных рецидивов спустя десятилетия после кажущегося исцеления, связаны с этими клетками.
Модель раковых стволовых клеток (РСК) подразумевает, что любое злокачественное новообразование (неоплазия) развивается из одной клетки. В результате неких событий генетический аппарат некогда нормальной клетки трансформируется настолько, что происходит её перерождение в инициирующую раковую клетку. В результате последующей пролиферации (деления) этой клетки формируется злокачественная опухоль. Согласно концепции РСК, эта опухоль устроена иерархически, то есть разные типы раковых клеток обладают разной способностью к делению.
Раковые стволовые клетки составляют лишь небольшую популяцию опухолевых клеток. Однако, будучи истинно стволовыми клетками, они (и только они) способны к неограниченному числу делений и постоянному самовоспроизведению. Число делений остальных клеток, если они способны к пролиферации (то есть формально обладают неким стволовым потенциалом), строго ограничено.
В основе процесса самовоспроизведения РСК лежит так называемый асимметричный тип деления стволовых клеток, который заключается в том, что родительская стволовая клетка даёт начало двум клеткам. Одна из них — с такими же стволовыми свойствами, что и материнская, другая же способна к ограниченному числу делений и поэтому называется частично дифференцированной, временно пролиферирующей раковой клеткой. Конечные потомки таких клеток — раковые клетки, не способные к делению. Их называют терминально дифференцированными. Соответственно иерархия опухолевой ткани выглядит так: раковые стволовые клетки → временно пролиферирующие раковые клетки → терминально дифференцированные раковые клетки. Два последних типа клеток образуют при этом основную массу опухоли.
Точно такая же иерархия имеет место и в нормальных тканях, стволовые клетки которых, способные к самовоспроизведению и поддержанию собственной популяции, также дают начало ограниченно пролиферирующим клеткам — предшественникам зрелых клеток. Эти зрелые тканевые клетки не способны к делению вовсе и погибают через какое-то время после выполнения свойственных им функций.
Итак, согласно модели раковых стволовых клеток, не все опухолевые клетки обладают равной способностью к делению и самовоспроизведению. И несмотря на то что основная масса опухоли состоит из злокачественных клеток той или иной степени дифференцировки, её рост и развитие определяются небольшой по численности, но наивысшей в иерархии популяцией раковых стволовых клеток.
Cловарик к статье
Клеточная дифференцировка — процесс клеточной дифференцировки заключается в так называемом созревании стволовой клетки-предшественника в клетку со строго определённым фенотипом (например, кардиомиоцит или пирамидный нейрон), называемую дифференцированной.
Пролиферация (от лат. proles — отпрыск, потомство и fero — несу) — разрастание ткани организма путём размножения клеток делением.
Репарация ДНК — внутриклеточная молекулярная система восстановления исходной последовательности ДНК после её повреждений.
Стохастический (от греч. στοχαστικός — умеющий угадывать) означает неопределённость, случайность чего-либо.
Фенотип (от греческого слова phainotip — являю, обнаруживаю) — совокупность характеристик, присущих индивиду на определённой стадии развития (особенности строения и жизнедеятельности).
Упреждая аргументы критиков РСК-модели, следует отметить, что некоторые злокачественные новообразования не вписываются в эту модель, а, скорее, соответствуют модели клональной эволюции. Есть виды неоплазий, при которых могут встречаться разные популяции раковых стволовых клеток, имеющих разные хромосомные нарушения. Хрестоматийные примеры таких новообразований — хроническая миелоидная лейкемия и колоректальный рак. В этих случаях РСК-модель не может полностью описать развитие опухоли, так как в соответствии с ней все клетки опухоли — потомки одной инициирующей РСК. Здесь же возможна либо инициация опухоли сразу из нескольких злокачественных стволовых клеток, формирующих несколько генетически различающихся клонов, либо эволюция одного клона из другого за счёт последовательного накопления генетических нарушений. Разные клоны могут обладать разной злокачественностью и соответственно могут конкурировать за ресурсы. Иными словами, будет проходить эволюция опухолевых клонов.
Рудольф Людвиг Карл Вирхов (1821–1902) — немецкий врач, антрополог, патолог и биолог, «отец» современной патологии, автор многих открытий.
Некоторые новообразования, отличающиеся экстремальной злокачественностью, также больше соответствуют модели клональной эволюции, нежели иерархической модели РСК. К ним относятся, например, различные злокачественные меланомы, при которых доля активно делящихся раковых клеток составляет чуть ли не более половины опухолевой массы. При этом в пределах одной опухоли сосуществуют РСК с различными фенотипами, которые при различных воздействиях на опухоль могут легко превращаться один в другой. Очевидно, что и для этих случаев РСК-модель не вполне подходит.
К первым работам, коснувшимся темы раковых стволовых клеток, можно отнести исследования Рудольфа Вирхова (Rudolf Virchow) полуторавековой давности. Вирхов занимался изучением особого вида злокачественных опухолей — тератокарцином. Эта форма новообразований отличается удивительной морфологией. Наряду со слабо дифференцированными, активно делящимися клетками в ней могут присутствовать дифференцированные клетки самых разных тканей (костной, мышечной, жировой, эпителиальной и прочих типов, включая волосы и ткани плаценты). В 1862 году Вирхов обнаружил, что данный тип рака развивается из эмбриональных клеток. Это дало начало теории «зародышевого остатка», постулировавшей развитие раковых заболеваний из клеток, соответствующих ранним этапам развития эмбриона, которые каким-то образом «сохранились» и вновь активировались во взрослом состоянии.
Более полувека спустя, в 1930-х годах, теория зародышевого остатка получила новый импульс. Гистологические наблюдения одной из опухолей мозга — медуллобластомы — показали, что её клетки морфологически очень напоминают клетки эмбрионального мозжечка, на основании чего было выдвинуто предположение, что эта форма опухолей мозга развивается из зародышевого остатка, состоящего из медуллобластов, утративших способность к дифференцировке.
Очередной значительный шаг на пути к концепции раковых стволовых клеток сделан в середине прошлого века. Исследования различных миелопролиферативных заболеваний (особой группы злокачественных новообразований, развившихся из клеток крови ** ) показали, что в развитие данной группы заболеваний могут быть вовлечены все ветви гемопоэза, за исключением лимфоидных ростков. Это послужило основанием для предположения, что все указанные патологии связаны со злокачественным перерождением клеток — предшественников всех остальных клеток миелоидного ряда, теперь известных как миелоидные cтволовые клетки.
Схема процесса образования клеток крови (гемопоэза). Плюрипотентные кроветворные стволовые клетки костного мозга дифференцируются в стволовые клетки — предшественники миелоидного (миелоидные стволовые клетки) и лимфоидного (лимфоидные стволовые клетки) ряда. Стволовые клетки лимфоидного ряда в конечном итоге дают начало многочисленным популяциям Т- и В-лимфоцитов. А мультипотентные миелоидные клетки дифференцируются в клетки — предшественники эритроцитов, тромбоцитов и олигопотентные миелобласты, дающие начало клеткам-предшественникам гранулоцитов (нейтрофилов, базофилов и эозинофилов) и моноцитов/макрофагов, которые вместе с лимфоцитами объединяют под термином «белые клетки крови».
В случае миелопролиферативных заболеваний злокачественная трансформация начинается в миелоидных стволовых клетках или их потомках и не затрагивает при этом лимфоидный росток, в результате чего все лимфоциты остаются нормальными (рисунок с сайта National Cancer Institute — с изменениями).
А уже в 1960 году Питер Ноуэл (Peter Nowell) и Дэвид Хангерфорд (David Hungerford) открыли уникальную взаимосвязь так называемой филадельфийской хромосомы с одним из миелопролиферативных заболеваний — хронической миелоидной лейкемией. Филадельфийская хромосома — следствие хромосомной аномалии, которая приводит к образованию мутантного белка BCR-ABL1. К несчастью, этот мутантный белок сохраняет способность одного из своих родительских белков (ABL) к передаче пролиферативного (стимулирующего деление клетки) сигнала внутрь клетки. Более того, он передаёт сигналы гораздо интенсивнее и при этом делится вне зависимости от внешних сигналов. В результате клетки, несущие такую мутацию, начинают быстро и неконтролируемо делиться. В дальнейшем наличие филадельфийской хромосомы при этом заболевании было подтверждено во всех клетках, не относящихся к лимфоидному ряду, на основании чего выдвинули гипотезу о происхождении всех клонов лейкемических клеток от одного предшественника.
Питер Ноуэлл (университет Пенсильвании, США, на фото — слева) и Дэвид Хангерфорд (Фокс Чэйс Раковый центр при Институте исследования рака, США) — первооткрыватели филадельфийской хромосомы (1960).
В 80-х годах прошлого века появилась стохастическая теория канцерогенеза, давшая начало упомянутой выше модели клональной эволюции опухоли. Стохастическая теория сочетала в себе эволюционную и мутационную теории старения (смерти) многоклеточных организмов. Основной её постулат состоит в том, что стохастическое «подпороговое» (то есть не приводящее к проявлению злокачественности) течение канцерогенных процессов происходит одновременно во многих клетках многоклеточного организма. Суть этих канцерогенных процессов заключается в последовательном накоплении соматических мутаций, то есть мутаций, происходящих в соматических (неполовых) клетках организма, не передающихся по наследству. При случайном стечении обстоятельств, когда эти процессы достигают «порогового» развития (имеют место нарушения в системе репарации ДНК и иммунной защите, а само число мутаций становится критическим), происходит злокачественное перерождение клетки. Скорость деления таких клеток существенно больше, чем у нормальных, что приводит к дальнейшему «лавинообразному» накоплению мутаций, поскольку система репликации (удвоения ДНК) допускает всё больше ошибок. В какой-то момент роста опухоли потомки «родительской» злокачественной клетки начинают различаться числом и качеством накопленных мутаций, что приводит к различиям в их скорости деления, отражающей степень их злокачественности. То есть в терминах эволюционной теории потомки одних раковых клеток будут иметь конкурентное преимущество перед клонами других клеток и в конце концов начнут численно превалировать в опухоли. В результате последующего накопления мутаций на базе «наиболее успешного клона» могут возникнуть ещё более злокачественные клетки, которые, в свою очередь, также займут «лидирующие позиции». Иными словами, будет иметь место клональная эволюция раковых клеток.
Как видно, модель клональной эволюции подразумевает, что одни раковые клоны отличаются большей злокачественностью, другие — меньшей, но в целом все они обладают сопоставимой способностью к делению. И в этом заключается принципиальное отличие стохастической теории канцерогенеза от иерархической теории, которая базируется на модели раковых стволовых клеток.
Основной причиной для критики стохастической теории канцерогенеза и модели клональной эволюции послужило открытое позднее несоответствие их наблюдаемым особенностям метастазирования опухолей. Новые методы исследования позволили обнаружить, что к образованию микрометастазов способно не более 10% циркулирующих в крово- и лимфотоке раковых клеток из первичной опухоли. И лишь доли процента из них образуют «полноценные» вторичные опухоли, снабжённые сосудистой сетью. Стало очевидным, что сопоставимой способностью к делению и инициации опухоли способна лишь малая часть раковых клеток, обладающих стволовыми характеристиками.
Тем не менее, как уже было упомянуто выше, модель клональной эволюции до сих пор не потеряла своей актуальности, поскольку в несколько большей степени, нежели модель РСК, объясняет развитие нескольких типов новообразований.
Долгое время концепция РСК находилась на вторых ролях. Однако в 1997 году Доминик Бонне (Dominique Bonnet, London Research Institute) и Джон Дик (John Dick, Toronto General Research Institute) продемонстрировали, что единичные лейкемические стволовые клетки, взятые у пациентов с острой миелоидной лейкемией, при трансплантации мышам дают начало полному спектру клеток с различными злокачественными фенотипами, наблюдаемыми при этом заболевании у человека. После этой работы число исследований, посвящённых РСК, стало лавинообразно нарастать.
В начале 2000-х годов раковые стволовые клетки были идентифицированы и в солидных опухолях (при одной из форм рака молочной железы). На сегодняшний день РСК описаны для абсолютного большинства форм онкологических заболеваний, и с этими клетками связывают все основные клинические проблемы в онкологии.
Однако в последнее время стало очевидным, что самовоспроизведение инициирующих РСК не единственный «источник» раковых стволовых клеток в опухоли. По мере развития (и в особенности под воздействием различных средств терапии) в первичной опухоли происходит генерация «вторичных» РСК из терминально или частично дифференцированных клеток. Скорее всего, именно такие РСК и участвуют в метастазировании. В некоторых работах указывается на то, что «вторичные» РСК могут отличаться по ряду фенотипических особенностей от «первичных» инициирующих РСК. Но принципиальная суть этих различий пока остаётся загадкой.
Здесь мы вплотную подошли к ещё одной концептуальной проблеме онкологии — гетерогенности опухоли. Дело в том, что новые высокоэффективные противоопухолевые лекарственные препараты, в отличие от классической цитотоксической химиотерапии, имеют таргетную (от англ. target — цель) природу. То есть они специфически «нацелены» на строго определённые белковые молекулы, которые, как ранее было установлено, играют важную роль в функционировании опухолевых клеток. Фенотипическая же гетерогенность опухолевых клеток приводит к тому, что определённые белки-мишени экспрессируются не во всех клетках опухоли. Соответственно та часть клеток, где эти белки не экспрессируются, останется нетронутой противоопухолевым препаратом.
Исследования последних лет показали, что опухолевая гетерогенность может быть весьма впечатляющей. Первый уровень гетерогенности заключается в описанной выше пролиферативной иерархии раковых клеток (РСК → временно пролиферирующие частично дифференцированные раковые клетки → неделящиеся полностью дифференцированные раковые клетки). Второй уровень гетерогенности заключается в том, что, как уже упоминалось, часть дифференцированных клеток меняет свой фенотип и «переходит» во вторичные РСК, фенотипически отличающиеся от первичных. Соответственно метастазы, формируемые этими клетками, тоже будут фенотипически отличаться от первичных опухолей. Наконец, ещё один источник гетерогенности — возможность сосуществования в одной опухоли нескольких пулов инициирующих РСК, сформированных в результате независимого злокачественного перерождения двух разных нормальных клеток или «эволюционировавших» одна в другую. Ситуация усугубляется ещё и лабильностью фенотипов РСК (способностью к быстрой смене одного фенотипа на другой). То есть случайно или в результате какого-либо терапевтического воздействия разные пулы РСК могут менять свой фенотип и «переходить» друг в друга.
Схематическое изображение возможных механизмов гетерогенности опухолевых клеток. Внизу — фенотипические различия раковых клеток первичной опухоли и метастазов. Схема сильно упрощена, поскольку не учитывает фенотипические различия между вторичными метастатическими РСК и первичными инициирующими РСК. Вверху — схема путей генерации опухолевой гетерогенности. Рисунок автора
Очевидно, что опухолевая гетерогенность представляет собой серьёзнейшую проблему. Уже сейчас ни для кого не секрет, что современные препараты годятся не для всех пациентов, в связи с чем персонифицированный подход, при котором лечение подбирается в зависимости от молекулярно-генетических особенностей конкретного пациента, становится новым трендом в медицине. В контексте же опухолевой гетерогенности, как замечают с иронией некоторые специалисты, «персонифицированность» должна теперь сводиться не к отдельно взятому пациенту, а к отдельной клетке (single-cell medicine).
Ещё одна неприятная особенность раковых стволовых клеток — их чрезвычайная устойчивость ко всем известным видам лечения. Какой бы вид противоопухолевой терапии ни применялся (радио-, химио-, иммунотерапия, таргетная), РСК будут погибать последними, когда все дифференцированные раковые клетки уже успешно побеждены.
Известно несколько механизмов терапевтической устойчивости РСК. Во-первых, РСК характеризуются повышенной экспрессией транспортных белков семейства ABC (ATP-binding cassette). Это эволюционно консервативные белки, присутствующие у всех организмов — от бактерий до человека. В норме они локализуются преимущественно в плазматической мембране клеток и отвечают за транспорт полезных веществ (например, витаминов) в клетку и выведение из неё вредных токсинов и ксенобиотиков. В РСК эти белки экспрессируются на особенно высоком уровне и отвечают за выведение из них различных химиотерапевтических препаратов.
Во-вторых, РСК, как никакие другие клетки, отличаются обилием фермента альдегид-дегидрогеназы (ALDH). В норме функция этого белка — окисление токсичных для организма альдегидов до карбоновых кислот. В РСК же он отвечает за инактивацию многих химиотерапевтических препаратов.
В-третьих, РСК отличаются экстремальной устойчивостью к апоптозу — особой молекулярной программе запуска «самоубийства» клетки в ответ на различные повреждающие воздействия. В раковых стволовых клетках эта программа практически заглушена. Именно поэтому после, например, тяжёлого ионизирующего облучения РСК не погибают. Вместо этого они активизируют восстановление повреждений ДНК и через какое-то время вновь приобретают способность к делению. Но поскольку повреждения ДНК «залатываются» экстренно, этот процесс сопровождается новыми мутациями и РСК становятся ещё злокачественнее. Более того, как было показано совсем недавно, даже в тех случаях, когда удаётся добиться апоптоза РСК, эти клетки, при определённых условиях, способны к обратной «самосборке» после их разрушения с полным восстановлением функций и усилением злокачественности.
Это основные, но далеко не все механизмы устойчивости РСК. В тех же случаях, когда системы резистентности РСК к терапии дают сбой, раковые стволовые клетки впадают в дормантность (состояние покоя), в которой они могут пребывать несколько десятилетий, после чего активируются и обусловливают скоротечный фатальный рецидив. Дормантные РСК отличаются очень низким уровнем метаболизма, экстремальной устойчивостью к повреждающим воздействиям и практически не экспрессируют поверхностные белки, которые могли бы послужить мишенями для создания таргетных препаратов. На сегодняшний день дормантные РСК представляют собой наибольшую трудность для лечения. Однако надежда на успех есть. Во-первых, испытываются и неплохо себя проявляют различные сложные комбинации уже существующих таргетных препаратов. Во-вторых, удалось вплотную приблизиться к получению препаратов, воздействующих на процессы, лежащие в основе образования вторичных метастатических РСК. В-третьих, обнаружены белки, отвечающие за дормантность РСК и обеспечение их жизнеспособности в состоянии покоя. Наконец, разрабатываются препараты, способствующие выходу РСК из дормантности, что делает их более чувствительными к существующим формам терапии.
* Большинство ведущих специалистов сегодня склоняются к мнению, что универсального сценария развития опухоли не существует. Возможна реализация обеих моделей.
** В просторечии — «рак крови». Терминологически — это грубая ошибка.
*** Само злокачественное перерождение может быть результатом одного или нескольких канцерогенных событий (например, мутаций, но не только их).