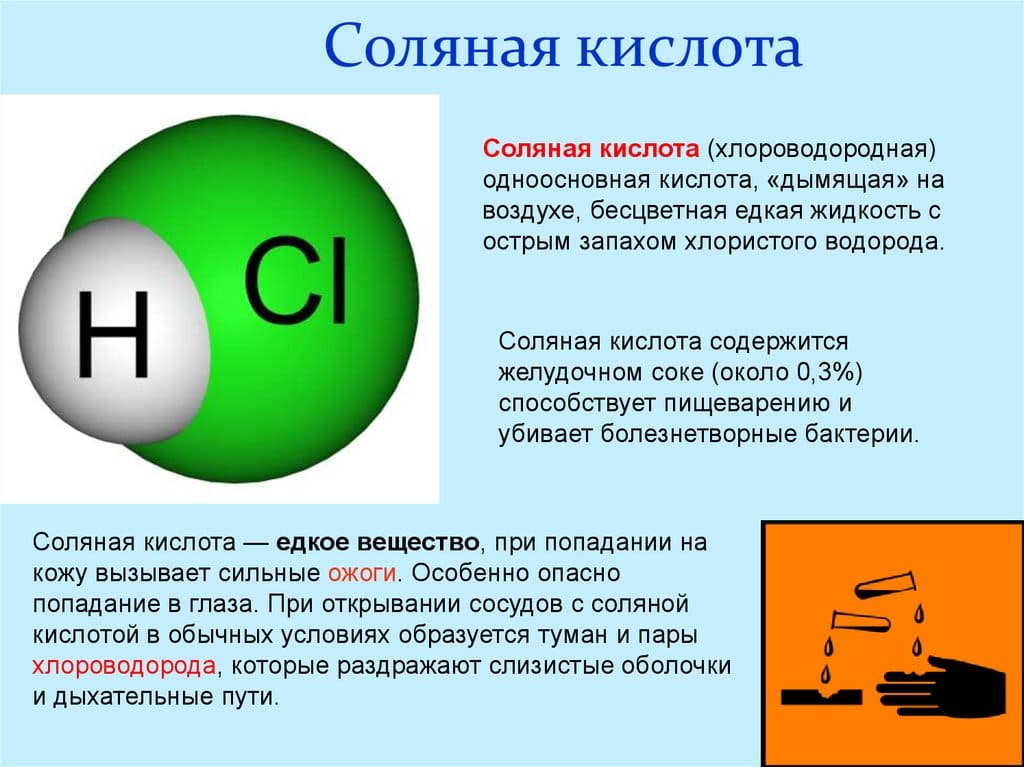
Чем пахнет соляная кислота
Соляная кислота. Свойства, производство, применение и цена соляной кислоты
Этого достаточно, чтобы разрушить бритвенное лезвие. Нужно всего около недели. Эксперименты, конечно, проводили вне человеческого тела.
Опасный предмет повредил бы пищевод, не задержался бы в желудке в течение 7-ми дней.
Какие еще эксперименты ставили ученые и чем пополнили список свойств соляной кислоты, расскажем далее.
Свойства соляной кислоты
Формула соляной кислоты – это смесь воды и хлористого водорода. Соответственно, жидкость едкая, что и позволяет ей разрушать большинство веществ.
На вид реагент бесцветный. Выдает его запах. Он кислый, удушливый. Аромат резкий и, скорее, характеризуется, как вонь.
Это критическая точка, при которой вещество попросту испаряется. Улетучивается и хлороводород, и вода.
При этом, естественно, раствор дымится. Максимальная концентрация указана для 20-градусной температуры воздуха. Чем больше градусов, тем быстрее протекает испарение.
Плотность 38-процентной кислоты чуть превышает 1 грамм на кубический сантиметр.
То есть, даже концентрированное вещество весьма водянисто. Хлебнешь такую жидкость, получишь ожоги.
А вот слабый 0,4-процентный раствор можно выпить. Естественно, в небольших количествах. Разбавленная кислота почти не пахнет, а вкус у нее терпко-кислый.
Взаимодействие соляной кислоты с другими веществами, во многом, обосновано одноосновным составом реагента.
Это значит, что в формулу кислоты входит лишь один атом водорода. Значит, в воде реагент диссоциирует, то есть, растворяется, полностью.
Остальные вещества, как правило, растворяются уже в самой кислоте. Так, в ней распадаются все металлы, стоящие в периодической системе перед водородом.
Главное, чтобы последние были получены от более слабых кислот. Соляная считается одной из самых сильных, ставится в один ряд с серной.
Из газов соляная кислота бурно реагирует с аммиаком. При этом, образуется хлорид аммония. Он кристаллизуется.
Частицы столь мелкие, а реакция столь активна, что хлорид устремляется вверх. Внешне это белый дым.
Реакция с нитратом серебра считается качественной, поскольку является специфической, не свойственной остальным однокомпонентным кислотам.
Они игнорируют благородные металлы, к коим относится и аргентум. Как помните, серебро стоит в химическом ряду после водорода и, по идее, не должно взаимодействовать с растворенным в воде хлороводородом.
Добыча соляной кислоты
Выделяется соляная кислота не только в лабораторных условиях, но и природе. Человеческий организм – ее часть.
Но, соляная кислота в желудке уже обсуждалась. Однако, это не единственный природный источник, причем, в прямом смысле.
Реагент встречается в некоторых гейзерах и прочих выходах воды вулканического происхождения.
Что же касается отдельно хлороводорода, он входит в состав бишофита, сильвина, галита. Все это – минералы.
Под словом «галит» скрывается обычная соль, которую употребляют в пищу, то есть, хлорид натрия.
Для промышленного получения реагента подходят все перечисленные минералы.
Но, чаще всего используют хлорид натрия. Соляная кислота получается, когда на поваренную соль воздействуют концентрированной серной кислотой.
Суть метода сводится к растворению газообразного хлороводорода в воде. На этом основаны еще два подхода.
Первый – синтетический. Водород сжигают в хлоре. Второй – абгазный, то есть, попутный.
Используется хлороводород, попутно получаемый при работе с органическими соединениями, то есть, углеводородами.
Абгазный хлороводород образуется при дегидрохлорировании и хлорировании органики.
Вещество, так же, синтезируется при пиролизе хлорорганических отходов. Пиролизом химики именуют разложение углеводородов в условиях дефицита кислорода.
Попутным сырье для соляной кислоты бывает и при работе с неорганическими веществами, к примеру, хлоридами металлов.
Тот же сильвин, к примеру, идет на производство калиевых удобрений. Магний тоже нужен растениям.
Поэтому, без дела не остается и бишофит. В итоге, производят не только подкормки, но и соляную кислоту.
Абгазный метод вытесняет остальные способы получения соляной кислоты. На «побочную» индустрию приходятся 90% производимого реагента. Узнаем, зачем его изготовляют, где применяют.
Применение соляной кислоты
Соляная кислота используется металлургами. Реагент нужен для декапирования металлов.
Так называют процесс удаления окалин, ржавчины, окислов и просто грязи. Соответственно, кислоту применяют и частные мастера, работая, к примеру, с винтажными вещами, в коих есть металлические детали.
Реагент растворит их поверхность. От проблемного слоя не останется и следа. Но, вернемся к металлургии.
В этой отрасли кислоту начинают применять для извлечения из руд редких металлов.
Старые методы основаны на использовании их оксидов. Но, не все из них легки в обработке.
Раз соляная кислота содержится в желудочном соке, а раствор малой концентрации можно выпить, значит, реагент можно применять и в пищевой промышленности.
Увидели на упаковке продукта добавку Е507? Знайте, это соляная кислота. Она придает ту самую кислинку и терпкость некоторым пирожным, колбасам.
Но, наиболее часто пищевой эмульгатор добавляют во фруктозу, желатин и лимонную кислоту.
Е507 нужна не только для вкуса, но и в качестве регулятора кислотности, то есть Ph продукта.
Соляная кислота может применяться в медицине. Слабый раствор соляной кислоты прописывают пациентам с пониженной кислотность желудка.
Она не менее опасна, чем повышенная. В частности, увеличивается вероятность рака желудка.
Организм недополучает полезные элементы, даже, если человек принимает витамины и правильно питается.
Дело в том, что для адекватного, полноценного всасывания полезных веществ, нужна стандартная кислотность.
Последнее применение реагента очевидно. Из кислоты получают хлор. Достаточно выпарить раствор.
Получается, будучи активной и агрессивной, соляная кислота необходима человечеству. Есть спрос, — есть предложение. Узнаем цену вопроса.
Цена соляной кислоты
Цена продукта зависит от вида. Техническая кислота дешевле, очищенная – дороже. За литр первой просят 20-40 рублей.
Стоимость зависит от концентрации. За литр очищенного реагента дают примерно на 20 рублей дороже.
Ценник зависит и от тары, фасовки, формы продажи. Приобретение кислоты в пластиковых канистрах по 25-40 литров выгоднее.
За 50 миллилитров отдашь 100-160 рублей. Это самая дорогостоящая соляная кислота.
Купить раствор хлороводорода в литровой таре тоже не дешево. Фасовка рассчитана на частного потребителя, поэтому, за бутыль просят около 400-500 рублей.
Техническая кислота в рознице встречается реже, стоит примерно на 100 рублей дешевле. Основной же рынок – оптовый.
Закупаются крупные предприятия. Именно для них актуальны цены, обозначенные в начале главы. В розницу гиганты рынка не торгуют.
Соответственно, стоимость вещества в небольших магазинах – отражение «аппетитов» владельцев лавок.
Кстати, об аппетите. Если кислотность в желудке повышена, пища переваривается быстрее, чаще хочется есть.
Это приводит к худобе, гастриту и язвам. Люди же с пониженной кислотностью склонны к зашлакованности, ведь пища долго «бродит» в желудке, плохо усваивается.
Это отражается на коже, как правило, в виде акне и черных точек. Есть такая проблема?
Задумайтесь не о дорогой косметике, а о проверке желудочно-кишечного тракта.
Соляная кислота — одна из самых сильных кислот, чрезвычайно востребованный реактив
Соляная кислота — неорганическое вещество, одноосновная кислота, одна из 
Свойства
Кислота в чистом виде представляет собой жидкость без цвета и запаха. Техническая кислота обычно содержит примеси, которые придают ей слегка желтоватый оттенок. Соляную кислоту часто называют «дымящей», так как она выделяет пары хлороводорода, вступающие в реакцию с влагой воздуха и образующие кислотный туман.
Очень хорошо растворяется в воде. При комнатной температуре максимально возможное по массе содержание хлороводорода —38%. Кислота концентрации большей 24% считается концентрированной.
Хлористоводородная кислота активно вступает в реакции с металлами, оксидами, гидроксидами, образуя соли — хлориды. HCl взаимодействует с солями более слабых кислот; с сильными окислителями и аммиаком.
Для определения соляной кислоты или хлоридов используют реакцию с нитратом серебра AgNO3, в результате которой выпадает белый творожистый осадок.
Техника безопасности

При разливе кислоты ее смывают большим количеством воды или нейтрализуют щелочным растворами. Пострадавших от кислоты следует вынести из опасной зоны, промыть кожу и глаза водой или содовым раствором, вызвать врача.
Перевозить и хранить хим реактив допускается в стеклянной, пластиковой таре, а также в металлической таре, покрытой изнутри резиновым слоем. Тара должна герметично закрываться.
Получение
В промышленных масштабах соляную кислоту получают из газообразного хлороводорода (HCl). Сам хлороводород производится двумя основными способами:
— экзотермической реакцией хлора и водорода — таким образом получают реактив высокой чистоты, например, для пищевой промышленности и фармацевтики;
— из сопутствующих промышленных газов — кислота на основе такого HCl называется абгазной.
Это любопытно
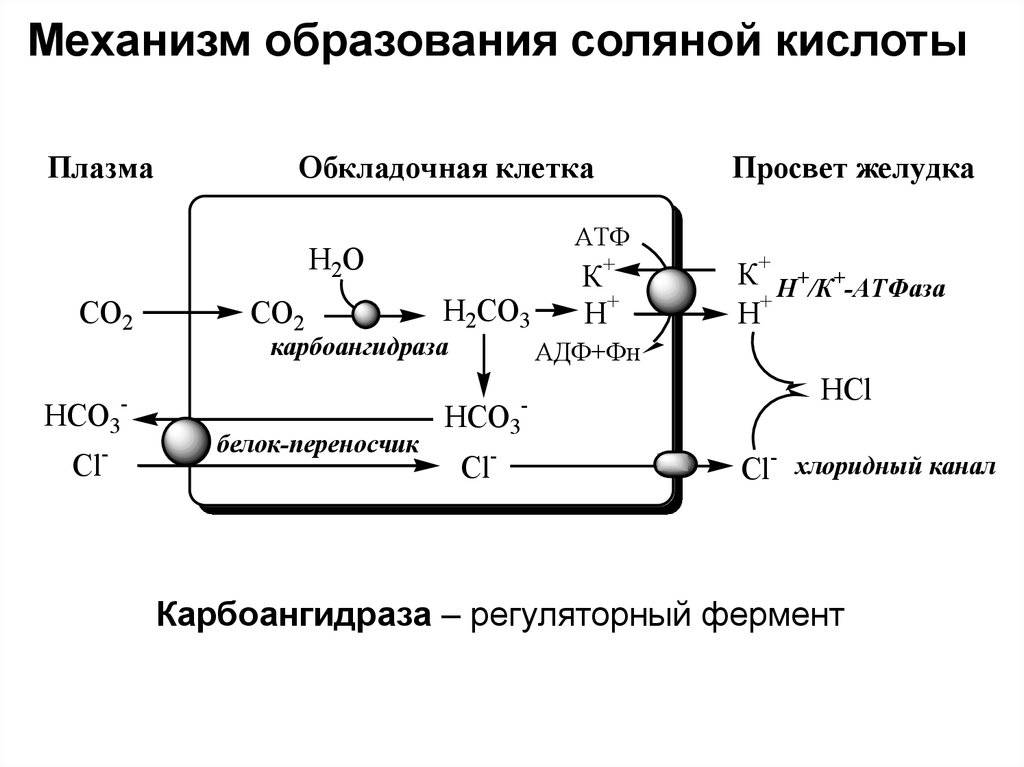
Именно соляной кислоте природа «поручила» процесс расщепления пищи в организме. Концентрация кислоты в желудке составляет всего 0,4%, но этого оказывается достаточно, чтобы за неделю переварить бритвенное лезвие!
Кислота вырабатывается клетками самого желудка, который защищен от этой агрессивной субстанции слизистой оболочкой. Тем не менее, его поверхность обновляется ежедневно, чтобы восстановить поврежденные участки. Кроме участия в процессе переваривания пищи, кислота выполняет еще и защитную функцию, убивая болезнетворные микроорганизмы, попадающие в организм через желудок.
Применение
— В медицине и фармацевтике — для восстановления кислотности желудочного сока при его недостаточности; при анемии для улучшения всасываемости железосодержащих лекарств.
— В пищепроме это пищевая добавка, регулятор кислотности Е507, а также ингредиент сельтерской (содовой) воды. Используется при изготовлении фруктозы, желатина, лимонной кислоты.
— В химической промышленности — основа для получения хлора, соды, 
— Больше всего производимой в мире хлористоводородной кислоты расходуется в металлургии для очистки заготовок от окислов. Для этих целей применяется ингибированная техническая кислота, в состав которой введены специальные ингибиторы (замедлители) реакции, благодаря чему реактив растворяет окислы, но не сам металл. Также соляной кислотой травят металлы; очищают их перед лужением, пайкой, гальванированием.
— Обрабатывают кожу перед дублением.
— В добывающей отрасли востребована для очистки буровых скважин от отложений, для обработки руд и горных пластов.
— В лабораторной практике хлористоводородная кислота используется как популярный реактив для аналитических исследований, для очистки сосудов от трудноудаляемых загрязнений.
— Применяется в каучуковой, целлюлозно-бумажной индустрии, в черной металлургии; для очистки котлов, труб, оборудования от сложных отложений, накипи, ржавчины; для очистки керамических и металлических изделий.
Соляная кислота
Соляная кислота — образовавшаяся сильная одноосновная кислотная среда, при растворении газа хлороводорода в жидкости. Это бесцветная жидкость либо газ, имеет очень сильный удушливый запах хлора. Синонимы: хлороводородная кислота, хлороводород, хлористоводородная кислота.
Информацию по наличию товара вы можете получить по телефону
Оплатить заказ вы можете через систему Qiwi или банковским переводом. Для юридических лиц предусмотрен безналичный способ оплаты. Так же при самовывозе возможен наличный расчёт.
1л – 500.00 руб
5л – 2000.00 руб
10л –4500.00 руб
Соляная кислота — образовавшаяся сильная одноосновная кислотная среда, при растворении газа хлороводорода в жидкости. Это бесцветная жидкость либо газ, имеет очень сильный удушливый запах хлора. Синонимы: хлороводородная кислота, хлороводород, хлористоводородная кислота.
Соляная кислота важна для промышленности. Например, в гидрометаллургии с её помощью осуществляют травление, в гальванопластике — декапирование. Будучи одной из сильнейших одноосновных кислот, она легко удаляет с металлической поверхности остатки посторонних веществ. Это делает её незаменимой в процессах лужения при пайке. Используется для получения хлоридов различных по свойствам металлов:
Её применяют в керамике, поскольку она эффективно очищает поверхности от загрязнений и уничтожает вредные бактерии. Используется и в пищевой промышленности, только не концентрированная соляная кислота, а специально обработанная. Из неё изготавливают содовую воду, она входит в пищевую добавку Е507. Используется в медицине, включается в структуру ферментных препаратов, применяющихся в гастроэнтерологии при пониженной кислотности.
Информация о продукте. Физические и химические свойства
При взаимодействии с металлами образуются соли — хлориды. Этот процесс сопровождается выделением газообразного водорода. Хлороводород реагирует не только с металлами, но и с их оксидами и гидроксидами. Результат — образование двух соединений: легко растворимой соли и воды.
Соляная кислота взаимодействует с солями, образованными более слабыми кислотами. В результате таких химических реакций образовывается водород и газообразный хлор. Для этого нужно вступить во взаимодействие с сильными окислителями, например, перманганатом калия. Реагирует хлористый водород и с аммиаком, в результате чего образуется хлорид аммония.
Как происходит синтез продукта. Способы обращения
Хлористоводородную кислоту получают разными способами. Среди них:
В промышленности часто используется техническая соляная кислота. Она характеризуется желтоватым оттенком, его вызывают примеси металлов и хлора.
Концентрированная соляная кислота хранится отдельно от других веществ, в защищённом от солнечных лучей месте, в проветриваемом помещении. Она должна находиться в герметичной таре, так как быстро выветривается. На промышленных складах необходимы ограждения, собирающие хлористый водород в случае утечки, нелишними будут средства нейтрализации.
Специфический товар
Поскольку HCl относится к опасным химическим соединениям, купить её возможно только у специальных продавцов. К такой относится компания «REAKTIV24.RU». У нас заказывают реактивы:
Свою деятельность REAKTIV24.RU осуществляет на основании лицензии, работаем в формате интернет-магазина. Есть возможность заказать у нас синтез концентрированной или технической соляной кислоты. Продаём продукцию оптом и в розницу, осуществляем доставку. Готовые растворы хлороводородной кислоты хранятся на специально оборудованных складах. Стоимость продукта указана на сайте.
Соляная кислота: влияние на экологию и здоровье человека. Справка
Соляная кислота (хлористоводородная кислота) – водный раствор хлористого водорода HCl, представляет собой прозрачную бесцветную жидкость с острым запахом хлористого водорода. Техническая кислота имеет желтовато-зеленый цвет из-за примесей хлора и солей железа. Максимальная концентрация соляной кислоты около 36% HCl; такой раствор имеет плотность 1,18 г/см3. Концентрированная кислота на воздухе «дымит», так как выделяющийся газообразный HCl образует с водяным паром мельчайшие капельки соляной кислоты.
Соляная кислота не горюча, не взрывоопасна. Она является одной из самых сильных кислот, растворяет (с выделением водорода и образованием солей – хлоридов) все металлы, стоящие в ряду напряжений до водорода. Хлориды образуются и при взаимодействии соляной кислоты с окислами и гидроокисями металлов. С сильными окислителями она ведет себя как восстановитель.
Соли соляной кислоты – хлориды, за исключением AgCl, Hg2Cl2, хорошо растворимы в воде. К ней устойчивы стекло, керамика, фарфор, графит, фторопласт.
Получают соляную кислоту растворением в воде хлористого водорода, который синтезируют или непосредственно из водорода и хлора или получают действием серной кислоты на хлорид натрия.
Выпускаемая техническая соляная кислота имеет крепость не менее 31% HCl (синтетическая) и 27,5% HCl (из NaCI). Торговую кислоту называют концентрированной, если она содержит 24% и больше HCl, если содержание HCl меньше, то кислота называется разбавленной.
Соляную кислоту применяют для получения хлоридов различных металлов, органических полупродуктов и синтетических красителей, уксусной кислоты, активированного угля, различных клеев, гидролизного спирта, в гальванопластике. Ее применяют для травления металлов, для очистки различных сосудов, обсадных труб буровых скважин от карбонатов, окислов и др. осадков и загрязнений. В металлургии кислотой обрабатывают руды, в кожевенной промышленности – кожу перед дублением и крашением. Соляную кислоту применяют в текстильной, пищевой промышленности, в медицине и т. д.
Соляная кислота играет важную роль в процессах пищеварения, она является составной частью желудочного сока. Разведенную соляную кислоту назначают внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока.
Транспортируют соляную кислоту в стеклянных бутылях или гуммированных (покрытых слоем резины) металлических сосудах, а также в полиэтиленовой посуде.
Соляная кислота очень опасна для здоровья человека. При попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза.
При попадании соляной кислоты на кожные покрытия ее необходимо немедленно смыть обильной струей воды.
Очень опасны туман и пары хлороводорода, образующиеся при взаимодействии с воздухом концентрированной кислоты. Они раздражают слизистые оболочки и дыхательные пути. Длительная работа в атмосфере HCl вызывает катары дыхательных путей, разрушение зубов, помутнение роговицы глаз, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства.
Острое отравление сопровождается охриплостью голоса, удушьем, насморком, кашлем.
В случае утечки или разлива соляная кислота может нанести существенный ущерб окружающей среде. Во-первых, это приводит к выделению паров вещества в атмосферный воздух в количествах превышающих санитарно-гигиенические нормативы, что может повлечь отравление всего живого, а также появлению кислотных осадков, которые могут привести к изменению химических свойств почвы и воды.
Во-вторых, она может просочиться в грунтовые воды, в результате чего может произойти загрязнение внутренних вод.
Там, где вода в реках и озерах стала довольно кислой (рН менее 5) исчезает рыба. При нарушении трофических цепей сокращается число видов водных животных, водорослей и бактерий.
В городах кислотные осадки ускоряют процессы разрушения сооружений из мрамора и бетона, памятников и скульптур. При попадании на металлы соляная кислота вызывает их коррозию, а, реагируя с такими веществами, как хлорная известь, диоксид марганца, или перманганат калия, образует токсичный газообразный хлор.
В случае разлива соляную кислоту смывают с поверхностей большим количеством воды или щелочного раствора, который нейтрализует кислоту.
Материал подготовлен на основе информации открытых источников
Описание соляной кислоты: формула, свойства и применение
Кислоты – это химические соединения способные отдавать протон или принимать электронную пару с образованием ковалентной связи. Данный класс веществ имеет различные классификации: по числу атомов водорода, по происхождению, по силе. Соляная кислота является сильной, одноосновной неорганической кислотой.
Формула и другие названия соляной кислоты
В состав соляной кислоты входят два химических элемента: хлор и водород. Данная кислота состоит из двух атомов и имеет формулу: HCl. Стоит отметить, что соляная кислота – это тривиальное название (т.е. название, применяемое в обиходной речи химиков, не отражающее состава). По международной номенклатуре ИЮПАК вещество с формулой HCl принято называть хлороводородной кислотой. Иногда HCl называют хлористоводородной кислотой или хлористым водородом, также приемлемо название – хлорид водорода.
Физические свойства
Физические свойства HCl коррелируют с концентрацией данного соединения в растворе. Для того, чтобы не перегружаться цифрами, рассмотрим физические свойства хлористого водорода на примере его концентрированной формы (около 36%):
Химические свойства
Химические свойства хлорида водорода можно подразделить на общие (характерные для всех соединений, основным свойство которых является отдача протона) и специфические (характерные только для HCl). Общие свойства:
Специфические свойства соляной кислоты:
Получение соляной кислоты
Промышленный способ получения хлористого водорода заключается в горении водорода в хлоре и последующим растворением образовавшегося вещества в воде. Существует и другой способ получения хлороводородной кислоты, применяемый в лабораторных условиях. Суть способа заключается в реакции поваренной соли(NaCl) с концентрированно серной кислотой при нагревании. В результате получаются следующие соединения: гидросульфат натрия и хлорид водорода, если провести химическое взаимодействие между образовавшимися продуктами, то образуется сульфат натрия и 2 молекулы хлористого водорода. Приведем общее уравнение реакции: 2NaCl + H2SO4 = Na2SO4 + 2HCl.
Области применения
Хлорид водорода является ключевым реагентом в химической промышленности, однако данное соединение нашло себе применение во многих отраслях человеческого деятельности.
В химической промышленности
В химической промышленности хлористый водород применяют для синтез хлорорганических соединений, а хлорсодержащих солей различных металлов.
В металлургии
В металлургии HCl используется с целью очистки металла после лужения (процесса нанесения олова с целью защиты металла от коррозии).
В пищевой промышленности
33% раствор HCl активно применяют в пищевом производстве в качестве регулятора pH, предназначенного для очистки воды.
В быту
В домохозяйстве HCl используют в составе моющих, хлорсодержащих средств.
В сельском хозяйстве
В сельскохозяйственной деятельности HCl применяется в составе хлорорганических веществ, которые используются в качестве органических ядохимикатов.
В медицине
В медицинской практике применяют слабые растворы хлористого водорода с целью улучшения пищеварения.
В строительстве
В строительстве HCl используют для очистки красного кирпича от грязи. Также использование растворов HCl повышает морозостойкость и влагостойкость бетонных конструкций, что способствует постройке более долгоживущих зданий.
Интересные факты
Приведем ряд фактов о хлороводородной кислоте, которые удивят обывателя: