Чем отличаются температуры плавления веществ с различными кристаллическими решетками
Чем отличаются температуры плавления веществ с различными кристаллическими решетками?
Чем отличаются температуры плавления веществ с различными кристаллическими решетками:
а) ионной;
б) атомной;
в) молекулярной?
Обсуждение вопроса:
а) Вещества с ионными кристаллическими решетками имеют высокие температуры плавления, так как разноименно заряженные ионы сильно притягиваются друг к другу, между ионами возникает прочная химическая связь.
б) Вещества с атомными кристаллическими решетками имеют высокие температуры плавления, так как атомы прочно удерживаются вместе ковалентными связями.
в) Вещества с молекулярными кристаллическими решетками имеют низкие температуры плавления, так как молекулы не связаны химической связью.
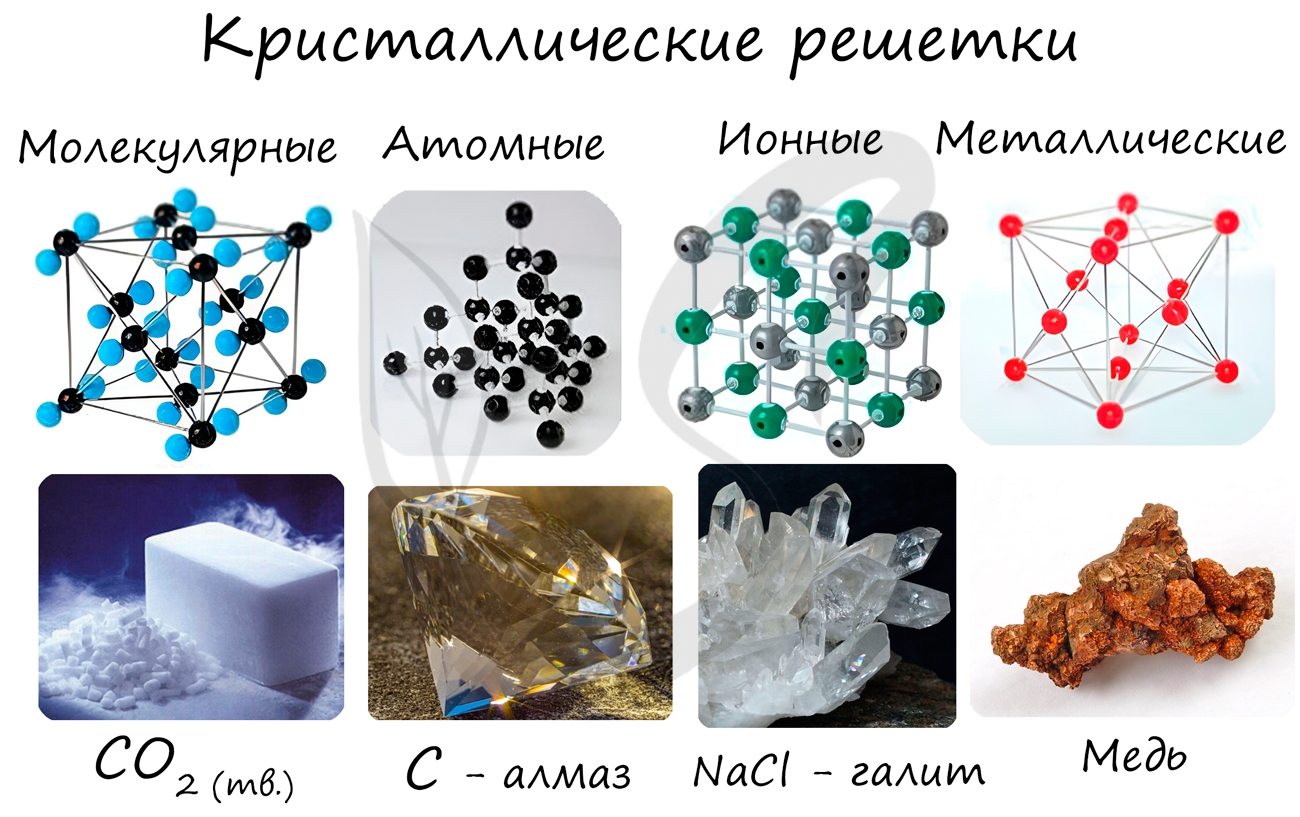
В зависимости от природы частиц, расположенных в узлах, и характера связи между ними различают четыре типа кристаллических решёток: ионную, металлическую, атомную и молекулярную.
Ионные кристаллические решётки имеют соли, щёлочи, оксиды активных металлов. Связи между ионами в таких кристаллах прочные. Поэтому ионные вещества твёрдые, тугоплавкие, нелетучие.
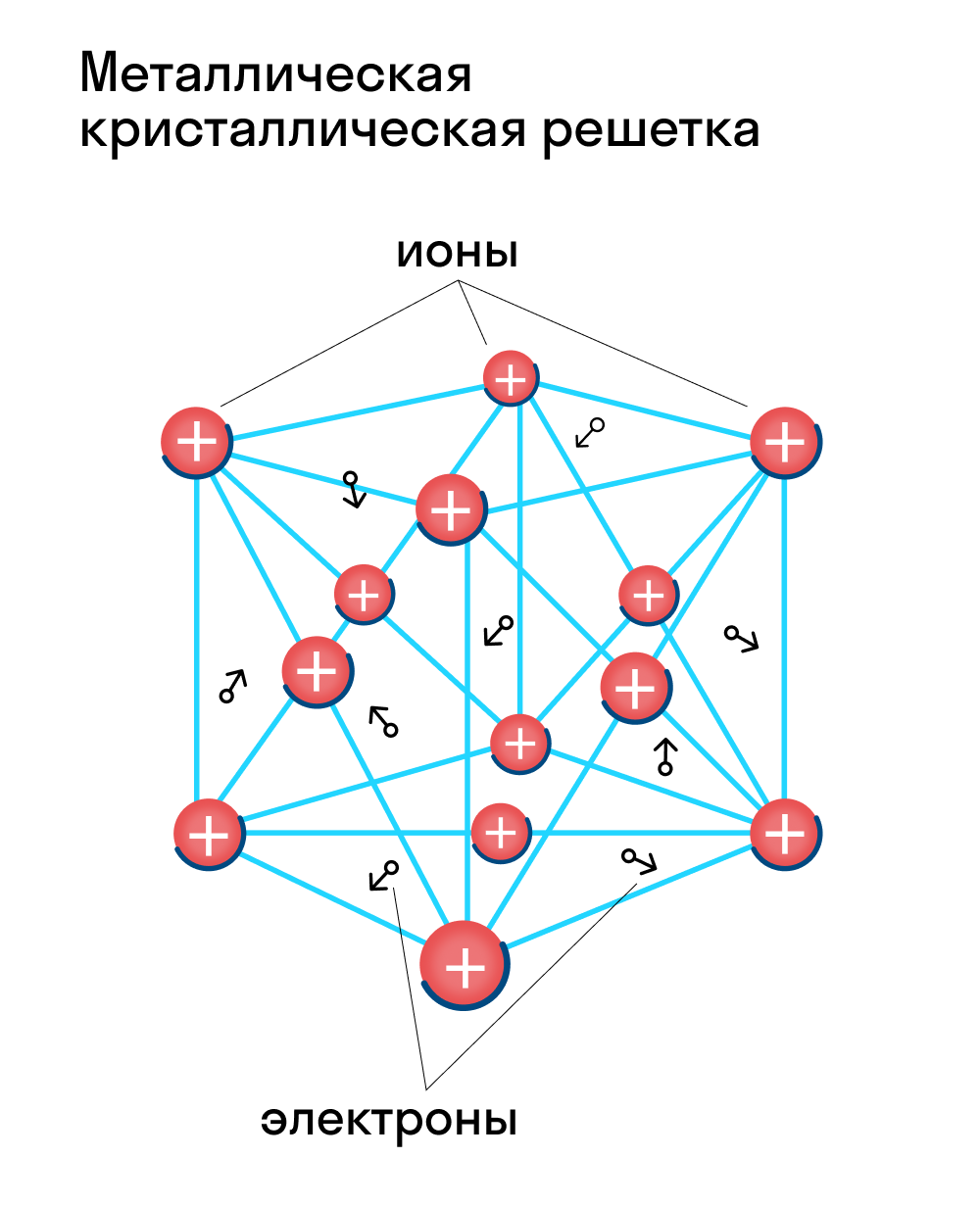
Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов. Температуры плавления металлов могут быть разными (от –37 °С у ртути до двух-трёх тысяч градусов).
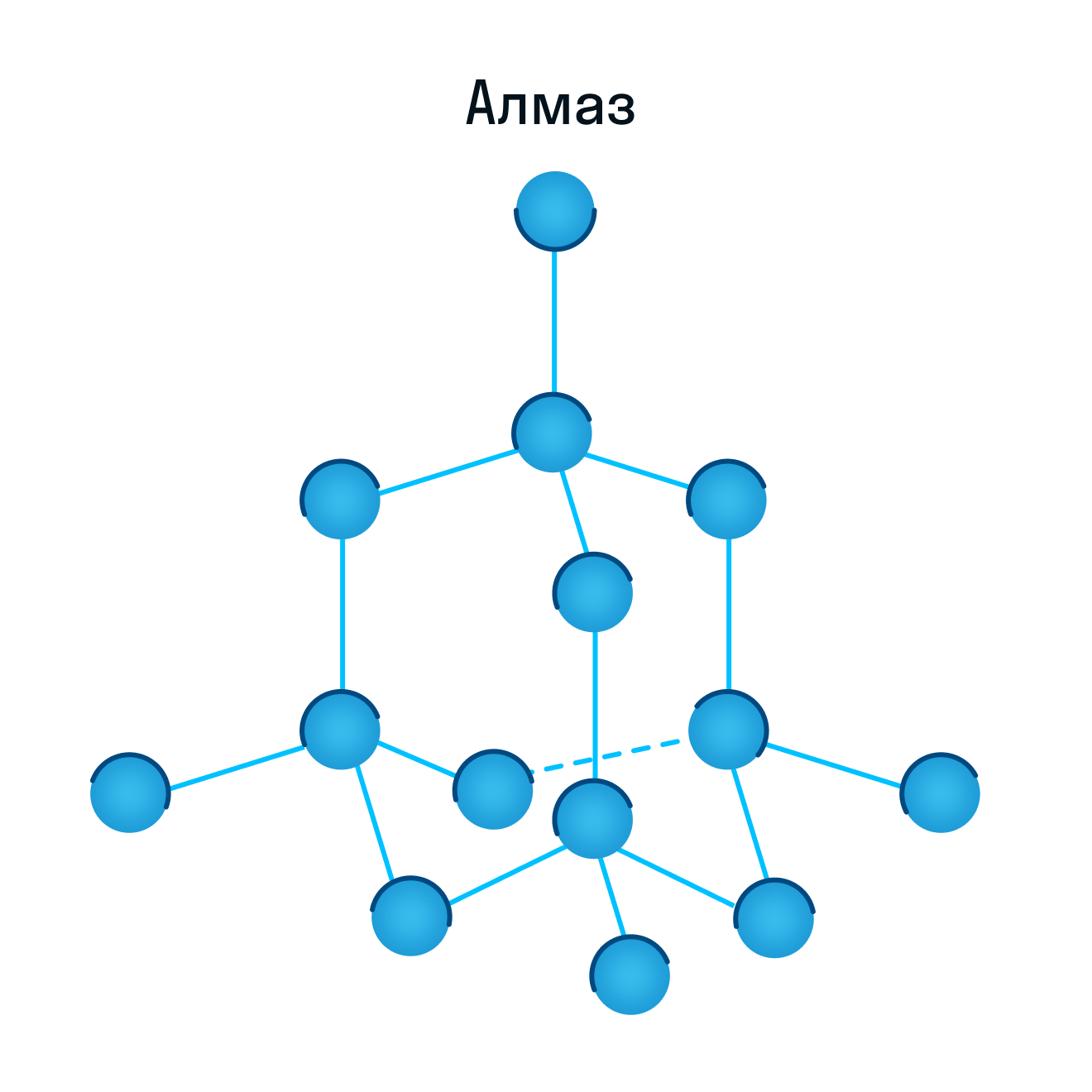
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, соединённые ковалентными связями. Такой тип решётки имеет алмаз — одно из аллотропных видоизменений углерода. К веществам с атомной кристаллической решёткой относятся графит, кремний, бор и германий, а также сложные вещества, например, кварц, горный хрусталь, песок. У веществ с атомной кристаллической решёткой очень высокие температуры плавления и кипения. Например, температура плавления кремнезёма — 1728 °С, а у графита она выше — 4000 °С.
Молекулярными называют решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием. Несмотря на то, что внутри молекул атомы соединены очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому молекулярные кристаллы имеют небольшую прочность и твёрдость, низкие температуры плавления и кипения. Многие молекулярные вещества при комнатной температуре представляют собой жидкости и газы.
Кристаллическая решетка
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Что такое кристаллическая решетка
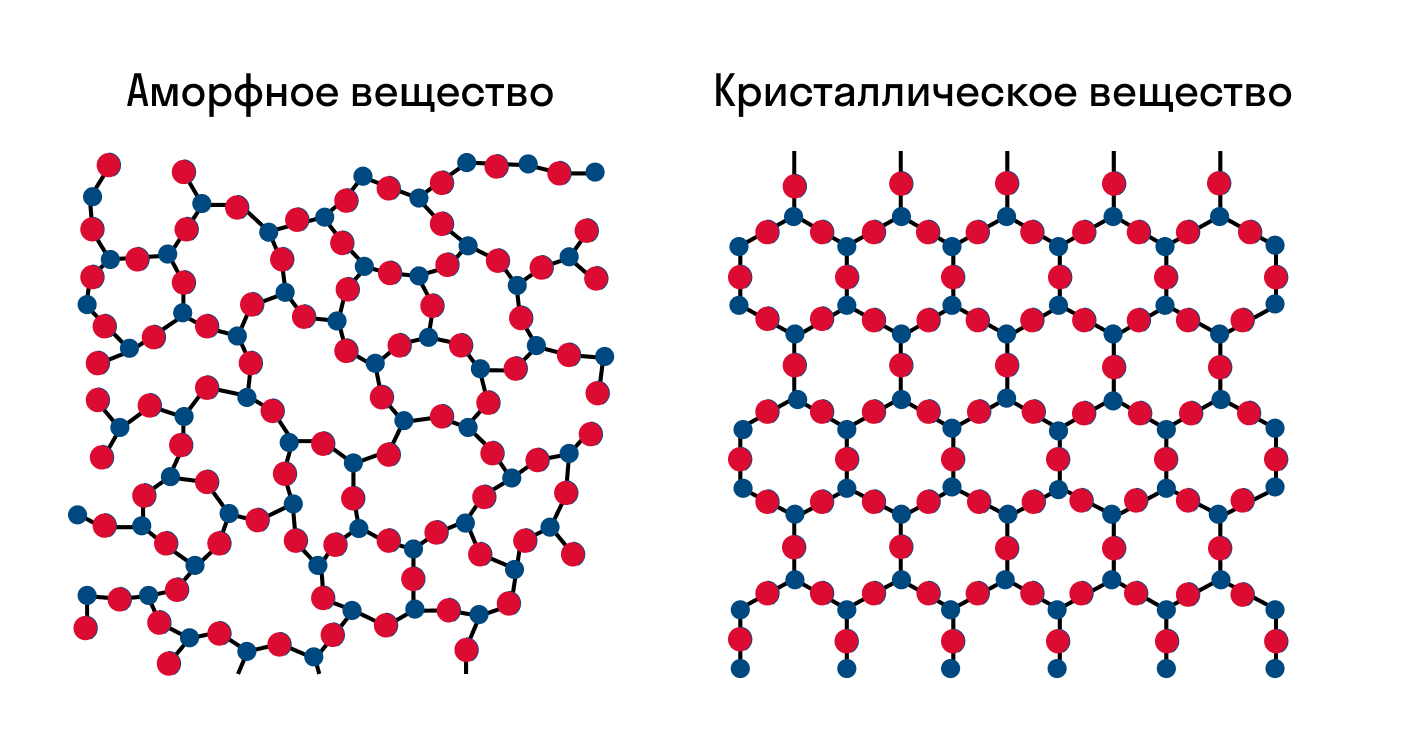
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).
Строение и агрегатное состояние веществ
Выделяют три агрегатных состояния: твердое тело, жидкость и газ. Каждое из них предполагает определенное расположение частиц. Ниже мы расскажем подробнее, как связаны в химии кристаллическая решетка и агрегатное состояние вещества, а пока осветим общие закономерности.
Если частицы хаотично движутся, а расстояние между ними многократно превышает их собственные размеры — это газ. За счет большой удаленности друг от друга молекулы и атомы в таком веществе слабо взаимодействуют между собой.
Если частицы расположены все так же беспорядочно, но на небольшом расстоянии друг от друга — это жидкость. В жидком состоянии вещества его молекулы и атомы имеют более прочные связи, которые сложнее разорвать.
Если частицы собраны близко друг к другу и в определенном порядке — это твердое тело. В таком состоянии связи между ними наиболее прочны. Частицы могут двигаться только в пределах своего расположения и почти не перемещаются в пространстве.
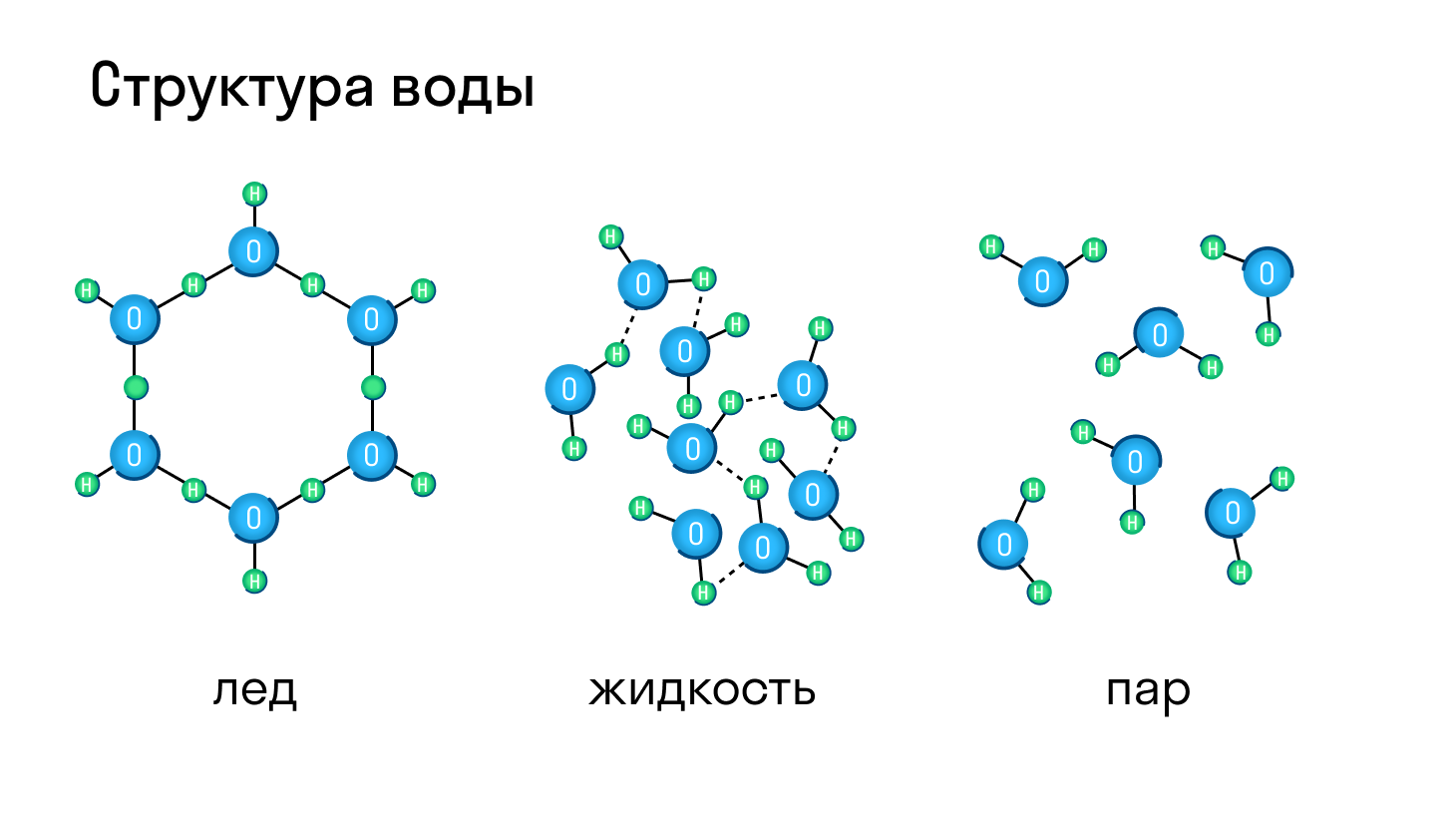
Большинство веществ могут находиться и в твердом, и в жидком, и газообразном состоянии, а в зависимости от давления и температуры легко переходить из одного в другое. Типичный пример — вода, которая при нагревании превращается в пар, а при остывании становится твердым льдом.
Атомная кристаллическая решетка
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
неспособность к растворению в воде,
высокая температура кипения и плавления.
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC. Типичный представитель этой группы — обычный песок, который по сути является оксидом кремния SiO2.
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
Свойства молекулярных веществ:
у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
Ионная кристаллическая решетка
Как известно, в ходе ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
способность растворяться в воде.
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.
Металлическая кристаллическая решетка
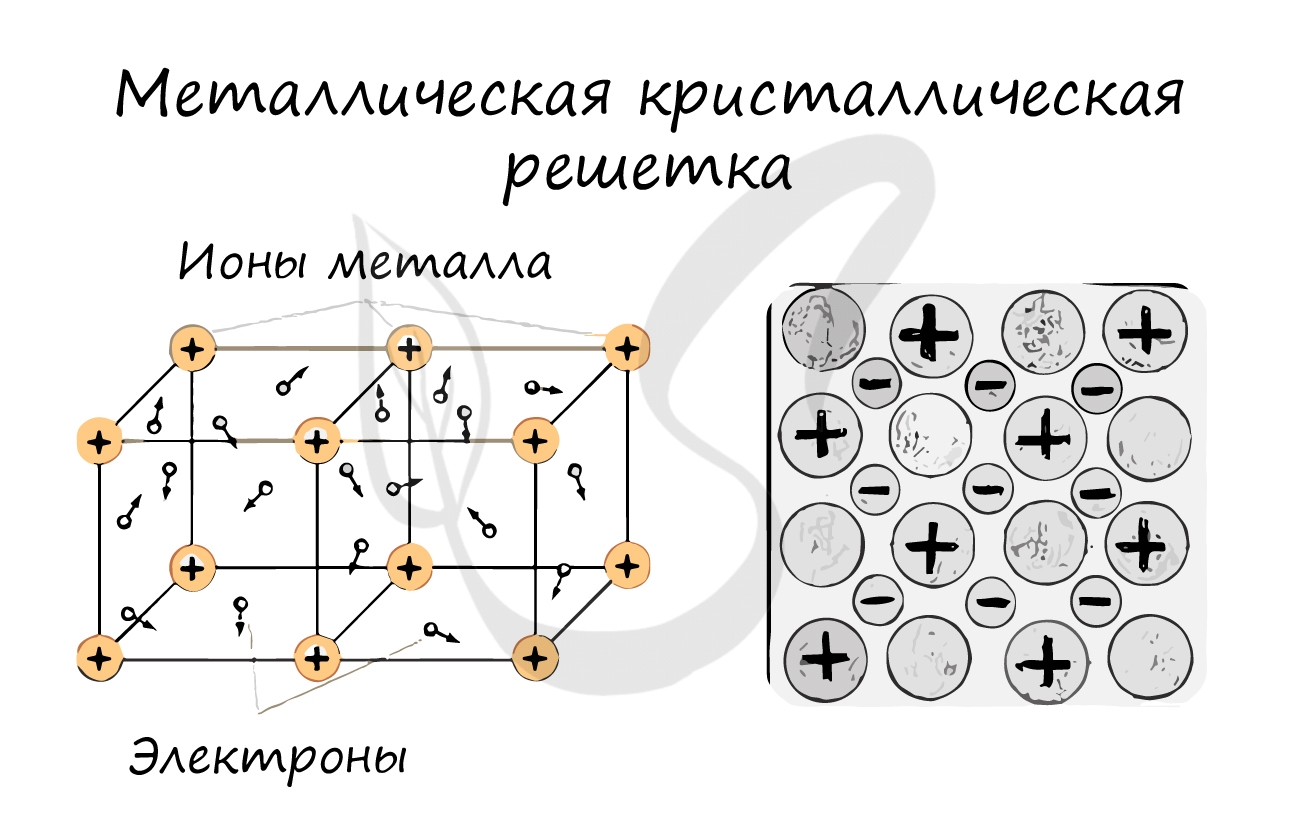
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Частицы в узлах решетки
Тип связи между частицами
Физические свойства веществ
Как определить кристаллическую решетку
Как понятно из предыдущего материала, строение вещества, его состав и физические характеристики тесно связаны. Поэтому для определения вида кристаллической решетки можно руководствоваться теми данными, которые у нас есть. Как правило, известен состав вещества, а значит, мы можем сделать вывод о химических связях внутри его молекулы, что позволит в свою очередь предположить тип решетки.
Также можно провести быстрый анализ:
если это неметалл, который при комнатной температуре представляет собой твердое тело — скорее всего он имеет атомную решетку;
если в обычных условиях это жидкость или газ либо речь об органическом веществе — предполагаем молекулярную решетку;
если это соль либо щелочь — кристаллы имеют ионную решетку;
если это металл или сплав — решетка точно будет металлической.
Вопросы для самопроверки:
Назовите виды кристаллических решеток.
Чем отличается кристаллическая решетка от химической связи?
Назовите примеры веществ с металлической кристаллической решеткой, с ионной, атомной и молекулярной.
Выберите лишнее вещество: молекулярную кристаллическую решетку имеет вода, поваренная соль, аргон, криптон.
Какое строение вещества придает ему высокую электропроводность?
Какое строение кристалла может придать веществу способность к возгонке?
 masterok
masterok
Мастерок.жж.рф
Хочу все знать
Всем специалистам в области кристаллографии или физики твердого тела совершенно ясно, что в случае кристалла мы имеем дело с упорядоченным расположением в пространстве атомов или ионов. В некоторых случаях, например в кристаллах льда или отвержденных газов, речь может идти о молекулах. Для краткости далее будем говорить только об атомах, в том числе ионизированных (ионах), если не оговаривается что-нибудь другое.
Итак, кристалл — это упорядоченная в пространстве система атомов. Они расположены правильным образом и чаще всего так, чтобы максимально плотно заполнить объем пространства. Попытавшись расположить вплотную друг к другу стальные шарики от шарикоподшипника, мы получим вполне приличную модель кристаллического строения и быстро убедимся, что число способов, которыми можно разместить шарики, ограничено. В зависимости от того, как расположены относительно друг друга атомные ряды и атомные плоскости, могут быть получены разные типы кристаллов. В свою очередь тип расположения атомов определяется их взаимодействием между собой, природой связи между частицами.
Аккуратное разламывание кристаллов приводит к появлению необычных структур с интересными свойствами. Сначала появляются крупные области с положительным или отрицательным поверхностным зарядом, создающие мощное электрическое поле, а затем они переходят в лабиринты шириной всего в несколько атомов.
Многие свойства ионных кристаллов обусловлены их структурой на атомарном масштабе: положительно и отрицательно заряженные атомы притягиваются друг к другу и образуют прочную периодическую решетку. Однако на поверхности кристалла заряды должны быть скомпенсированы. «Если расщепить кристалл с кубической решеткой вдоль определенных направлений, то можно получить заряды только одного типа, — поясняет один из авторов работы Ульрих Дибольд из Венского университета. — Такая конфигурация крайне нестабильна». Потенциально такой слой мог бы на крошечном образце создавать поле с напряжением в миллионы вольт. Такую ситуацию ученые называют «поляризационной катастрофой».
В новом исследовании физики пытались понять, как именно атомы реорганизуются, чтобы не допустить поляризационной катастрофы. «Поверхность может по-разному измениться в ответ на разлом, — говорит первый автор статьи Мартин Сетвин. — Электроны могут начать накапливаться в определенных местах, кристаллическая решетка может исказиться или молекулы из воздуха могут налипнуть на поверхность, меняя ее свойства».
Ученые раскалывали кристаллы танталата калия KTaO3 при низких температурах и получали сколы, при которых половина атомов из слоя с одинаковыми зарядами оставалось на одном обломке, а вторая — на другом. Области с ионами одинакового заряда формировали «островки», хотя в среднем поверхность оказывалась нейтральной. «Тем не менее, островки достаточно велики, поэтому поляризационной катастрофы не удается полностью избежать — создаваемое ими поле настолько велико, что оно меняет свойства нижележащих слоев», — рассказал Сетвин.
При небольшом повышении температуры островки распались на лабиринт из ломаных линий, причем его «стены» были высотой всего в один атом и шириной в 4-5 атомов.
«Лабиритнообразные структуры не только прекрасны, но и потенциально полезны, — подытожил Дибольд. — Этот как раз то, что нужно — сильные электрические поля на атомном масштабе». Одним из возможных применений авторы называют проведение химических реакций, которые не проходят в других условиях, например, расщепление воды для получения водорода.
Основные свойства кристаллов – анизотропность, однородность, способность к самоогоранению и наличие постоянной температуры плавления определяются их внутренним строением.
Анизотропность
Это свойство называется еще неравносвойственностью. Выражается она в том, что физические свойства кристаллов (твердость, прочность, теплопроводность, электропроводность, скорость распространения света) неодинаковы по разным направлениям. Частицы, образующие кристаллическую структуру по непараллельным направлениям, отстоят друг от друга на разных расстояниях, вследствие чего и свойства кристаллического вещества по таким направлениям должны быть различными. Характерным примером вещества с ярко выраженной анизотропностью является слюда. Кристаллические пластинки этого минерала легко расщепляются лишь по плоскостям, параллельным его пластинчастости. В поперечных же направлениях расщепить пластинки слюды значительно труднее.
Анизотропность проявляется и в том, что при воздействии на кристалл какого-либо растворителя скорость химических реакций различна по различным направлениям. В результате каждый кристалл при растворении приобретает свои характерные формы, носящие название фигур вытравливания.
Аморфные вещества характеризуются изотропностью (равносвойственностью) – физические свойства по всем направлениям проявляются одинаково.
Однородность
Выражается в том, что любые элементарные объемы кристаллического вещества, одинаково ориентированные в пространстве, абсолютно одинаковы по всем своим свойствам: имеют один и тот же цвет, массу, твердость и т.д. таким образом, всякий кристалл есть однородное, но в то же время и анизотропное тело.
Однородность присуща не только кристаллическим телам. Твердые аморфные образования также могут быть однородными. Но аморфные тела не могут сами по себе принимать многогранную форму.
Способность к самоогранению
Способность к самоогранению выражается в том, что любой обломок или выточенный из кристалла шарик в соответствующей для его роста среде с течением времени покрывается характерными для данного кристалла гранями. Эта особенность связана с кристаллической структурой. Стеклянный же шарик, например, такой особенностью не обладает.
Кристаллы одного и того же вещества могут отличаться друг от друга своей величиной, числом граней, ребер и формой граней. Это зависит от условий образования кристалла. При неравномерном росте кристаллы получаются сплющенными, вытянутыми и т.д. Неизменными остаются углы между соответственными гранями растущего кристалла. Эта особенность кристаллов известна как закон постоянства гранных углов. При этом величина и форма граней у различных кристаллов одного и того же вещества, расстояние между ними и даже их число могут меняться, но углы между соответствующими гранями во всех кристаллах одного и того же вещества остаются постоянными при одинаковых условиях давления и температуры.
Закон постоянства гранных углов было установлен в конце XVII века датским ученым Стено (1699) на кристаллах железного блеска и горного хрусталя, впоследствии этот закон был подтвержден М.В. Ломоносовым (1749) и французским ученым Роме де Лиллем (1783). Закон постоянства гранных углов получил название первого закона кристаллографии.
Закон постоянства гранных углов объясняется тем, что все кристаллы одного вещества тождественны по внутреннему строению, т.е. имеют одну и ту же структуру.
Согласно этому закону кристаллы определенного вещества характеризуются своими определенными углами. Поэтому измерением углов можно доказать принадлежность исследуемого кристалла к тому или иному веществу. На этом основан один из методов диагностики кристаллов.
Для измерения у кристаллов двугранных углов были изобретены специальные приборы – гониометры.
Постоянная температура плавления
Выражается в том, что при нагревании кристаллического тела температура повышается до определенного предела; при дальнейшем же нагревании вещество начинает плавиться, а температура некоторое время остается постоянной, так как все тепло идет на разрушение кристаллической решетки. Температура, при которой начинается плавление, называется температурой плавления.
Аморфные вещества в отличие от кристаллических не имеют четко выраженной температуры плавления. На кривых охлаждения (или нагревания) кристаллических и аморфных веществ, можно видеть, что в первом случае имеются два резких перегиба, соответствующие началу и концу кристаллизации; в случае же охлаждения аморфного вещества мы имеем плавную кривую. По этому признаку легко отличить кристаллические вещества от аморфных.
Прочность кристаллов
Проблема прочности кристаллов была и остается одной из самых важных в современных технике. Дело в том, что широко используемые конструкционные материалы в большей части представляют собой сплавы железа (сталь), алюминия (силумин, дюралюминий), меди (латунь, бронза) и некоторых других металлов, и все они имеют кристаллическое строение. В случае металлов мы редко имеем дело с такими правильными и красивыми кристаллами, о которых шла речь раньше. Металлические сплавы имеют так называемое поликристаллическое строение, то есть состоят из отдельных зерен — кристаллов, несколько развернутых друг относительно друга.
Шаг за шагом человек переходил от менее прочного материала к более прочному, это вело к совершенствованию всей используемой техники и расширению ее возможностей. Сейчас в борьбе за прочность счет идет уже только на проценты; из технических материалов выжато практически все, что можно, и каждый последующий шаг дается со все большим трудом.
Лет двадцать назад казалось, что если научиться выращивать бездефектные кристаллы большого размера, то проблема прочности будет полностью решена, а расход металла в сотни раз сократится. К сожалению, эти надежды не сбылись. Вырастить идеальный кристалл большого размера или очень дорого, или невозможно. Только в таких областях, как радиоэлектроника, это можно себе позволить. Например, полупроводниковые кристаллы Ge и Si выращиваются практически бездефектными. Такими же являются и рубиновые кристаллы для лазеров. Что же касается конструкционных материалов, то здесь пока приходится достигать высоких значений прочности, идя традиционным путем.
И еще одно важное заключение. Оказывается, что многие физические свойства кристаллов, в первую очередь их прочность, определяются не идеальной кристаллической решеткой, а отклонениями от идеальности — дефектной структурой. Умелое использование таких пороков кристалла позволяет управлять его свойствами и приспосабливать их к разнообразным требованиям современной техники. Для физика или инженера дефекты являются очень важной составной частью кристалла, без которой он практически не может существовать. Но тема дефектов в кристаллах заслуживает более глубокого и всестороннего обсуждения, чем то, которое возможно в этой статье.
Кристаллические решетки
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
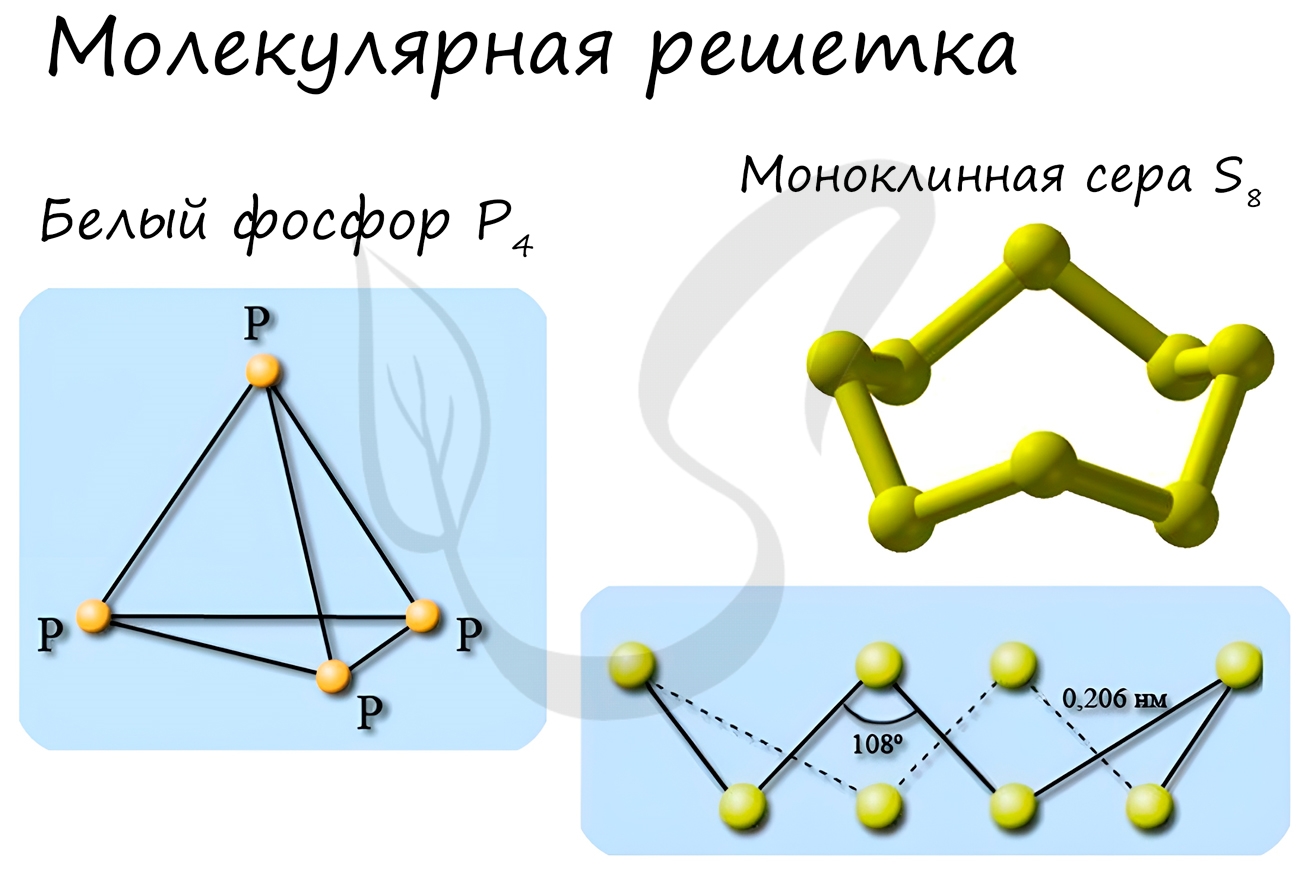
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.







 masterok
masterok