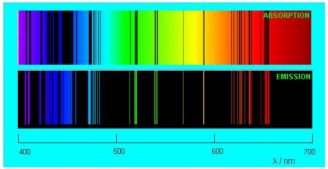
Чем отличаются спектры испускания и поглощения
Линейчатые спектры
теория по физике 🧲 оптика
Если пропустить солнечный свет через стеклянную призму или дифракционную решётку, то на экране получится хорошо известный нам спектр. Спектр, который вы видите ниже, называется непрерывным спектром. Он представляет собой сплошную полосу, состоящую из разных цветов, плавно переходящих друг в друга.
Непрерывный (сплошной) спектр — разновидность спектра, в которой присутствуют все длины волн видимого диапазона (от красной границы до фиолетовой).
Излучения, обладающие непрерывным спектром:
Пример №1. Будет ли излучать свет в непрерывном спектре спираль работающей электроплиты?
В данном случае да, поскольку спирать — твердое тело, нагретое до высокой температуры.
Линейчатый спектр и его виды
Картина резко меняется, когда мы наблюдаем свечение, излучаемое разреженными газами. Спектр перестает быть непрерывным: в нём появляются разрывы, которые увеличиваются по мере разрежения газа. В предельном случае чрезвычайно разреженного атомарного газа спектр становится линейчатым.
Линейчатый спектр — спектр, который состоит из отдельных достаточно тонких линий.
Линейчатый спектр бывает двух видов:
Спектр испускания
Предположим, что газ состоит из атомов некоторого химического элемента и разрежен настолько, что атомы почти не взаимодействуют друг с другом. Раскладывая в спектр излучение такого газа (нагретого до очень высокой температуры), мы сможем наблюдать такую картину, как на картинке ниже.
Спектр испускания — линейчатый спектр, который состоит из тонких изолированных разноцветных линий, соответствующих тем длинам волн света, который излучается атомами.
Любой атомарный разреженный газ излучает свет с линейчатым спектром. Но наибольшую важность имеет то, что для любого химического элемента спектр испускания является уникальным. Поэтому по нему можно устанавливать, какой химический элемент находится перед нами. Он является своего рода идентификатором.
Поскольку газ разрежен и атомы мало взаимодействуют друг с другом, мы можем сделать следующий вывод:
Свет излучают атомы сами по себе. Следовательно, каждый атом характеризуется дискретным, строго определённым набором длин волн излучаемого света. У каждого химического элемента этот набор свой.
Спектр поглощения
Атомы излучают свет в процессе перехода из возбуждённого состояния в основное. Но вещество может не только излучать, но и поглощать свет. При поглощении света атом совершает обратный процесс — он переходит из основного состояния в возбуждённое.
Снова рассмотрим разреженный атомарный газ, но теперь в охлажденном состоянии (при довольно низкой температуре). Свечения газа в этом случае мы не увидим. В не нагретом состоянии газ не излучает свечение, так как атомов в возбуждённом состоянии оказывается для этого слишком мало.
Если сквозь охлажденный газ пропустить свет с непрерывным спектром, мы увидим следующую картину (см. рисунок ниже).
Спектр поглощения — темные линии на фоне непрерывного спектра, соответствующие тем длинам волн света, которые поглощаются атомами и излучаются впоследствии при сильном нагревании.
Объясним, откуда берутся темные линии. Под действием падающего света газовые атомы переходят в возбуждённое состояние. При этом оказывается, что для возбуждения атомов нужны не любые длины волн, а лишь некоторые, строго определённые для данного вида газа. Именно эти длины волн газ поглощает из падающего на него света.
Внимание! Газ поглощает те длины волн, которые излучает сам. Поэтому, цветные линии на спектре испускания соответствуют темным линиям на спектре поглощения. Если их сложить, можно получить непрерывный спектр.
На рисунке ниже сопоставлены спектры испускания и поглощения разреженных паров натрия.
Глядя на спектры испускания и поглощения, ученые XIX века пришли к выводу, что атом не является неделимой частицей и обладает некоторой внутренней структурой. Ведь что-то внутри атома должно обеспечивать процессы излучения и поглощения света.
Кроме того, уникальность атомных спектров говорит о том, что этот механизм различен у атомов разных химических элементов. Поэтому атомы разных химических элементов должны отличаться по своему внутреннему устройству.
Спектральный анализ
Использование линейчатых спектров в качестве идентификаторов химических элементов лежит в основе спектрального анализа.
Спектральный анализ — метода исследования химического состава вещества по его спектру.
Идея спектрального анализа заключается в следующем. Спектр излучения исследуемого вещества сопоставляется с эталонными спектрами химических элементов. Затем делается вывод о присутствии или отсутствии различных химических элементов в исследуемом образце. При определённых условиях посредством спектрального анализа можно определить химический состав не только качественно, но и количественно.
В результате наблюдения различных спектров были открыты новые химические элементы. Первыми из таких элементов были цезий и рубидий. Названия эти элементы получили по цвету линий своего спектра. Так, в спектре цезия больше всего выражены две линии небесно-синего цвета, который на латинском языке звучит как caesius. Рубидий же даёт две отчетливые линии рубинового цвета.
В 1868 году в спектре солнечного света были обнаружены линии, не соответствующие ни одному из известных химических элементов. Этот элемент был назван гелием (от греческого гелиос — солнце). Впоследствии гелий был найден в атмосфере нашей планеты. Спектральный анализ излучения Солнца и других звезд показал, что все входящие в их состав входят элементы имеются и на Земле. Таким образом, оказалось, что все объекты Вселенной собраны из одного и того же набора элементов.
Пример №2. Какую картинку можно получить, если провести спектральный анализ вещества, состоящего из двух химических элементов?
Спектры испускания и спектры поглощения будут накладываться друг на друга. В итоге можно будет получить спектр испускания, в котором будут присутствовать все длины волн, соответствующие тем, что испускаются первым и вторым химическим элементом. В спектре поглощения эти же длины волн будут отсутствовать.
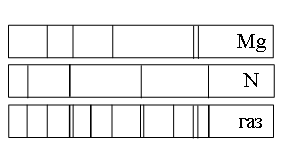
а) азота (N), магния (Mg) и другого неизвестного вещества
в) только магния (Mg)
г) только магния (Mg) и азота (N)
Алгоритм решения
Решение
Если спектр поглощения неизвестного газа содержит все линии, которые есть на спектре известного элемента, то этот газ содержит этот элемент.
Видно, что спектр поглощения неизвестного газа включает в себя все линии, которые есть в спектре поглощения магния. Следовательно, этот газ содержит магний.
Видно, что спектр поглощения неизвестного газа включает в себя все линии, которые есть в спектре поглощения азота. Следовательно, этот газ также содержит азот.
Но кроме линий, соответствующих азоту и магнию, на спектре поглощения газа наблюдаются другие линии. Следовательно, газ содержит как минимум еще один элемент.
pазбирался: Алиса Никитина | обсудить разбор | оценить
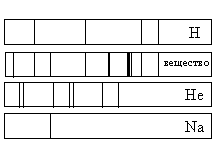
а) только натрий (Na) и водород (Н)
б) только водород (Н) и гелий (Не)
в) водород (Н), гелий (Не) и натрий (Na)
г) натрий (Na), водород (H) и другие элементы, но не гелий (He)
Алгоритм решения
Решение
Если спектр поглощения неизвестного газа содержит все линии, которые есть на спектре известного элемента, то этот газ содержит данный элемент.
Видно, что спектр поглощения неизвестного вещества включает в себя все линии, которые есть в спектре поглощения водорода и натрия. Но линий, соответствующих спектру поглощения гелия, в нем нет. Следовательно, это вещество содержит водород, натрий, но не содержит гелий.
Кроме линий, соответствующих водороду и натрию, на спектре поглощения вещества наблюдаются другие линии. Следовательно, оно содержит как минимум еще один элемент.
pазбирался: Алиса Никитина | обсудить разбор | оценить

Можно утверждать, что в неизвестном образце
а) не содержится стронция
б) не содержится кальция
в) содержатся кальций и ещё какие-то элементы
г) содержится только кальций
Алгоритм решения
Решение
Если спектр излучения неизвестного образца содержит все линии, которые есть на спектре излучения известного элемента, то этот образец содержит данный элемент.
Видно, что спектр излучения неизвестного образца включает в себя все линии, которые есть в спектре излучения стронция. Но линий, соответствующих спектру излучения кальция, в нем нет. Следовательно, этот образец не содержит кальций.
Кроме линий, соответствующих стронцию, на спектре излучения неизвестного образца наблюдаются другие линии. Следовательно, он содержит как минимум еще один элемент.
Из всех перечисленных утверждений верным является только одно — образец не содержит кальция.
pазбирался: Алиса Никитина | обсудить разбор | оценить
В чём разница между спектром излучения и спектром поглощения?
Основные различия
Спектры поглощения и излучения дают полный спектр света, прошедшего через вещество (то есть те длины, которые отсутствуют в спектре поглощения, находятся в спектре излучения и наоборот).
Спектр поглощения
Изображения спектра поглощения химического соединения представляют собой полосы с линейной или непрерывной структурой с более или менее выраженными крайностями.
Спектр излучения
Спектры излучения возникают, когда электрически заряженные электроны, атомы, частицы или фрагменты молекул, образующих данное тело, будучи возбужденными, переходят из состояния с более высокой энергией в состояние с более низкой энергией. Этот переход сопровождается излучением кванта электромагнитного излучения с энергией, равной разности энергий уровней, между которыми проходила частица.
Для газов с простым атомом спектр излучения часто принимает форму ряда хорошо разделенных частот, которые спектрометры записывают в виде полос. Расположение этих полос ясно указывает на наличие определенного элемента в газе и называется атомным спектром. Это позволяет, среди прочего определение на основе спектров излучения элементного состава далеких небесных тел. Спектр излучения непрерывен для твердых тел и жидкостей. Зонный спектр получен для атомных газов со сложной структурой.
Разница между спектрами поглощения и излучения
Структура атома включает в себя центральное ядро, называемое ядром, и облако электронов вокруг ядра. Согласно современной атомной теории, эти электроны расположены на определенных энергетических уров
Содержание:
Структура атома включает в себя центральное ядро, называемое ядром, и облако электронов вокруг ядра. Согласно современной атомной теории, эти электроны расположены на определенных энергетических уровнях, называемых оболочками или орбиталями, где их энергии квантованы. Известно, что оболочка, ближайшая к ядру, обладает самой низкой энергией. Когда энергия передается атому извне, это заставляет электроны прыгать с одной оболочки на другую. Эти движения могут быть использованы для получения спектров поглощения и излучения. Спектры как поглощения, так и излучения являются линейными. Основное различие между спектрами поглощения и излучения состоит в том, что спектры поглощения показывают черные цветные промежутки / линии в то время как Спектры излучения показывают разноцветные линии в спектрах.
Ключевые области покрыты
1. Что такое спектры поглощения
— определение, характеристики
2. Что такое эмиссионные спектры
— определение, характеристики
3. В чем разница между спектрами поглощения и излучения
— Сравнение основных различий
Ключевые слова: атом, спектры поглощения, спектры излучения, орбиталь, фотон, оболочка
Что такое спектры поглощения
Спектр поглощения можно определить как спектр, полученный путем передачи электромагнитного излучения через вещество. Характерной особенностью спектров поглощения является то, что на спектре показаны темные линии.
Спектр поглощения является результатом поглощения фотонов атомами, присутствующими в веществе. Когда вещество подвергается воздействию источника электромагнитного излучения, такого как белый свет, оно может получить спектры поглощения. Если энергия фотона такая же, как энергия между двумя энергетическими уровнями, то энергия фотона поглощается электроном на более низком энергетическом уровне. Это поглощение вызывает увеличение энергии этого конкретного электрона. Тогда энергия этого электрона высока. Таким образом, он прыгает на более высокий энергетический уровень. Но если энергия фотона не равна разности энергий между двумя энергетическими уровнями, фотон не будет поглощен.
Тогда передача излучения через вещество дает цветные полосы, которые соответствуют фотонам, которые не были поглощены; темные линии указывают на фотоны, которые были поглощены. Энергия фотона задается как;
E = hc / λ
Следовательно, энергия обратно пропорциональна длине волны электромагнитного излучения. Поскольку непрерывный спектр источника света задается как диапазон длин волн электромагнитного излучения, могут быть найдены недостающие длины волн. Уровни энергии и их положения в атоме также могут быть определены из этого. Это указывает на то, что спектр поглощения специфичен для конкретного атома.
Рисунок 1: Спектр поглощения нескольких элементов
Что такое эмиссионные спектры
Спектр излучения может быть определен как спектр электромагнитного излучения, испускаемого веществом. Атом испускает электромагнитное излучение, когда он приходит в стабильное состояние из возбужденного состояния. Возбужденные атомы имеют более высокую энергию. Чтобы стать стабильными, атомы должны прийти в более низкое энергетическое состояние. Их энергия высвобождается в виде фотонов. Эта коллекция фотонов вместе делает спектр, известный как спектр излучения.
Спектр излучения показывает цветные линии или полосы в спектре, потому что выпущенные фотоны имеют определенную длину волны, соответствующую этой конкретной длине волны непрерывного спектра. Следовательно, цвет этой длины волны в непрерывном спектре показан спектром излучения.
Спектр излучения является уникальным для вещества. Это связано с тем, что спектр излучения точно противоположен спектру поглощения.
Рисунок 2: Спектр эмиссии гелия
Разница между спектрами поглощения и излучения
Определение
Спектры поглощения: Спектр поглощения можно определить как спектр, полученный путем передачи электромагнитного излучения через вещество.
Спектры эмиссии: Спектр излучения может быть определен как спектр электромагнитного излучения, испускаемого веществом.
Энергопотребление
Спектры поглощения: Спектр поглощения создается, когда атомы поглощают энергию.
Спектры эмиссии: Спектр излучения создается, когда атомы выделяют энергию.
Внешность
Спектры поглощения: Спектры поглощения показывают темные линии или разрывы.
Спектры эмиссии: Спектры излучения показывают цветные линии.
Энергия атома
Спектры поглощения: Атом получает более высокий энергетический уровень, когда этот атом дает спектр поглощения.
Спектры эмиссии: Спектр излучения дается, когда возбужденный атом получает более низкий энергетический уровень.
длина волны
Спектры поглощения: Спектры поглощения учитывают длины волн, поглощаемые веществом.
Спектры эмиссии: Спектры излучения учитывают длины волн, излучаемых веществом.
Резюме
Линейные спектры очень полезны при определении неизвестного вещества, потому что эти спектры уникальны для конкретного вещества. Основными типами спектров являются непрерывные спектры, спектры поглощения и эмиссионные спектры. Основное различие между спектрами поглощения и эмиссии состоит в том, что спектры поглощения показывают черные цветные промежутки / линии, тогда как спектры эмиссии показывают разные цветные линии.
Рекомендации:
1. «Спектры поглощения и эмиссии». Кафедра астрономии и астрофизики. Н.п., н.д. Web.